СДХА
| СДХА | |||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Идентификаторы | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Псевдонимы | SDHA , CMD1GG, FP, PGL5, SDH1, SDH2, SDHF, флавопротеиновая субъединица А комплекса сукцинатдегидрогеназы, MC2DN1, NDAXOA | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Внешние идентификаторы | ОМИМ : 600857; МГИ : 1914195; Гомологен : 3073; GeneCards : SDHA; OMA :SDHA – ортологи | ||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Викиданные | |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
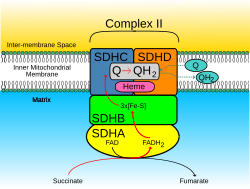
Комплекс сукцинатдегидрогеназы, субъединица А, вариант флавопротеина — это белок , который у людей кодируется геном SDHA . [5] Этот ген кодирует основную каталитическую субъединицу сукцинат-убихиноноксидоредуктазы , комплекса митохондриальной дыхательной цепи. Комплекс состоит из четырех ядерно-кодируемых субъединиц и локализован во внутренней мембране митохондрий. SDHA содержит сайт связывания FAD , где сукцинат депротонируется и превращается в фумарат . Мутации в этом гене связаны с формой дефицита митохондриальной дыхательной цепи, известной как синдром Лея. На хромосоме 3q29 был идентифицирован псевдоген . Для этого гена были обнаружены альтернативно сплайсированные варианты транскриптов, кодирующие различные изоформы. [6]
Структура
Ген SDHA расположен на плече p хромосомы 5 в локусе 15 и состоит из 17 экзонов. [6] Белок SDHA, кодируемый этим геном, имеет длину 664 аминокислоты и весит 72,7 кДа. [7] [8]
Белок SDHA имеет четыре субдомена, включая кэпирующий домен, спиральный домен, C-концевой домен и, что наиболее важно, β-бочонок FAD-связывающего домена на N-конце . Таким образом, SDHA является флавопротеином (Fp) из-за простетической группы флавинадениндинуклеотида (FAD). Кристаллическая структура предполагает, что FAD ковалентно связан с остатком гистидина (His99) и далее координируется водородными связями с рядом других аминокислотных остатков в пределах FAD-связывающего домена. FAD, который получен из рибофлавина (витамина B2 ) , является, таким образом, необходимым кофактором для SDHA и всей функции комплекса II. [9]
Функция

Комплекс SDH расположен на внутренней мембране митохондрий и участвует как в цикле лимонной кислоты, так и в дыхательной цепи . Комплекс белка сукцинатдегидрогеназы (SDH) катализирует окисление сукцината (сукцинат + убихинон => фумарат + убихинол). Электроны, удаленные от сукцината, переносятся на SDHA, переносятся через SDHB через кластеры железа и серы к субъединицам SDHC / SDHD на гидрофобном конце комплекса, закрепленного в митохондриальной мембране.
Первоначально SDHA окисляет сукцинат посредством депротонирования в месте связывания FAD , образуя FADH 2 и оставляя фумарат , слабо связанный с активным сайтом, свободным для выхода из белка. Электроны, полученные из сукцината, туннелируют вдоль реле [Fe-S] в субъединице SDHB , пока не достигнут кластера железа и серы [3Fe-4S] . Затем электроны переносятся на ожидающую молекулу убихинона в активном центре пула Q в димере SDHC/SDHD. Карбонильный кислород O1 убихинона ориентируется в активном центре посредством водородных связей с Tyr83 SDHD . Присутствие электронов в кластере железа и серы [3Fe-4S] вызывает перемещение убихинона во вторую ориентацию. Это облегчает второе взаимодействие водородной связи между карбонильной группой O4 убихинона и Ser27 SDHC . После первого шага восстановления одного электрона образуется радикальный вид семихинона . Второй электрон поступает из кластера [3Fe-4S] для обеспечения полного восстановления убихинона до убихинола . [10]
SDHA действует как промежуточное звено в основном действии фермента SDH:
- SDHA преобразует сукцинат в фумарат в рамках цикла лимонной кислоты . Эта реакция также преобразует FAD в FADH 2 .
- Электроны от FADH 2 переносятся на кластеры железа субъединицы SDHB [2Fe-2S],[4Fe-4S],[3Fe-4S]. Эта функция является частью дыхательной цепи
- Наконец, электроны переносятся в пул убихинона (Q) через субъединицы SDHC / SDHD .
Клиническое значение
Из-за сложности локуса SDHA, SDHA редко анализировался, [11] но в растущем количестве исследований было обнаружено, что мутации в SDHA являются патогенными для ряда состояний, включая синдром наследственной феохромоцитомы-параганглиомы (PPGL), дефицит митохондриального комплекса II, желудочно-кишечные стромальные опухоли, синдром Лея, дилатационную кардиомиопатию и возможную связь с аденомами гипофиза, карциномами надпочечников и другими нейроэндокринными опухолями. [12] Наследственный синдром PPGL, связанный с мутациями в SDHA, называется «Парагангиомы 5» с вероятной более низкой пенетрантностью, чем другие мутации SDHx. [13]
Известно, что биаллельные мутации в SDHA являются патогенными для синдрома Лея у младенцев или детей раннего возраста , прогрессирующего заболевания мозга. [14] [15] [16] Однако неизвестно, как мутации в гене SDHA связаны с конкретными признаками синдрома Лея. Существует некоторая связь между синдромом Лея как фенотипом дефицита митохондриального комплекса II, но оба могут возникать без другого, как связанные с мутациями SDHA. [17]
SDHA — ген-супрессор опухолей, и гетерозиготные носители имеют повышенный риск параганглиом , а также феохромоцитом и рака почек. [18] Управление рисками для гетерозиготных носителей мутации SDHA обычно включает мониторинг с помощью ежегодных анализов мочи на метанефрины и катехоламины, а также нерадиоактивную визуализацию, такую как МРТ. ПЭТ-сканирование и радиационная визуализация используются, но должны быть ограничены, чтобы предотвратить воздействие радиации. [19]
Интерактивная карта маршрутов
Нажмите на гены, белки и метаболиты ниже, чтобы перейти к соответствующим статьям. [§ 1]
- ^ Интерактивную карту путей можно редактировать на WikiPathways: «TCACycle_WP78».
Ссылки
- ^ abc GRCh38: Ensembl выпуск 89: ENSG00000073578 – Ensembl , май 2017 г.
- ^ abc GRCm38: Ensembl выпуск 89: ENSMUSG00000021577 – Ensembl , май 2017 г.
- ^ "Human PubMed Reference:". Национальный центр биотехнологической информации, Национальная медицинская библиотека США .
- ^ "Mouse PubMed Reference:". Национальный центр биотехнологической информации, Национальная медицинская библиотека США .
- ^ Hirawake H, Wang H, Kuramochi T, Kojima S, Kita K (июль 1994). «Комплекс II человека (сукцинат-убихинон оксидоредуктаза): клонирование кДНК субъединицы флавопротеина (Fp) митохондрий печени». Журнал биохимии . 116 (1): 221–7. doi :10.1093/oxfordjournals.jbchem.a124497. PMID 7798181.
- ^ ab "Ген Энтреза: комплекс сукцинатдегидрогеназы".
- ^ Zong NC, Li H, Li H, Lam MP, Jimenez RC, Kim CS и др. (октябрь 2013 г.). «Интеграция биологии и медицины сердечного протеома с помощью специализированной базы знаний». Circulation Research . 113 (9): 1043–53. doi :10.1161/CIRCRESAHA.113.301151. PMC 4076475. PMID 23965338 .
- ^ "SDHA - Сукцинатдегидрогеназа [убихинон] флавопротеиновая субъединица, митохондриальная". База знаний по атласу белков сердечной органеллы (COPaKB) .
- ^ Van Vranken JG, Na U, Winge DR, Rutter J (март–апрель 2015 г.). «Белково-опосредованная сборка сукцинатдегидрогеназы и ее кофакторов». Critical Reviews in Biochemistry and Molecular Biology . 50 (2): 168–80. doi :10.3109/10409238.2014.990556. PMC 4653115. PMID 25488574 .
- ^ Horsefield R, Yankovskaya V, Sexton G, Whittingham W, Shiomi K, Omura S и др. (март 2006 г.). «Структурный и вычислительный анализ участка связывания хинона комплекса II (сукцинат-убихинон оксидоредуктаза): механизм переноса электронов и протонной проводимости во время восстановления убихинона». Журнал биологической химии . 281 (11): 7309–16. doi : 10.1074/jbc.m508173200 . PMID 16407191.
- ^ Wagner AJ, Remillard SP, Zhang YX, Doyle LA, George S, Hornick JL (февраль 2013 г.). «Потеря экспрессии SDHA предсказывает мутации SDHA в желудочно-кишечных стромальных опухолях». Mod Pathol . 26 (2): 289–94. doi :10.1038/modpathol.2012.153. PMID 22955521.
- ^ "SDHA[ген] ▶ GRCh37". ClinVar . Национальная медицинская библиотека.
- ^ ван дер Туин К., Мензенкамп А.Р., Топс CM, Корссмит Э.П., Диньенс В.Н., ван де Хорст-Шрайверс А.Н., Янсен Дж.К., де Йонг М.М., Кунст Х.П., Кастерс Б., Литер Э.М., Морро Х., ван Нессельрой Б.М., Ольденбург Р.А. , Спруйт Л., Хес Ф.Дж., Тиммерс Х.Дж. (февраль 2018 г.). «Клинические аспекты феохромоцитомы и параганглиомы, связанных с SDHA: общенациональное исследование». J Clin Эндокринол Метаб . 103 (2): 438–445. дои : 10.1210/jc.2017-01762. ПМИД 29177515.
«ИСПРАВЛЕНИЕ ДЛЯ «Клинических аспектов феохромоцитомы и параганглиомы, связанных с SDHA: общенациональное исследование»". J Clin Endocrinol Metab . 103 (5): 2077. Май 2018. doi :10.1210/jc.2018-00533. PMID 29538659. - ^ "Синдром Ли". Genetics Home Reference . Национальная медицинская библиотека США . Получено 30 июля 2018 г.
- ^ Pagnamenta AT, Hargreaves IP, Duncan AJ, Taanman JW, Heales SJ, Land JM и др. (ноябрь 2006 г.). «Фенотипическая изменчивость митохондриальных заболеваний, вызванных ядерной мутацией в комплексе II». Молекулярная генетика и метаболизм . 89 (3): 214–21. doi :10.1016/j.ymgme.2006.05.003. PMID 16798039.
- ^ Van Coster R, Seneca S, Smet J, Van Hecke R, Gerlo E, Devreese B и др. (июль 2003 г.). «Гомозиготная мутация Gly555Glu в гене флавопротеина 70 кДа, кодируемом ядерным кодом, вызывает нестабильность комплекса II дыхательной цепи». American Journal of Medical Genetics. Часть A. 120A ( 1): 13–8. doi : 10.1002/ajmg.a.10202. PMID 12794685. S2CID 30987591.
- ^ Fullerton M, McFarland R, Taylor RW, Alston CL (2020). «Генетическая основа дефицита изолированного митохондриального комплекса II». Mol Genet Metab . 131 (1–2): 53–65. doi :10.1016/j.ymgme.2020.09.009. PMC 7758838. PMID 33162331 .
- ^ Ссылка, Genetics Home. "SDHA". Genetics Home Reference . Получено 2016-08-31 .
- ^ «SDHA, SDHB или SDHC-связанная семейная параганглиома-феохромоцитома – управление рисками». eviQ Cancer Treatments Online . Cancer Institute NSW. 22 февраля 2022 г. 4066 v.3.
Дальнейшее чтение
- Aboulaich N, Vainonen JP, Strålfors P, Vener AV (октябрь 2004 г.). «Векторная протеомика выявляет нацеливание, фосфорилирование и специфическую фрагментацию полимеразы I и фактора высвобождения транскрипта (PTRF) на поверхности кавеол в человеческих адипоцитах». The Biochemical Journal . 383 (Pt 2): 237–48. doi :10.1042/BJ20040647. PMC 1134064 . PMID 15242332.
- Bonache S, Martínez J, Fernández M, Bassas L, Larriba S (июнь 2007 г.). «Полиморфизмы отдельных нуклеотидов в субъединицах сукцинатдегидрогеназы и генах цитратсинтазы: результаты ассоциации для нарушенного сперматогенеза». International Journal of Andrology . 30 (3): 144–52. doi : 10.1111/j.1365-2605.2006.00730.x . PMID 17298551.
- Horváth R, Abicht A, Holinski-Feder E, Laner A, Gempel K, Prokisch H и др. (январь 2006 г.). «Синдром Ли, вызванный мутациями в субъединице флавопротеина (Fp) сукцинатдегидрогеназы (SDHA)». Журнал неврологии, нейрохирургии и психиатрии . 77 (1): 74–6. doi :10.1136/jnnp.2005.067041. PMC 2117401 . PMID 16361598.
- Kullberg M, Nilsson MA, Arnason U, Harley EH, Janke A (август 2006 г.). «Гены домашнего хозяйства для филогенетического анализа родственных связей плацентарных». Молекулярная биология и эволюция . 23 (8): 1493–503. doi : 10.1093/molbev/msl027 . PMID 16751257.
- Tomitsuka E, Kita K, Esumi H (2009). «Регулирование активности сукцинат-убихинонредуктазы и фумаратредуктазы в человеческом комплексе II путем фосфорилирования его субъединицы флавопротеина». Труды Японской академии. Серия B, Физические и биологические науки . 85 (7): 258–65. Bibcode : 2009PJAB...85..258T. doi : 10.2183/pjab.85.258. PMC 3561849. PMID 19644226 .
- Hao HX, Khalimonchuk O, Schraders M, Dephoure N, Bayley JP, Kunst H и др. (август 2009 г.). "SDH5, ген, необходимый для флавинирования сукцинатдегидрогеназы, мутирует при параганглиоме". Science . 325 (5944): 1139–42. Bibcode :2009Sci...325.1139H. doi :10.1126/science.1175689. PMC 3881419 . PMID 19628817.
- Kimura K, Wakamatsu A, Suzuki Y, Ota T, Nishikawa T, Yamashita R и др. (январь 2006 г.). «Диверсификация транскрипционной модуляции: крупномасштабная идентификация и характеристика предполагаемых альтернативных промоторов человеческих генов». Genome Research . 16 (1): 55–65. doi :10.1101/gr.4039406. PMC 1356129. PMID 16344560 .
- Гонсалес-Кабо П., Васкес-Манрике Р.П., Гарсия-Химено М.А., Санс П., Палау Ф (август 2005 г.). «Фратаксин функционально взаимодействует с белками митохондриальной цепи переноса электронов». Молекулярная генетика человека . 14 (15): 2091–8. дои : 10.1093/hmg/ddi214 . ПМИД 15961414.
- Baysal BE, Lawrence EC, Ferrell RE (март 2007 г.). «Изменчивость последовательности генов сукцинатдегидрогеназы человека: доказательства долгосрочного балансирующего отбора на SDHA». BMC Biology . 5 : 12. doi : 10.1186/1741-7007-5-12 . PMC 1852088 . PMID 17376234.
- Eng C, Kiuru M, Fernandez MJ, Aaltonen LA (март 2003 г.). «Роль митохондриальных ферментов в наследственной неоплазии и не только». Nature Reviews. Cancer . 3 (3): 193–202. doi :10.1038/nrc1013. PMID 12612654. S2CID 20549458.
- Бриер Ж.Дж., Фавье Ж., Эль Гузи В., Джуади Ф., Бенит П., Хименес А.П., Растин П. (октябрь 2005 г.). «Дефицит сукцинатдегидрогеназы у человека». Клеточные и молекулярные науки о жизни . 62 (19–20): 2317–24. дои : 10.1007/s00018-005-5237-6. ПМЦ 11139140 . PMID 16143825. S2CID 23793565.
- Корстен А., де Ку ИФ, Спруйт Л., де Вит Л.Е., Смитс Х.Дж., Слейтер В. (февраль 2010 г.). «Пациенты с наследственной оптической нейропатией Лебера не могут компенсировать нарушение окислительного фосфорилирования». Biochimica et Biophysica Acta (BBA) – Биоэнергетика . 1797 (2): 197–203. дои : 10.1016/j.bbabio.2009.10.003 . ПМИД 19836344.
- Hendrickson SL, Lautenberger JA, Chinn LW, Malasky M, Sezgin E, Kingsley LA и др. (сентябрь 2010 г.). «Генетические варианты в ядерно-кодируемых митохондриальных генах влияют на прогрессирование СПИДа». PLOS ONE . 5 (9): e12862. Bibcode :2010PLoSO...512862H. doi : 10.1371/journal.pone.0012862 . PMC 2943476 . PMID 20877624.
- Van Coster R, Seneca S, Smet J, Van Hecke R, Gerlo E, Devreese B и др. (июль 2003 г.). «Гомозиготная мутация Gly555Glu в гене флавопротеина с ядерной массой 70 кДа вызывает нестабильность комплекса II дыхательной цепи». American Journal of Medical Genetics. Часть A. 120A ( 1): 13–8. doi : 10.1002/ajmg.a.10202. PMID 12794685. S2CID 30987591.
- Wang L, McDonnell SK, Hebbring SJ, Cunningham JM, St Sauver J, Cerhan JR и др. (декабрь 2008 г.). «Полиморфизмы митохондриальных генов и риск рака простаты». Cancer Epidemiology, Biomarkers & Prevention . 17 (12 ) : 3558–66. doi :10.1158/1055-9965.EPI-08-0434. PMC 2750891. PMID 19064571.
- Huang G, Chen Y, Lu H, Cao X (февраль 2007 г.). «Связь митохондриальной дыхательной цепи с клеточной смертью: существенная роль митохондриального комплекса I в смерти раковых клеток, вызванной интерфероном-бета и ретиноевой кислотой». Cell Death and Differentiation . 14 (2): 327–37. doi : 10.1038/sj.cdd.4402004 . PMID 16826196.
- Sifroni KG, Damiani CR, Stoffel C, Cardoso MR, Ferreira GK, Jeremias IC и др. (сентябрь 2010 г.). «Митохондриальная дыхательная цепь в слизистой оболочке толстой кишки у пациентов с язвенным колитом». Молекулярная и клеточная биохимия . 342 (1–2): 111–5. doi :10.1007/s11010-010-0474-x. PMID 20440543. S2CID 34103232.
- Ma YY, Wu TF, Liu YP, Wang Q, Li XY, Ding Y и др. (май 2014 г.). «Две сложные мутации со сдвигом рамки считывания в гене сукцинатдегидрогеназы китайского мальчика с энцефалопатией». Brain & Development . 36 (5): 394–8. doi :10.1016/j.braindev.2013.06.003. PMID 23849264. S2CID 24730430.






