Рисдиплам
 | |
| Клинические данные | |
|---|---|
| Торговые наименования | Эврисди |
| Другие имена | RG7916; RO7034067 |
| AHFS / Drugs.com | Монография |
| Данные лицензии |
|
Категория беременности |
|
| Пути введения | Через рот |
| код АТС |
|
| Правовой статус | |
| Правовой статус | |
| Идентификаторы | |
| |
| Номер CAS |
|
| CID PubChem |
|
| DrugBank |
|
| ChemSpider |
|
| УНИИ |
|
| КЕГГ |
|
| ChEMBL |
|
| Панель инструментов CompTox ( EPA ) |
|
| Информационная карта ECHA | 100.278.103 |
| Химические и физические данные | |
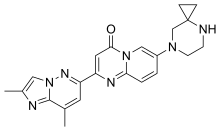
| Формула | С22Н23Н7О |
| Молярная масса | 401,474 г·моль −1 |
| 3D модель ( JSmol ) |
|
| |
| |
Рисдиплам , продаваемый под торговой маркой Evrysdi , является лекарственным средством, используемым для лечения спинальной мышечной атрофии (СМА) [6] [9] и первым пероральным лекарственным средством, одобренным для лечения этого заболевания. [6] [9]
Рисдиплам — это модификатор сплайсинга РНК , направленный на выживание двигательных нейронов 2. [6] [5] [10]
В клинических испытаниях наиболее распространенными нежелательными явлениями были лихорадка, диарея, сыпь, язвы в области рта, боли в суставах (артралгия) и инфекции мочевыводящих путей. [6] [5] Дополнительные нежелательные явления, наблюдаемые у популяции с началом заболевания в младенческом возрасте, включали инфекцию верхних дыхательных путей, пневмонию, запор и рвоту. [6] [5]
Рисдиплам был одобрен Управлением по контролю за продуктами и лекарствами США (FDA) в августе 2020 года для лечения взрослых и детей в возрасте двух месяцев и старше. [6] [11] Разработанный компанией Roche в Базеле, Швейцария, [12] совместно с PTC Therapeutics и SMA Foundation, [9] [11] он продается в США компанией Genentech , [6] дочерней компанией Roche . [11]
Медицинское применение
В Соединенных Штатах рисдиплам показан для лечения спинальной мышечной атрофии у людей в возрасте двух месяцев и старше. [6] [5]
Побочные эффекты
В двух клинических испытаниях следующие нежелательные явления возникали по крайней мере на 5% чаще у пациентов, получавших рисдиплам, чем в группе плацебо: лихорадка, диарея, сыпь, язвы в области рта, боль в суставах (артралгия) и инфекции мочевыводящих путей. [6] [5] Дополнительные нежелательные явления у популяции с началом заболевания в младенческом возрасте включали инфекцию верхних дыхательных путей, пневмонию, запор и рвоту. [6] [5]
Рисдиплам не следует принимать вместе с препаратами, которые являются субстратами множественных лекарственных препаратов и токсинов (MATE), поскольку рисдиплам может повышать концентрацию этих препаратов в плазме. [6] [5]
Фармакология
Механизм действия
Рисдиплам устраняет основную причину СМА: сниженное количество белка выживаемости двигательных нейронов (SMN). Белок кодируется генами SMN1 и SMN2 . СМА вызывается мутациями в SMN1 , которые кодируют неактивные формы белка. Активность гена SMN2 , который производит гораздо меньшее количество SMN, как правило, определяет тяжесть заболевания. [9] [13]
Соединение представляет собой производное пиридазина , которое изменяет сплайсинг матричной РНК SMN2 , включая экзон 7, [14] [10] [15], что приводит к увеличению концентрации функционального белка SMN in vivo . [12]
Нусинерсен , первый препарат, одобренный для лечения СМА, антисмысловой олигонуклеотид, нацеленный на интронный сайленсир сплайсинга N1 (ISS-N1), также изменяет сплайсинг мРНК SMN2 . [16]
Эффективность
Безопасность и эффективность рисдиплама при СМА с младенческим и поздним началом оценивались в текущих клинических испытаниях . [9] [17] [18]
В исследовании младенческой СМА, открытом исследовании с 41 участником, эффективность была установлена на основе способности сидеть без поддержки в течение как минимум пяти секунд. После 12 месяцев лечения 29% участников смогли сидеть самостоятельно более пяти секунд. После 23 или более месяцев лечения 81% участников были живы без постоянной вентиляции легких. Хотя исследование не проводило прямых сравнений с детьми, получавшими плацебо ( неактивное лечение), эти результаты выгодно отличаются от типичного течения нелеченного заболевания. [17] [6]
Исследование SMA с поздним началом было рандомизированным контролируемым исследованием, в котором приняли участие 180 участников в возрасте от 2 до 25 лет с менее тяжелыми формами заболевания. Участники, лечившиеся рисдипламом в течение 12 месяцев, показали улучшение двигательной функции по сравнению с участниками, которым давали плацебо. [18] [6] [9]
Общество и культура
Правовой статус
Управление по контролю за продуктами и лекарствами США (FDA) выдало Genentech разрешение на маркетинг в августе 2020 года. Ранее FDA одобрило заявку на ускоренное рассмотрение , приоритетное рассмотрение и присвоение рисдипламу статуса орфанного препарата . [6] [9] [11] Genentech также получил ваучер на приоритетное рассмотрение для редких детских заболеваний . [6]
Европейское агентство по лекарственным средствам (EMA) присвоило рисдипламу статус приоритетного лекарственного средства в 2018 году [11] [19] [20] и статус орфанного препарата в 2019 году [11] [21]
По состоянию на август 2020 года [обновлять]компания Roche подала заявки на получение разрешения на продажу в Бразилии, Чили, Китае, Европейском союзе, Индонезии, России, Южной Корее и Тайване. [11] [22]
Имена
Рисдиплам — международное непатентованное наименование (МНН). [23]
Сострадательное использование
С конца 2019 года компания Roche предлагает препарат бесплатно по всему миру некоторым имеющим на это право людям в рамках программы расширенного доступа . [24]
Ссылки
- ^ ab "Evrysdi". Управление по контролю за товарами терапевтического назначения (TGA) . 11 июня 2021 г. Получено 6 сентября 2021 г.
- ^ ab "AusPAR: Risdiplam". Управление по контролю за товарами терапевтического назначения (TGA) . 13 сентября 2021 г. Получено 13 сентября 2021 г.
- ^ «Summary Basis of Decision (SBD) for Evrysdi». Health Canada . 23 октября 2014 г. Получено 29 мая 2022 г.
- ^ "Основные моменты в области продуктов для здоровья 2021: Приложения к продуктам, одобренным в 2021 году". Министерство здравоохранения Канады . 3 августа 2022 г. Получено 25 марта 2024 г.
- ^ abcdefgh Управление по контролю за продуктами питания и лекарственными средствами (FDA) (18 августа 2020 г.). "Evrysdi-risdiplam powder, for solution". DailyMed . Бетесда , Мэриленд , США: MedLine Национальной медицинской библиотеки (NLM) Национальных институтов здравоохранения США (NIH) . Получено 24 сентября 2020 г.
- ^ abcdefghijklmnop O'Keefe L (7 августа 2020 г.). «FDA одобряет пероральное лечение спинальной мышечной атрофии» (пресс-релиз). Силвер-Спринг , Мэриленд , Соединенные Штаты Америки: Управление по контролю за продуктами и лекарствами США (FDA) . Отдел новостей FDA. Архивировано из оригинала 11 августа 2020 г. . Получено 7 августа 2020 г. .
 В данной статье использован текст из этого источника, находящегося в общественном достоянии .
В данной статье использован текст из этого источника, находящегося в общественном достоянии . - ^ "Evrysdi EPAR". Европейское агентство по лекарственным средствам . 24 февраля 2021 г. Получено 4 марта 2023 г.
- ^ "Информация о продукте Evrysdi". Единый реестр лекарственных средств . Получено 3 марта 2023 г.
- ^ abcdefg Управление по контролю за продуктами и лекарствами (FDA) (7 августа 2020 г.). «Эврисди (Рисдиплам) при спинальной мышечной атрофии». SMA News Today . Пенсакола , Флорида , США: BioNews Services (BioNews Services, LLC.). Архивировано из оригинала 27 января 2021 г. Получено 9 июня 2021 г.
- ^ ab Zhao X, Feng Z, Ling KK, Mollin A, Sheedy J, Yeh S, et al. (май 2016 г.). «Фармакокинетика, фармакодинамика и эффективность модификатора сплайсинга SMN2 малой молекулы в мышиных моделях спинальной мышечной атрофии». Молекулярная генетика человека . 25 (10). Оксфорд , Соединенное Королевство Великобритании: Oxford University Press (OUP) : 1885–1899 . doi :10.1093/hmg/ddw062. PMC 5062580. PMID 26931466.
- ^ abcdefg "FDA одобряет препарат Evrysdi (рисдиплам) компании Genentech для лечения спинальной мышечной атрофии (СМА) у взрослых и детей в возрасте 2 месяцев и старше". Genentech (пресс-релиз). Сан-Франциско , Калифорния , Соединенные Штаты Америки: Genentech, Inc. (Roche Group). Genentech Global Product Development Division. 7 августа 2020 г. Архивировано из оригинала 18 августа 2020 г. Получено 7 августа 2020 г.
- ^ ab Ratni H, Ebeling M, Baird J, Bendels S, Bylund J, Chen KS и др. (август 2018 г.). «Открытие Risdiplam, селективного модификатора сплайсинга гена выживаемости моторного нейрона-2 (SMN2) для лечения спинальной мышечной атрофии (СМА)». Journal of Medicinal Chemistry . 61 (15). Вашингтон, округ Колумбия : 6501– 6517. doi : 10.1021/acs.jmedchem.8b00741 . LCCN a63000643. OCLC 39480771. PMID 30044619.
- ^ Ramdas S, Servais L (февраль 2020 г.). Grech D, Michaelidis D, Abdollahi M (ред.). «Новые методы лечения спинальной мышечной атрофии: обзор имеющихся в настоящее время данных». Мнение эксперта по фармакотерапии . 21 (3). Лондон , Англия , Соединенное Королевство Великобритании: Taylor & Francis (Informa UK Ltd): 307– 315. doi : 10.1080/14656566.2019.1704732. OCLC 57378019. PMID 31973611. S2CID 210880199.
- ^ "RG7916". Пенсакола , Флорида , США: BioNews Services (BioNews Services, LLC.). 8 ноября 2016 г. Архивировано из оригинала 24 апреля 2020 г. Получено 9 июня 2021 г.
- ^ Baranello G, Darras BT, Day JW, Deconinck N, Klein A, Masson R и др. (март 2021 г.). «Рисдиплам при спинальной мышечной атрофии 1-го типа». The New England Journal of Medicine . 384 (10). Бостон , Массачусетс , Соединенные Штаты Америки: NEJM Group ( Massachusetts Medical Society ): 915–923 . doi : 10.1056/NEJMoa2009965 . LCCN 20020456. OCLC 231027780. PMID 33626251. S2CID 232047598.
- ^ Zanetta C, Nizzardo M, Simone C, Monguzzi E, Bresolin N, Comi GP, Corti S (январь 2014 г.). «Молекулярные терапевтические стратегии при спинальных мышечных атрофиях: текущие и будущие клинические испытания». Clinical Therapeutics . 36 (1). Филадельфия , Пенсильвания , Соединенные Штаты Америки: Elsevier: 128– 140. doi : 10.1016/j.clinthera.2013.11.006 . PMID 24360800.
- ^ ab Baranello G, Servais L, Day J, Deconinck N, Mercuri E, Klein A и др. (1 октября 2019 г.). "P.353FIREFISH Часть 1: 16-месячная безопасность и исследовательские результаты лечения рисдипламом (RG7916) у младенцев со спинальной мышечной атрофией 1 типа". Нейромышечные расстройства . 29 (Приложение 1). Лондон, Соединенное Королевство Великобритании: World Muscle Society (WMS)/Elsevier Inc.: S184. doi : 10.1016/j.nmd.2019.06.515 . ISSN 0960-8966. OCLC 24318845.
- ^ ab Mercuri E, Baranello G, Kirschner J, Servais L, Goemans N, Pera MC и др. (16 апреля 2019 г.). «Обновление от SUNFISH Часть 1: Безопасность, переносимость и PK/PD из исследования по поиску дозы, включая данные об эффективности у пациентов со спинальной мышечной атрофией (СМА) 2-го или 3-го типа, леченных Рисдипламом (RG7916) (S25.007)». Неврология . 92 (15 (Дополнение)). Миннеаполис , Миннесота , Соединенные Штаты Америки: Американская академия неврологии / Wolters Kluwer . doi : 10.1212/WNL.92.15_supplement.S25.007. ISSN 0028-3878. LCCN 55043902. OCLC 960771045. Получено 9 июня 2021 г.
- ^ Inacio P (21 декабря 2018 г.). «Рисдиплам получил статус PRIME от EMA за потенциал в лечении спинальной мышечной атрофии». SMA News Today . Пенсакола , Флорида , США: BioNews Services (BioNews Services, LLC.). Архивировано из оригинала 26 января 2021 г. Получено 9 июня 2021 г.
- ^ Roche Group Media Relations Division (17 декабря 2018 г.). «Европейским агентством по лекарственным средствам присвоен статус PRIME препарату Roche risdiplam для лечения спинальной мышечной атрофии (SMA)» (пресс-релиз). Базель , Швейцария : F. Hoffmann-La Roche Ltd. Group Communications Department (Roche Group Media Relations Division). стр. 1–5 . Архивировано из оригинала (PDF) 18 августа 2020 г. Получено 9 июня 2021 г.
- ^ Стоянова-Бенинска В., Шварцер-Даум Б. (26 февраля 2019 г.). Публичное резюме мнения о назначении орфанного препарата: Рисдиплам для лечения спинальной мышечной атрофии (PDF) . Комитет EMA по орфанным лекарственным препаратам (COMP) (Отчет). Амстердам, Нидерланды: Европейское агентство по лекарственным препаратам (Комитет EMA по орфанным лекарственным препаратам). стр. 1– 4. Архивировано (PDF) из оригинала 6 мая 2020 г.
- ^ PTC Therapeutics (17 августа 2020 г.). «PTC объявляет о принятии заявки на получение разрешения на европейский маркетинг препарата Evrysdi™ (рисдиплам) для лечения спинальной мышечной атрофии» (пресс-релиз). Альбукерке , Нью-Мексико , Соединенные Штаты Америки: PR Newswire. PTC Therapeutics. Архивировано из оригинала 18 августа 2020 г. Получено 9 июня 2021 г.
- ^ Всемирная организация здравоохранения (2018). «Международные непатентованные наименования фармацевтических веществ (МНН): рекомендуемые МНН: список 80». WHO Drug Information . 32 (3): 482. hdl : 10665/330907 .
- ^ Petridis F (13 января 2020 г.). «Roche объявляет о глобальной программе сострадательного использования Risdiplam» (пресс-релиз). Стратфорд-на-Эйвоне , Англия , Соединенное Королевство Великобритании: Spinal Muscular Atrophy UK ltd. Глобальная группа Roche SMA (F. Hoffmann-La Roche Ltd) . Получено 9 июня 2021 г.
Дальнейшее чтение
- Dhillon S (ноябрь 2020 г.). «Risdiplam: Первое одобрение». Лекарственные средства . 80 (17). Берлин , Германия / Гейдельберг , Германия / Хам , Швейцария : Adis International / Springer Nature Switzerland AG (Springer Nature) : 1853– 1858. doi :10.1007/s40265-020-01410-z. OCLC 01566990. PMID 33044711. S2CID 222279898.
- Ratni H, Scalco RS, Stephan AH (июнь 2021 г.). «Рисдиплам, первый одобренный препарат-модификатор сплайсинга малых молекул как образец для будущих преобразующих лекарств». ACS Medicinal Chemistry Letters . 12 (6). Вашингтон, округ Колумбия : ACS Publications ( Американское химическое общество ): 874– 877. doi : 10.1021/acsmedchemlett.0c00659. OCLC 643819990. PMC 8201486. PMID 34141064 .
Внешние ссылки
- Номер клинического исследования NCT02913482 для «Исследования безопасности, переносимости, фармакокинетики, фармакодинамического действия и эффективности рисдиплама (RO7034067) у младенцев со спинальной мышечной атрофией 1 типа (FIREFISH)» на ClinicalTrials.gov
- Номер клинического исследования NCT02908685 для «Исследования безопасности, переносимости, фармакокинетики, фармакодинамики и эффективности Рисдиплама (RO7034067) у пациентов со спинальной мышечной атрофией (СМА) 2-го и 3-го типа (SUNFISH)» на ClinicalTrials.gov
