Реакция ретро-Дильса-Альдера
Реакция ретро -Дильса-Альдера ( реакция рДА ) является обратной реакцией Дильса-Альдера (ДА) , [4+2] циклоэлиминированием. Она включает образование диена и диенофила из циклогексена . Она может быть осуществлена спонтанно под воздействием тепла или при посредничестве кислоты или основания. [1] [2]
В принципе, становится термодинамически выгодным для реакции Дильса-Альдера протекать в обратном направлении, если температура достаточно высока. На практике эта реакция обычно требует некоторых особых структурных особенностей для протекания при температурах, имеющих синтетическое значение. Например, расщепление циклогексена с образованием бутадиена и этена наблюдалось, но только при температурах, превышающих 800 К. [3] Однако при наличии соответствующей движущей силы реакция Дильса-Альдера протекает в обратном направлении в относительно мягких условиях, обеспечивая диен и диенофил из исходных производных циклогексена. Еще в 1929 году этот процесс был известен и применялся для обнаружения циклогексадиенов, которые выделяли этилен и ароматические соединения после реакции с ацетиленами через последовательность Дильса-Альдера/ретро-Дильса-Альдера. [4] С тех пор множество субстратов подвергалось rDA, давая множество различных диенов и диенофилов. Кроме того, проведение rDA в присутствии поглощающего диена или диенофила привело к захвату многих транзиторных реактивных видов. [5]

Механизм и стереохимия
Преобладающий механизм
Реакция ретро-Дильса–Альдера является микроскопическим обращением реакции Дильса–Альдера: согласованный (но не обязательно синхронный), перициклический, одношаговый процесс. Доказательства ретро-реакции Дильса–Альдера были получены путем наблюдения эндо - экзоизомеризации аддуктов Дильса–Альдера. [6] Было высказано предположение, что при высоких температурах изомеризация кинетических эндо- аддуктов в более термодинамически стабильные экзопродукты происходит через последовательность rDA/DA. Однако такая изомеризация может происходить через полностью внутримолекулярный, [3,3]-сигматропный (Cope) процесс. Доказательства последнего были получены с помощью реакции ниже — ни один из изомеров «голова к голове» не был получен, что предполагает полностью внутримолекулярный процесс изомеризации. [7]
(2)
Стереохимия
Подобно реакции Дильса-Альдера, rDA сохраняет конфигурацию в диене и диенофиле. Гораздо меньше известно об относительных скоростях реверсии эндо- и экзоаддуктов , и исследования указали на отсутствие корреляции между относительной конфигурацией в исходном материале циклогексена и скоростью реверсии. [8]
Область применения и ограничения
Несколько реакций rDA происходят спонтанно при комнатной температуре из-за высокой реакционной способности или летучести выделяемого диенофила. Однако большинство из них требуют дополнительной термической или химической активации. Относительные тенденции различных диенов и диенофилов к образованию через rDA описаны ниже:
Диен : фуран , пиррол > бензол > нафталин > фульвен > циклопентадиен > антрацен > бутадиен
Диенофил : N2 > CO2 > нафталин > бензол , нитрилы > метакрилат > малеимиды > циклопентадиен , имины , алкены > алкины
Полностью углеродные диенофилы
Поскольку реакция Дильса-Альдера обменивает две π-связи на две σ-связи, она по своей сути термодинамически выгодна в прямом направлении. Однако известны различные стратегии преодоления этого присущего термодинамического смещения. Комплексообразование кислот Льюиса с основными функциональными группами в исходном материале может вызвать ретрореакцию Дильса-Альдера, даже в случаях, когда прямая реакция является внутримолекулярной. [9]
(3)
Базовое посредничество может быть использовано для индукции rDA в случаях, когда разделенные продукты менее основные, чем исходный материал. Эта стратегия использовалась, например, для получения ароматических циклопентадиенильных анионов из аддуктов циклопентадиена. [10] Стратегически размещенные электроноакцепторные группы в исходном материале могут сделать этот процесс по существу необратимым.
(4)
Если целью является выделение или реакция неуловимого диена или диенофила, можно использовать одну из двух стратегий. Флэш-вакуумный пиролиз аддуктов Дильса-Альдера, синтезированных независимыми способами, может обеспечить чрезвычайно реактивные, короткоживущие диенофилы (которые затем могут быть захвачены уникальным диеном). [11] В качестве альтернативы реакция rDA может быть проведена в присутствии поглотителя. Поглотитель реагирует либо с диеном, либо (что более типично) с диенофилом, чтобы сместить равновесие процесса ретро-DA в сторону продуктов. Высокореактивные цианоакрилаты могут быть выделены из аддуктов Дильса-Альдера (синтезированных независимо) с использованием поглотителя. [12]
(5)
Гетероатомные диенофилы
Нитрилы могут высвобождаться в реакциях rDA аддуктов DA пиримидинов или пиразинов. Полученные высокозамещенные пиридины могут быть труднодоступны другими способами. [13]
(6)
Высвобождение изоцианатов из аддуктов Дильса-Альдера пиридонов может быть использовано для получения высокозамещенных ароматических соединений. Изоцианаты могут быть изолированы или захвачены, если они являются желаемым продуктом. [14]
(7)
Выделение азота из шестичленных циклических диазенов является обычным и часто спонтанным при комнатной температуре. Такая реакция может быть использована в клик-реакциях , где алканы реагируют с 1,2,4,5-тетразином в реакции Дильса-Альдера, а затем в ретрореакции Дильса-Альдера с потерей азота. В этом другом примере показанный эпоксид подвергается rDA при 0 °C. Изомер с цис -связью между диазеном и эпоксидом реагирует только после нагревания до >180 °C. [15]
(8)
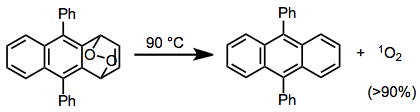
Согласованное высвобождение кислорода через rDA приводит к образованию синглетного кислорода . Очень высокие выходы синглетного кислорода являются результатом реакций rDA некоторых циклических пероксидов — в этом примере был получен выход синглетного кислорода более 90%. [16]
(9)
Углекислый газ является обычным диенофилом, выделяющимся в ходе реакций rDA. Аддукты Дильса-Альдера алкинов и 2-пиронов могут подвергаться rDA с выделением углекислого газа и образованием ароматических соединений. [17]
(10)
Условия и порядок проведения эксперимента
Типичные условия
Внутренняя энергия является единственным фактором, контролирующим степень реакций rDA, а температура обычно является единственной переменной, приводимой для этих реакций. Таким образом, нет условий, которые можно было бы считать «типичными». Для реакций rDA, которые дают летучий продукт, удаление этого продукта может облегчить реакцию, хотя большинство этих реакций (например, rDA с высвобождением азота и кислорода) необратимы без какого-либо дополнительного стимулирования.
Ссылки
- ^ Рикборн, Б. (1998). "Ретро-<SCP>Дильса-<SCP>Альдера Реакция Часть<SCP>I</SCP>.<SCP>C</SCP><SCP>C</SCP>Диенофилы". Реакция Ретро-Дильса-Альдера. Часть I. C–C Диенофилы . Т. 52. С. 1– 393. doi :10.1002/0471264180.or052.01. ISBN 978-0471264187.
{{cite book}}:|journal=проигнорировано ( помощь ) - ^ Рикборн, Б. (1998). "Ретро-реакция Дильса-Альдера. Часть II. Диенофилы с одним или несколькими гетероатомами". Реакция ретро-Дильса-Альдера. Часть II. Диенофилы с одним или несколькими гетероатомами . Т. 53. С. 223–629 . doi :10.1002/0471264180.or053.02. ISBN 978-0471264187.
{{cite book}}:|journal=проигнорировано ( помощь ) - ^ Учияма, Масао; Томиока, Тадао; Амано, Акира (2002-05-01). «Термическое разложение циклогексена». Журнал физической химии . 68 (7): 1878– 1881. doi :10.1021/j100789a036.
- ^ Дильс, О.; Олдер, К.; Штейн, Г.; Прис, П.; Винклер, Х. (1929). «Синтез в гидроароматическом Рейхе, VI. Mitteilung, Курт Альдер и Герхард Штейн: Über partiell Hydraulicte Naphtho- и Anthrachinone mit Wasserstoff в γ- bzw. δ-Stellung. (Mitbearbeitet von Paul Pries und Hans Winckler)». хим. Бер . 62 (8): 2337. doi :10.1002/cber.19290620872.
- ^ Ичихара, А. (1987). «Ретро-стратегия Дильса-Альдера в синтезе натуральных продуктов». Синтез . 1987 (3): 207–222 . doi :10.1055/s-1987-27894.
- ^ Алдер, К.; Рикерт, HF (1936). «Zur Kenntnis der Dien-synthese. I. Über eine Methode der direkten Unterscheidung cyclischer Penta- und Hexa-diene». Юстус Либигс Энн. Хим . 524 : 180–189 . doi : 10.1002/jlac.19365240109.
- ^ Хаслоуэн, Дж.; Русак, Ф. (1977). «Термический разрыв ретро-Дильса-Альдера. V. Синтез (±) ипсенола». Бюллетень химического общества Франции, часть 2 . 11–12 : 1242–1244 .
- ^ Рай, AR; Веге, Д. (1974). «Подготовка и термолиз экзо- и эндо-Трицикло[6,2,1,0 2,7 ] ундека-3,5,9-триена». Aust. J. Chem . 27 (9): 1943. doi :10.1071/CH9741943.
- ^ Rogers, C.; Keay, BA (1991). "Каталитический дихлорид метилалюминия: эффективный метод ускорения внутримолекулярной реакции Дильса-Альдера фуран-диена" (PDF) . Tetrahedron Lett . 32 (45): 6477. doi :10.1016/0040-4039(91)80197-E. hdl : 1880/44897 . S2CID 97379495.
- ^ Neukam, W.; Grimme, W. (1978). "Анионные (4+2)-циклореверсии, приводящие к цианоциклопентадиенидному иону". Tetrahedron Lett . 19 (25): 2201. doi :10.1016/S0040-4039(01)86845-3.
- ^ Ахмар, М.; Ромен, И.; Блох, Р. (1993). «Эффективные и высокостереоселективные синтезы энантиомерно обогащенных субъединиц C(1)-C(7) эритронолидов». J. Org. Chem . 58 (11): 2953. doi :10.1021/jo00063a009.
- ^ Бак, CJJ (1978). «Недвусмысленный синтез бис(2-цианоакрилатных) мономеров. I. Через антраценовые аддукты». Polym. Sci., Polym. Chem. Ed . 16 (10): 2475– 2507. Bibcode :1978JPoSA..16.2475B. doi :10.1002/pol.1978.170161007.
- ^ Мартин, Дж. К. Дж. (1980). «Синтез пиридинов из дицианопиримидинов. Подход Дильса-Альдера к c-кольцу стрептонигрина». J. Heterocycl. Chem . 17 (5): 1111– 1112. doi :10.1002/jhet.5570170554.
- ^ Афаринкиа, К.; Винадер, В.; Нельсон, ТД; Познер, ГХ (1992). "Циклоприсоединения Дильса-Альдера 2-пиронов и 2-пиридонов". Тетраэдр . 48 (42): 9111. doi : 10.1016/S0040-4020(01)85607-6 .
- ^ Ляо, И.; Уайт, Дж. Б. (1990). «Исследование влияния [ sic ] стереохимии эпоксида на экструзию азота из экзо- и эндо-6,7-диазо-3-оксотрицикло[3.2.2.0 2,4 ]Нон-6-ена». Tetrahedron Lett . 31 (36): 5129. doi :10.1016/S0040-4039(00)97822-5.
- ^ Turro, NJ; Chow, MF (1979). «Влияние магнитного поля на термолиз эндопероксидов ароматических соединений. Корреляции с выходом синглетного кислорода и энтропиями активации». J. Am. Chem. Soc . 101 (13): 3701. doi :10.1021/ja00507a067.
- ^ Сакурай, Х.; Эрияма, Ю.; Хосоми, А.; Накадайра, Ю.; Кабуто, К. (1984). «Получение и реакции додекаметил-3,4,7,8,11,12-гексасилациклододека-1,5,9-триина». хим. Летт . 13 (4): 595–598 . doi : 10.1246/cl.1984.595.