Третичная структура нуклеиновой кислоты


Третичная структура нуклеиновой кислоты — это трехмерная форма полимера нуклеиновой кислоты . [1] Молекулы РНК и ДНК способны выполнять разнообразные функции, от молекулярного распознавания до катализа . Такие функции требуют точной трехмерной структуры. Хотя такие структуры разнообразны и кажутся сложными, они состоят из повторяющихся, легко узнаваемых третичных структурных мотивов , которые служат молекулярными строительными блоками. Некоторые из наиболее распространенных мотивов для третичной структуры РНК и ДНК описаны ниже, но эта информация основана на ограниченном количестве решенных структур. Еще больше третичных структурных мотивов будет обнаружено по мере структурной характеристики новых молекул РНК и ДНК.
Спиральные структуры

Двойная спираль
Двойная спираль является доминирующей третичной структурой для биологической ДНК, а также возможной структурой для РНК. Считается, что в природе встречаются три конформации ДНК: A-ДНК , B-ДНК и Z-ДНК . Форма «B», описанная Джеймсом Д. Уотсоном и Фрэнсисом Криком , как полагают, преобладает в клетках. [2] Джеймс Д. Уотсон и Фрэнсис Крик описали эту структуру как двойную спираль с радиусом 10 Å и шагом 34 Å , совершающую один полный оборот вокруг своей оси каждые 10 п.н. последовательности. [3] Двойная спираль совершает один полный оборот вокруг своей оси каждые 10,4–10,5 пар оснований в растворе. Эта частота скручивания (известная как шаг спирали ) во многом зависит от сил укладки, которые каждое основание оказывает на своих соседей в цепи. Двойная спиральная РНК принимает конформацию, похожую на структуру формы A.
Возможны и другие конформации; фактически, только буквы F, Q, U, V и Y теперь доступны для описания любой новой структуры ДНК, которая может появиться в будущем. [4] [5] Однако большинство этих форм были созданы синтетически и не наблюдались в естественных биологических системах.
Триплексы больших и малых бороздок
Триплекс малой бороздки является вездесущим структурным мотивом РНК . Поскольку взаимодействия с малой бороздкой часто опосредуются 2'-ОН сахара рибозы , этот мотив РНК выглядит совсем иначе, чем его эквивалент в ДНК . Наиболее распространенным примером триплекса малой бороздки является мотив A-minor, или вставка оснований аденозина в малую бороздку (см. выше). Однако этот мотив не ограничивается аденозинами, поскольку было обнаружено, что другие азотистые основания также взаимодействуют с малой бороздкой РНК.
Малая бороздка представляет собой почти идеальное дополнение для вставленного основания. Это обеспечивает оптимальные ван-дер-ваальсовы контакты , обширные водородные связи и гидрофобное поверхностное захоронение, а также создает энергетически выгодное взаимодействие. [8] [9] Поскольку тройки малой бороздки способны стабильно упаковывать свободную петлю и спираль, они являются ключевыми элементами в структуре больших рибонуклеотидов , включая интрон группы I, [10] интрон группы II, [11] и рибосому .
Хотя большая бороздка стандартной A-формы РНК довольно узкая и, следовательно, менее доступна для триплексного взаимодействия, чем малая бороздка, триплексные взаимодействия большой бороздки можно наблюдать в нескольких структурах РНК. Эти структуры состоят из нескольких комбинаций пар оснований и взаимодействий Хугстина. Например, триплекс GGC (GGC амино(N-2)-N-7, имино-карбонил, карбонил-амино(N-4); Уотсон-Крик), наблюдаемый в рибосоме 50S , состоящий из пары GC типа Уотсона-Крика и входящего G, который образует псевдо-Хугстиновскую сеть водородных связей между обоими основаниями, участвующими в каноническом спаривании. [12] Другие известные примеры триплексов большой бороздки включают в себя (i) каталитическое ядро интрона группы II, показанное на рисунке слева [6] (ii) каталитически важную тройную спираль, наблюдаемую в человеческой теломеразной РНК [7] (iii) рибосвитч SAM-II [14] и (iv) элемент ядерной экспрессии (ENE), который действует как элемент стабилизации РНК посредством образования тройной спирали с поли(А)-хвостом. [15] [16]
Трехцепочечная ДНК также возможна из- за хугстиновских или обратных хугстиновских водородных связей в большой бороздке ДНК B-формы .
Квадруплексы
Помимо двойных спиралей и вышеупомянутых триплексов, РНК и ДНК также могут образовывать четверные спирали. Существуют различные структуры квадруплексов оснований РНК. Четыре последовательных остатка гуанина могут образовывать квадруплекс в РНК с помощью водородных связей Хугстина , образуя «кольцо Хугстина» (см. рисунок). [12] Пары GC и AU также могут образовывать квадруплекс оснований с комбинацией спаривания Уотсона-Крика и неканонического спаривания в малой бороздке . [17]
Ядро аптамера малахитового зеленого также представляет собой своего рода базовый квадруплекс с другим рисунком водородных связей (см. рисунок). [13] Квадруплекс может повторяться несколько раз подряд, создавая чрезвычайно стабильную структуру.
Уникальная структура квадруплексных областей в РНК может выполнять различные функции в биологической системе. Две важные функции — это связывающий потенциал с лигандами или белками и его способность стабилизировать всю третичную структуру ДНК или РНК. Сильная структура может ингибировать или модулировать транскрипцию и репликацию , например, в теломерах хромосом и UTR мРНК. [18] Идентичность основания важна для связывания лиганда. G-квартет обычно связывает одновалентные катионы, такие как калий, в то время как другие основания могут связывать многочисленные другие лиганды, такие как гипоксантин в квадруплексе UUCU. [17]
Наряду с этими функциями, G-квадруплекс в мРНК вокруг областей связывания рибосомы может служить регулятором экспрессии генов у бактерий . [19] Возможно, существуют более интересные структуры и функции, которые еще предстоит открыть in vivo .
Коаксиальное стекирование

Коаксиальная укладка, также известная как спиральная укладка, является основным фактором, определяющим третичную структуру РНК более высокого порядка. Коаксиальная укладка происходит, когда два дуплекса РНК образуют непрерывную спираль, которая стабилизируется укладкой оснований на границе двух спиралей. Коаксиальная укладка была отмечена в кристаллической структуре тРНКPhe. [21] Совсем недавно коаксиальная укладка наблюдалась в структурах более высокого порядка многих рибозимов , включая многие формы самосплайсирующихся интронов группы I и группы II . Общие мотивы коаксиальной укладки включают взаимодействие поцелуйной петли и псевдоузел . Стабильность этих взаимодействий можно предсказать с помощью адаптации «правил Тернера». [22]
В 1994 году Уолтер и Тернер определили вклады свободной энергии взаимодействий укладки ближайших соседей в интерфейсе спираль-спираль, используя модельную систему, которая создавала интерфейс спираль-спираль между коротким олигомером и выступом из четырех нуклеотидов на конце шпильки . Их эксперименты подтвердили, что термодинамический вклад укладки оснований между двумя спиральными вторичными структурами близко имитирует термодинамику стандартного образования дуплекса (взаимодействия ближайших соседей предсказывают термодинамическую стабильность полученной спирали). Относительную стабильность взаимодействий ближайших соседей можно использовать для прогнозирования благоприятной коаксиальной укладки на основе известной вторичной структуры. Уолтер и Тернер обнаружили, что в среднем точность прогнозирования структуры РНК улучшилась с 67% до 74%, когда были включены вклады коаксиальной укладки. [23]
Большинство хорошо изученных третичных структур РНК содержат примеры коаксиальной укладки. Некоторые известные примеры — тРНК-Phe, интроны группы I, интроны группы II и рибосомальные РНК. Кристаллические структуры тРНК выявили наличие двух расширенных спиралей, которые являются результатом коаксиальной укладки акцепторного стебля аминокислоты с Т-плечом и укладки D- и антикодоновых плеч. Эти взаимодействия внутри тРНК ориентируют антикодоновый стебель перпендикулярно аминокислотному стеблю, что приводит к функциональной L-образной третичной структуре. [21] В интронах группы I было показано, что спирали P4 и P6 коаксиально укладываются с использованием комбинации биохимических [24] и кристаллографических методов. Кристаллическая структура P456 дала подробное представление о том, как коаксиальная укладка стабилизирует упаковку спиралей РНК в третичные структуры. [25] В интроне группы самосплайсинга II из Oceanobacillus iheyensis, стержни IA и IB коаксиально укладываются друг на друга и способствуют относительной ориентации составляющих спиралей пятистороннего соединения. [6] Эта ориентация облегчает правильное сворачивание активного сайта функционального рибозима. Рибосома содержит многочисленные примеры коаксиальной укладки, включая уложенные друг на друга сегменты длиной до 70 п.н. [26]

Два распространенных мотива, включающих коаксиальную укладку, — это целующиеся петли и псевдоузлы. При взаимодействии целующихся петель одноцепочечные области петель двух шпилек взаимодействуют посредством спаривания оснований, образуя составную, коаксиально уложенную спираль. Примечательно, что эта структура позволяет всем нуклеотидам в каждой петле участвовать в спаривании оснований и укладке взаимодействий. Этот мотив был визуализирован и изучен с помощью анализа ЯМР Ли и Крозерсом. [27] Мотив псевдоузла возникает, когда одноцепочечный регион петли шпильки спаривается с последовательностью выше или ниже по течению в пределах одной и той же нити РНК. Два полученных дуплексных региона часто накладываются друг на друга, образуя стабильную коаксиально уложенную составную спираль. Одним из примеров мотива псевдоузла является высокостабильный рибозим вируса гепатита Дельта, в котором остов показывает общую топологию двойного псевдоузла. [28]
Эффект, аналогичный коаксиальному стекированию, наблюдался в рационально спроектированных структурах ДНК. Структуры ДНК-оригами содержат большое количество двойных спиралей с открытыми тупыми концами. Было замечено, что эти структуры слипаются вдоль краев, содержащих эти открытые тупые концы, из-за гидрофобных взаимодействий стекирования. [29] Объединив эти рационально спроектированные наноструктуры ДНК и сверхразрешающую визуализацию DNA-PAINT, исследователи выявили индивидуальную силу энергий стекирования между всеми возможными динуклеотидами. [30]
Измерение коаксиальной укладки в нуклеиновой кислоте
Ранние измерения коаксиальной укладки проводились с использованием биохимических анализов, которые изучают относительную миграцию различных молекул нуклеиновых кислот на основе их конформации и вида присутствующих взаимодействий. Короткие молекулы ДНК, содержащие зазубрины, которые все еще могли укладываться коаксиально, мигрировали быстрее, чем молекулы ДНК, содержащие пробелы и, таким образом, не имели коаксиальной укладки. Это можно объяснить полимерными свойствами ДНК, где более жесткие стержнеобразные молекулы будут мигрировать быстрее вдоль электрического градиента в матрице по сравнению с более гибкими молекулами. [31] Разработка более новых методов, таких как оптический пинцет и способность складывать наноструктуры ДНК, привела к измерению пучков ДНК и их способности укладываться друг с другом. Затем можно было проанализировать силу, необходимую для разделения этих пучков с помощью оптического пинцета, для измерения энергий укладки пар оснований. [32] Эти измерения проводились в основном в неравновесных условиях, и были сделаны различные экстраполяции для получения точных значений коаксиальной укладки между основаниями. Недавние исследования отдельных молекул с использованием ДНК-наноструктур и микроскопии сверхвысокого разрешения DNA-PAINT позволили измерить это взаимодействие между динуклеотидами, используя глубокий кинетический анализ времени связывания коротких молекул ДНК с их комплементарными последовательностями в присутствии или отсутствии взаимодействий при укладке ДНК. [30]
Другие мотивы
Взаимодействие тетрапетли с рецептором

Взаимодействия тетрапетля-рецептор объединяют спаривание оснований и стекинговые взаимодействия между нуклеотидами петли мотива тетрапетли и мотивом рецептора, расположенным внутри дуплекса РНК, создавая третичный контакт, который стабилизирует глобальную третичную складку молекулы РНК . Тетрапетли также являются возможными структурами в дуплексах ДНК. [34]
Стебель-петли могут сильно различаться по размеру и последовательности, но тетрапетли из четырех нуклеотидов очень распространены и обычно относятся к одной из трех категорий в зависимости от последовательности. [35] Эти три семейства — тетрапетли CUYG, UNCG и GNRA (см. рисунок справа) . [36] В каждом из этих семейств тетрапетли второй и третий нуклеотиды образуют поворот в цепи РНК, а пара оснований между первым и четвертым нуклеотидами стабилизирует структуру стебля-петли. Было определено, в общем, что стабильность тетрапетли зависит от состава оснований внутри петли и от состава этой «замыкающей пары оснований». [37] Семейство тетрапетлей GNRA чаще всего наблюдается во взаимодействиях тетрапетля-рецептор. Кроме того, известно, что тетрапетли UMAC являются альтернативными версиями петель GNRA, обе имеют схожие структуры остова; Несмотря на сходство, они различаются по возможным дальнодействующим взаимодействиям, на которые они способны. [38]

«Тетрапетлевые рецепторные мотивы» — это дальнодействующие третичные взаимодействия [39], состоящие из водородных связей между основаниями в тетрапетле и последовательностями стебель-петля в дистальных участках вторичной структуры РНК. [40] Помимо водородных связей, важным компонентом этих третичных взаимодействий являются взаимодействия стекирования. Например, во взаимодействиях GNRA-тетрапетля второй нуклеотид тетрапетли укладывается непосредственно на мотив A-платформы (см. выше) внутри рецептора. [25] Последовательность тетрапетли и ее рецептора часто ковариируют, так что один и тот же тип третичного контакта может быть установлен с различными изоформами тетрапетли и ее родственного рецептора. [41]
Например, самосплайсирующийся интрон группы I опирается на мотивы рецептора тетрапетли для своей структуры и функции. [25] [40] В частности, три остатка аденина канонического мотива GAAA укладываются на вершину спирали рецептора и образуют множественные стабилизирующие водородные связи с рецептором. Первый аденин последовательности GAAA образует тройную пару оснований с основаниями AU рецептора. Второй аденин стабилизируется водородными связями с тем же уридином, а также через его 2'-OH с рецептором и через взаимодействия с гуанином тетрапетли GAAA. Третий аденин образует тройную пару оснований.
Мотив ля минор
Мотив A-minor является вездесущим третичным структурным мотивом РНК. Он образуется путем вставки неспаренного нуклеозида в малую бороздку дуплекса РНК. Таким образом, он является примером тройной малой бороздки. Хотя гуанозин, цитозин и уридин также могут образовывать тройные взаимодействия малой бороздки, взаимодействия малой бороздки с аденином очень распространены. В случае аденина край N1-C2-N3 вставочного основания образует водородные связи с одним или обоими 2'-OH дуплекса, а также с основаниями дуплекса (см. рисунок: Взаимодействия A-minor). Дуплекс-хозяин часто представляет собой пару оснований GC.
Мотивы A-minor были разделены на четыре класса, [8] [9] типы 0–III, на основе положения вставочного основания относительно двух 2'-OH пары оснований Уотсона-Крика . В мотивах A-minor типа I и II N3 аденина глубоко вставлен в малую бороздку дуплекса (см. рисунок: Взаимодействия A-minor — взаимодействие типа II), и наблюдается хорошая комплементарность формы с парой оснований. В отличие от типов 0 и III, взаимодействия типов I и II специфичны для аденина из-за взаимодействий водородных связей. Во взаимодействии типа III как O2', так и N3 вставочного основания связаны менее тесно с малой бороздкой дуплекса. Мотивы типов 0 и III слабее и неспецифичны, поскольку они опосредованы взаимодействиями с одним 2'-OH (см. рисунок: Взаимодействия A-minor — взаимодействия типа 0 и типа III).
Мотив A-minor является одним из наиболее распространенных структурных мотивов РНК в рибосоме, где он способствует связыванию тРНК с субъединицей 23S. [43] Чаще всего они стабилизируют дуплексные взаимодействия РНК в петлях и спиралях, например, в ядре интронов группы II. [6]
Интересным примером A-минора является его роль в распознавании антикодона . Рибосома должна различать правильные и неправильные пары кодон-антикодон. Она делает это, отчасти, посредством вставки адениновых оснований в малую бороздку. Неправильные пары кодон-антикодон будут представлять собой искаженную спиральную геометрию, которая не позволит взаимодействию A-минора стабилизировать связывание и увеличит скорость диссоциации неправильной тРНК. [44]
Анализ A-минорных мотивов в рибосомальной РНК 23S выявил иерархическую сеть структурных зависимостей, предположительно связанных с эволюцией рибосом и порядком событий, которые привели к развитию современной большой субъединицы бактерий. [45]
Сообщается, что мотив A-minor и его новый подкласс, взаимодействия WC/H A-minor, укрепляют другие третичные структуры РНК, такие как тройные спирали большой бороздки, идентифицированные в элементах стабилизации РНК. [16] [15]
Рибосная молния
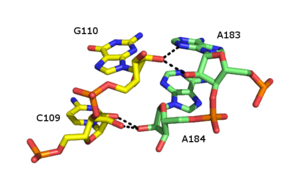
Рибозная молния — это третичный структурный элемент РНК , в котором две цепи РНК удерживаются вместе водородными связями, включающими 2'OH рибозных сахаров на разных цепях. 2'OH может вести себя как донор и акцептор водородных связей, что позволяет образовывать раздвоенные водородные связи с другим 2'OH. [46] [47]
Было описано множество форм рибозной молнии, но распространенный тип включает четыре водородные связи между 2'-OH группами двух соседних сахаров. Рибозные молнии обычно встречаются в массивах, которые стабилизируют взаимодействия между отдельными цепями РНК. [48] Рибозные молнии часто наблюдаются как взаимодействия Stem-Loop с очень низкой специфичностью последовательности. Однако в малых и больших рибосомных субъединицах существует склонность к рибозным молниям последовательности CC/AA — два цитозина в первой цепи в паре с двумя аденинами во второй цепи.
Роль ионов металлов
Функциональные РНК часто представляют собой свернутые, стабильные молекулы с трехмерными формами, а не гибкие, линейные нити. [50] Катионы необходимы для термодинамической стабилизации третичных структур РНК. Катионы металлов, связывающие РНК, могут быть одновалентными, двухвалентными или трехвалентными. Калий (K + ) является распространенным одновалентным ионом, связывающим РНК. Распространенным двухвалентным ионом, связывающим РНК, является магний (Mg 2+ ). Было обнаружено, что другие ионы, включая натрий (Na + ), кальций (Ca 2+ ) и марганец (Mn 2+ ), связывают РНК in vivo и in vitro . Многовалентные органические катионы, такие как спермидин или спермин, также встречаются в клетках, и они вносят важный вклад в сворачивание РНК. Трехвалентные ионы, такие как гексамин кобальта, или ионы лантаноидов, такие как тербий (Tb 3+ ), являются полезными экспериментальными инструментами для изучения связывания металлов с РНК. [51] [52]
Ион металла может взаимодействовать с РНК несколькими способами. Ион может диффузно связываться с остовом РНК, экранируя в противном случае неблагоприятные электростатические взаимодействия . Этот экран заряда часто выполняется одновалентными ионами. Связанные с сайтом ионы стабилизируют определенные элементы третичной структуры РНК. Связанные с сайтом взаимодействия можно далее подразделить на две категории в зависимости от того, опосредует ли вода связывание металла. Взаимодействия «внешней сферы» опосредуются молекулами воды, которые окружают ион металла. Например, гексагидрат магния взаимодействует и стабилизирует определенные мотивы третичной структуры РНК посредством взаимодействий с гуанозином в большой бороздке. Наоборот, взаимодействия «внутренней сферы» напрямую опосредуются ионом металла. РНК часто сворачивается в несколько стадий, и эти стадии могут стабилизироваться различными типами катионов. На ранних стадиях РНК образует вторичные структуры , стабилизированные посредством связывания одновалентных катионов, двухвалентных катионов и полианионных аминов с целью нейтрализации полианионной основы. Более поздние стадии этого процесса включают формирование третичной структуры РНК, которая стабилизируется почти в основном посредством связывания двухвалентных ионов, таких как магний, с возможным вкладом связывания калия.
Металл-связывающие сайты часто локализуются в глубокой и узкой большой бороздке дуплекса РНК, координируясь с краями Хугстина пуринов . В частности, катионы металлов стабилизируют сайты скручивания остова, где плотная упаковка фосфатов приводит к образованию области плотного отрицательного заряда. В кристаллических структурах было выявлено несколько мотивов связывания ионов металлов в дуплексах РНК. Например, в домене P4-P6 интрона группы I Tetrahymena thermophila несколько сайтов связывания ионов состоят из тандемных пар колебаний GU и тандемных несоответствий GA , в которых двухвалентные катионы взаимодействуют с краем Хугстина гуанозина через O6 и N7. [53] [54] [55] Другим мотивом связывания ионов в интроне группы I Tetrahymena является мотив платформы AA, в котором последовательные аденозины в одной и той же цепи РНК образуют неканоническую пару псевдооснований. [56] В отличие от тандемного мотива GU, мотив платформы AA связывается преимущественно с одновалентными катионами. Во многих из этих мотивов отсутствие одновалентных или двухвалентных катионов приводит либо к большей гибкости, либо к потере третичной структуры.
Двухвалентные ионы металлов, особенно магния , оказались важными для структуры соединений ДНК, таких как промежуточное соединение Холлидея в генетической рекомбинации . Ион магния защищает отрицательно заряженные фосфатные группы в соединении и позволяет им располагаться ближе друг к другу, допуская сложенную конформацию, а не несложенную. [57] Магний жизненно важен для стабилизации этих типов соединений в искусственно созданных структурах, используемых в нанотехнологии ДНК , таких как мотив двойного кроссинговера. [58]
История
Самые ранние работы в области структурной биологии РНК совпали, более или менее, с работами, которые велись с ДНК в начале 1950-х годов. В своей основополагающей статье 1953 года Уотсон и Крик предположили, что ван-дер-ваальсово скучивание группой 2`OH рибозы не позволит РНК принять двойную спиральную структуру, идентичную предложенной ими модели — то, что мы теперь знаем как B-форму ДНК. [59] Это вызвало вопросы о трехмерной структуре РНК: может ли эта молекула образовывать некий тип спиральной структуры, и если да, то как?
В середине 1960-х годов роль тРНК в синтезе белка интенсивно изучалась. В 1965 году Холли и др. очистили и секвенировали первую молекулу тРНК, первоначально предположив, что она приняла структуру клеверного листа, основанную в основном на способности определенных участков молекулы образовывать структуры стебель-петля. [60] Выделение тРНК оказалось первым крупным достижением в структурной биологии РНК. В 1971 году Ким и др. добились еще одного прорыва, создав кристаллы дрожжевой тРНК PHE , которые дифрагировали до разрешения 2-3 Ангстрема с использованием спермина, встречающегося в природе полиамина , который связывался с тРНК и стабилизировал ее. [61]
В течение значительного времени после первых структур тРНК область структуры РНК не претерпела значительных изменений. Возможность изучения структуры РНК зависела от возможности выделения РНК-мишени. Это оказалось ограничивающим для области на многие годы, отчасти потому, что другие известные мишени — например, рибосому — было значительно сложнее выделить и кристаллизовать. Таким образом, в течение примерно двадцати лет после первоначальной публикации структуры тРНК PHE были решены структуры только нескольких других РНК-мишеней, причем почти все они принадлежали к семейству транспортных РНК. [62]
Этот досадный недостаток масштаба в конечном итоге был преодолен в значительной степени благодаря двум основным достижениям в исследовании нуклеиновых кислот: идентификации рибозимов и возможности их получения посредством транскрипции in vitro . После публикации Тома Чеха, подразумевающей интрон группы I Tetrahymena как автокаталитический рибозим [63] , и отчета Сиднея Альтмана о катализе рибонуклеазой P РНК [64] , в конце 1980-х годов были идентифицированы несколько других каталитических РНК, [65] включая рибозим молотоголовый. В 1994 году Маккей и др. опубликовали структуру «комплекса РНК молотоголовый-ДНК рибозим-ингибитор» с разрешением 2,6 Ангстрема, в котором автокаталитическая активность рибозима была нарушена путем связывания с субстратом ДНК. [66] В дополнение к достижениям в определении глобальной структуры с помощью кристаллографии, в начале 1990-х годов также наблюдалось внедрение ЯМР как мощного метода в структурной биологии РНК. Такие исследования, как это, позволили более точно охарактеризовать взаимодействия пар оснований и укладки оснований, которые стабилизировали глобальные складки больших молекул РНК.
Возрождение структурной биологии РНК в середине 1990-х годов вызвало настоящий взрыв в области структурных исследований нуклеиновых кислот. Со времени публикации структур «молотоголовый» и P 4-6 было сделано множество крупных вкладов в эту область. Некоторые из наиболее примечательных примеров включают структуры интронов группы I и группы II [6] и рибосомы [42] . Первые три структуры были получены с использованием транскрипции in vitro , и этот ЯМР сыграл свою роль в исследовании частичных компонентов всех четырех структур — свидетельство незаменимости обоих методов для исследования РНК. Нобелевская премия по химии 2009 года была присуждена Аде Йонат , Венкатраману Рамакришнану и Томасу Стейтцу за их структурную работу по рибосоме , продемонстрировавшую важную роль структурной биологии РНК в современной молекулярной биологии.
Смотрите также
Ссылки
- ^ IUPAC , Compendium of Chemical Terminology , 2nd ed. («Золотая книга») (1997). Онлайн-исправленная версия: (2006–) «третичная структура». doi :10.1351/goldbook.T06282
- ^ Richmond TJ, Davey CA (май 2003). «Структура ДНК в ядре нуклеосомы». Nature . 423 (6936): 145–50. Bibcode :2003Natur.423..145R. doi :10.1038/nature01595. PMID 12736678. S2CID 205209705.
- ^ Watson JD, Crick FH (апрель 1953). «Молекулярная структура нуклеиновых кислот; структура дезоксирибозонуклеиновой кислоты» (PDF) . Nature . 171 (4356): 737–8. Bibcode :1953Natur.171..737W. doi :10.1038/171737a0. PMID 13054692. S2CID 4253007.
- ^ Бансал М (2003). «Структура ДНК: Пересмотр двойной спирали Уотсона-Крика». Current Science . 85 (11): 1556–1563.
- ^ Ghosh A, Bansal M (2003). «Словарь структур ДНК от A до Z». Acta Crystallogr D. 59 ( 4): 620–626. doi :10.1107/S0907444903003251. PMID 12657780.
- ^ abcde PDB : 3BWP ; Toor N, Keating KS, Taylor SD, Pyle AM (апрель 2008 г.). «Кристаллическая структура самосплайсированного интрона группы II». Science . 320 (5872): 77–82. Bibcode :2008Sci...320...77T. doi :10.1126/science.1153803. PMC 4406475 . PMID 18388288. ; визуализировано с помощью PyMOL
- ^ ab PDB : 2K95 ; Kim NK, Zhang Q, Zhou J, Theimer CA, Peterson RD, Feigon J (декабрь 2008 г.). «Структура решения и динамика псевдоузла дикого типа человеческой теломеразной РНК». J. Mol. Biol . 384 (5): 1249–61. doi :10.1016/j.jmb.2008.10.005. PMC 2660571 . PMID 18950640. ; визуализировано с помощью PyMOL
- ^ ab Nissen P, Ippolito JA, Ban N, Moore PB, Steitz TA (апрель 2001 г.). "Третичные взаимодействия РНК в большой рибосомальной субъединице: мотив A-minor". Proc. Natl. Acad. Sci. USA . 98 (9): 4899–903. Bibcode :2001PNAS...98.4899N. doi : 10.1073/pnas.081082398 . PMC 33135 . PMID 11296253.
- ^ ab Doherty EA, Batey RT, Masquida B, Doudna JA (апрель 2001 г.). «Универсальный способ упаковки спиралей в РНК». Nat. Struct. Biol . 8 (4): 339–43. doi :10.1038/86221. PMID 11276255. S2CID 213577.
- ^ Szewczak AA, Ortoleva-Donnelly L, Ryder SP, Moncoeur E, Strobel SA (декабрь 1998 г.). «Тройная спираль малой бороздки РНК в каталитическом ядре интрона группы I». Nat. Struct. Biol . 5 (12): 1037–42. doi :10.1038/4146. PMID 9846872. S2CID 10908125.
- ^ Boudvillain M, de Lencastre A, Pyle AM (июль 2000 г.). «Третичное взаимодействие, связывающее домены активного сайта с сайтом сплайсинга 5' интрона группы II». Nature . 406 (6793): 315–8. Bibcode :2000Natur.406..315B. doi :10.1038/35018589. PMID 10917534. S2CID 4336795.
- ^ abc PDB : 1RAU ; Cheong C, Moore PB (сентябрь 1992 г.). «Структура раствора необычно стабильного тетраплекса РНК, содержащего структуры G- и U-квартета». Биохимия . 31 (36): 8406–14. doi :10.1021/bi00151a003. PMID 1382577.; визуализировано с помощью PyMOL
- ^ ab PDB : 1FIT ; Baugh C, Grate D, Wilson C (август 2000 г.). "2.8 Кристаллическая структура аптамера малахитового зеленого". J. Mol. Biol . 301 (1): 117–28. doi :10.1006/jmbi.2000.3951. PMID 10926496.; визуализировано с помощью PyMOL
- ^ Gilbert SD, Rambo RP, Van Tyne D, Batey RT (февраль 2008 г.). «Структура рибопереключателя SAM-II, связанного с S-аденозилметионином». Nat. Struct. Mol. Biol . 15 (2): 177–82. doi :10.1038/nsmb.1371. PMID 18204466. S2CID 40791601.
- ^ ab Mitton-Fry RM, DeGregorio SJ, Wang J, Steitz TA, Steitz JA (ноябрь 2010 г.). «Распознавание поли(А) хвоста вирусным элементом РНК посредством сборки тройной спирали». Science . 330 (6008): 1244–7. Bibcode :2010Sci...330.1244M. doi :10.1126/science.1195858. PMC 3074936 . PMID 21109672.
- ^ ab Torabi SF, Vaidya AT, Tycowski KT, DeGregorio SJ, Wang J, Shu MD и др. (январь 2021 г.). «Стабилизация РНК с помощью кармана связывания 3'-конца поли(A)-хвоста и других режимов взаимодействия поли(A)-РНК». Science . 371 (6529). doi : 10.1126/science.abe6523 . ISSN 0036-8075. PMC 9491362 . PMID 33414189. S2CID 231195473.
- ^ ab Batey RT, Gilbert SD, Montange RK (ноябрь 2004 г.). «Структура природного гуанин-чувствительного рибопереключателя в комплексе с метаболитом гипоксантином». Nature . 432 (7015): 411–5. Bibcode :2004Natur.432..411B. doi :10.1038/nature03037. PMID 15549109. S2CID 2462025.
- ^ Arthanari H, Bolton PH (март 2001 г.). «Функциональные и дисфункциональные роли квадруплексной ДНК в клетках». Chem. Biol . 8 (3): 221–30. doi : 10.1016/S1074-5521(01)00007-2 . PMID 11306347.
- ^ Оливер AW, Богдарина I, Шредер E, Тейлор IA, Книл GG (август 2000 г.). «Предпочтительное связывание белка гена fd 5 с тетраплексными структурами нуклеиновых кислот». J. Mol. Biol . 301 (3): 575–84. doi :10.1006/jmbi.2000.3991. PMID 10966771.
- ^ PDB : 6tna ; Sussman JL, Holbrook SR, Warrant RW, Church GM, Kim SH (август 1978). «Кристаллическая структура РНК-переносчика фенилаланина дрожжей. I. Кристаллографическое уточнение». J. Mol. Biol . 123 (4): 607–30. doi :10.1016/0022-2836(78)90209-7. PMID 357742.; визуализировано с помощью PyMOL.
- ^ ab Quigley GJ, Rich A (ноябрь 1976 г.). «Структурные домены молекул транспортной РНК». Science . 194 (4267): 796–806. Bibcode :1976Sci...194..796Q. doi :10.1126/science.790568. PMID 790568.
- ^ "Дуглас Х. Тернер". Правила Тернера . Кафедра химии, Рочестерский университет.
- ^ Walter AE, Turner DH, Kim J, Lyttle MH, Müller P, Mathews DH, Zuker M (сентябрь 1994 г.). «Коаксиальная укладка спиралей усиливает связывание олигорибонуклеотидов и улучшает прогнозы укладки РНК». Proc. Natl. Acad. Sci. USA . 91 (20): 9218–22. Bibcode :1994PNAS...91.9218W. doi : 10.1073/pnas.91.20.9218 . PMC 44783 . PMID 7524072.
- ^ Murphy FL, Wang YH, Griffith JD, Cech TR (сентябрь 1994 г.). «Коаксиально сложенные спирали РНК в каталитическом центре рибозима Tetrahymena». Science . 265 (5179): 1709–12. Bibcode :1994Sci...265.1709M. doi :10.1126/science.8085157. PMID 8085157.
- ^ abc Cate JH, Gooding AR, Podell E, Zhou K, Golden BL, Kundrot CE, Cech TR, Doudna JA (сентябрь 1996 г.). «Кристаллическая структура домена рибозима группы I: принципы упаковки РНК». Science . 273 (5282): 1678–85. Bibcode :1996Sci...273.1678C. doi :10.1126/science.273.5282.1678. PMID 8781224. S2CID 38185676.
- ^ Noller HF (сентябрь 2005 г.). «Структура РНК: чтение рибосомы». Science . 309 (5740): 1508–14. Bibcode :2005Sci...309.1508N. doi :10.1126/science.1111771. PMID 16141058. S2CID 16577145.
- ^ Ли А.Дж., Крозерс Д.М. (август 1998 г.). «Структура решения комплекса петля-петля РНК: последовательность инвертированной петли ColE1». Структура . 6 (8): 993–1005. doi : 10.1016/S0969-2126(98)00101-4 . PMID 9739090.
- ^ Ферре-Д'Амаре AR, Чжоу K, Дудна JA (октябрь 1998 г.). «Кристаллическая структура рибозима вируса гепатита дельта». Nature . 395 (6702): 567–74. Bibcode :1998Natur.395..567F. doi :10.1038/26912. PMID 9783582. S2CID 4359811.
- ^ Rothemund PW (март 2006 г.). «Сворачивание ДНК для создания наноразмерных форм и узоров» (PDF) . Nature . 440 (7082): 297–302. Bibcode : 2006Natur.440..297R. doi : 10.1038/nature04586. PMID 16541064. S2CID 4316391.
- ^ ab Баннерджи, Абхинав; Ананд, Микки; Калита, Симанта; Ганджи, Махипал (декабрь 2023 г.). «Анализ одиночных молекул энергетики укладки оснований ДНК с использованием узорчатых наноструктур ДНК». Nature Nanotechnology . 18 (12): 1474–1482. Bibcode :2023NatNa..18.1474B. doi :10.1038/s41565-023-01485-1. PMC 10716042 . PMID 37591937.
- ^ Яковчук, Питер; Протозанова, Екатерина; Франк-Каменецкий, Максим Д. (2006). «Вклад стэкинга и спаривания оснований в термическую стабильность двойной спирали ДНК». Nucleic Acids Research . 34 (2): 564–574. doi :10.1093/nar/gkj454. PMC 1360284. PMID 16449200.
- ^ КИЛХЕРР, ФАБИАН; ВАХАУФ, КРИСТИАН; ПЕЛЬЦ, БЕНДЖАМИН; РИФ, МАТТИАС; ЗАХАРИЯ, МАРТИН; ДИТЦ, ХЕНДРИК (2016). «Одномолекулярное рассечение сил укладки в ДНК». Наука . 353 (6304). doi : 10.1126/science.aaf5508. ПМИД 27609897.
- ^ abcd PDB : 1GID ; Cate JH, Gooding AR, Podell E, Zhou K, Golden BL, Kundrot CE, Cech TR, Doudna JA (сентябрь 1996 г.). "Кристаллическая структура домена рибозима группы I: принципы упаковки РНК". Science . 273 (5282): 1678–85. Bibcode :1996Sci...273.1678C. doi :10.1126/science.273.5282.1678. PMID 8781224. S2CID 38185676.; визуализировано с помощью PyMOL
- ^ Nakano M, Moody EM, Liang J, Bevilacqua PC (декабрь 2002 г.). «Отбор термодинамически стабильных тетрапетель ДНК с использованием электрофореза в градиенте температуры выявляет четыре мотива: d(cGNNAg), d(cGNABg), d(cCNNGg) и d(gCNNGc)». Биохимия . 41 (48): 14281–92. doi :10.1021/bi026479k. PMID 12450393.
- ^ Мур ПБ (1999). «Структурные мотивы в РНК». Annu. Rev. Biochem . 68 (1): 287–300. doi :10.1146/annurev.biochem.68.1.287. PMID 10872451.
- ^ Abramovitz DL, Pyle AM (февраль 1997 г.). «Замечательная морфологическая изменчивость общего мотива сворачивания РНК: взаимодействие тетрапетли GNRA с рецептором». J. Mol. Biol . 266 (3): 493–506. doi : 10.1006/jmbi.1996.0810 . PMID 9067606.
- ^ Moody EM, Feerrar JC, Bevilacqua PC (июнь 2004 г.). «Доказательства того, что сворачивание шпильки тетрапетли РНК менее кооперативно, чем ее аналога в ДНК». Биохимия . 43 (25): 7992–8. doi :10.1021/bi049350e. PMID 15209494.
- ^ Zhao Q, Huang HC, Nagaswamy U, Xia Y, Gao X, Fox GE (август 2012 г.). «Тетраплеты UNAC: в какой степени они имитируют тетрапетли GNRA?». Биополимеры . 97 (8): 617–628. doi :10.1002/bip.22049. PMID 22605553.
- ^ Уильямс Д. Х., Гейт М. Дж., Лоукс Д. (2006). Нуклеиновые кислоты в химии и биологии . Кембридж, Великобритания: RSC Pub. ISBN 0-85404-654-2.
- ^ ab Jaeger L, Michel F, Westhof E (март 1994). "Участие тетрапетли GNRA в третичных взаимодействиях РНК на больших расстояниях". J. Mol. Biol . 236 (5): 1271–6. doi :10.1016/0022-2836(94)90055-8. PMID 7510342.
- ^ Мишель Ф., Вестхоф Э. (декабрь 1990 г.). «Моделирование трехмерной архитектуры каталитических интронов группы I на основе сравнительного анализа последовательностей». J. Mol. Biol . 216 (3): 585–610. doi :10.1016/0022-2836(90)90386-Z. PMID 2258934.
- ^ abc PDB : 1FFK ; Ban N, Nissen P, Hansen J, Moore PB, Steitz TA (август 2000 г.). «Полная атомная структура большой рибосомальной субъединицы с разрешением 2,4 А». Science . 289 (5481): 905–20. Bibcode :2000Sci...289..905B. doi :10.1126/science.289.5481.905. PMID 10937989.; визуализировано с помощью PyMOL
- ^ Nissen P, Ippolito JA, Ban N, Moore PB, Steitz TA (апрель 2001 г.). «Третичные взаимодействия РНК в большой рибосомальной субъединице: мотив A-minor». Proc. Natl. Acad. Sci. USA . 98 (9): 4899–903. Bibcode :2001PNAS...98.4899N. doi : 10.1073/pnas.081082398 . PMC 33135 . PMID 11296253.
- ^ Yoshizawa S, Fourmy D, Puglisi JD (сентябрь 1999 г.). «Распознавание кодон-антикодоновой спирали рибосомной РНК». Science . 285 (5434): 1722–5. doi :10.1126/science.285.5434.1722. PMID 10481006.
- ^ Боков К, Штейнберг СВ (февраль 2009). "Иерархическая модель эволюции 23S рибосомальной РНК". Nature . 457 (7232): 977–80. Bibcode :2009Natur.457..977B. doi :10.1038/nature07749. PMID 19225518. S2CID 4400869.
- ^ Batey RT, Rambo RP, Doudna JA (август 1999). «Третичные мотивы в структуре и фолдинге РНК». Angew. Chem. Int. Ed. Engl . 38 (16): 2326–2343. doi :10.1002/(SICI)1521-3773(19990816)38:16<2326::AID-ANIE2326>3.0.CO;2-3. PMID 10458781.
- ^ Тамура М, Холбрук SR (июль 2002 г.). «Последовательность и структурная консервация в РНК-рибозных молниях». J. Mol. Biol . 320 (3): 455–74. doi :10.1016/S0022-2836(02)00515-6. PMID 12096903.
- ^ PDB : 3IGI ; Toor N, Keating KS, Fedorova O, Rajashankar K, Wang J, Pyle AM (январь 2010 г.). «Третичная архитектура интрона группы II Oceanobacillus iheyensis». РНК . 16 (1): 57–69. doi :10.1261/rna.1844010. PMC 2802037 . PMID 19952115. ; визуализировано с использованием PyMOL.
- ^ PDB : 1ZZN ; Stahley MR, Strobel SA (сентябрь 2005 г.). «Структурные доказательства двухметаллического механизма сплайсинга интронов группы I». Science . 309 (5740): 1587–90. Bibcode : 2005Sci...309.1587S. doi : 10.1126/science.1114994. PMID 16141079. S2CID 40099718.; визуализировано с помощью PyMOL
- ^ Celander DW, Cech TR (январь 1991). «Визуализация сворачивания более высокого порядка каталитической молекулы РНК». Science . 251 (4992): 401–7. Bibcode :1991Sci...251..401C. doi :10.1126/science.1989074. PMID 1989074.
- ^ Pyle AM (сентябрь 2002 г.). «Ионы металлов в структуре и функции РНК». J. Biol. Inorg. Chem . 7 (7–8): 679–90. doi :10.1007/s00775-002-0387-6. PMID 12203005. S2CID 42008484.
- ^ Morrow JR, Andolina CM (2012). "Глава 6. Спектроскопические исследования связывания ионов лантаноидов с нуклеиновыми кислотами". В Sigel A, Sigel H, Sigel RK (ред.). Взаимодействие между ионами металлов и нуклеиновыми кислотами . Ионы металлов в науках о жизни. Том 10. Springer. стр. 171–197. doi :10.1007/978-94-007-2172-2_6. ISBN 978-94-007-2171-5. PMID 22210339.
- ^ Cate JH, Doudna JA (октябрь 1996 г.). «Металло-связывающие сайты в большой бороздке большого домена рибозима». Структура . 4 (10): 1221–9. doi : 10.1016/S0969-2126(96)00129-3 . PMID 8939748.
- ^ Кифт Дж. С., Тиноко И. (май 1997 г.). «Структура раствора участка связывания металла в большой бороздке РНК, комплексированной с гексаммином кобальта (III)». Структура . 5 (5): 713–21. doi : 10.1016/S0969-2126(97)00225-6 . PMID 9195889.
- ^ Рюдиссер С., Тиноко И. (февраль 2000 г.). «Структура раствора гексаммина кобальта(III), комплексированного с тетрапетлей GAAA, и связывание ионов металла с несоответствиями G·A». J. Mol. Biol . 295 (5): 1211–23. doi :10.1006/jmbi.1999.3421. PMID 10653698.
- ^ Burkhardt C, Zacharias M (октябрь 2001 г.). «Моделирование связывания ионов с мотивами платформы AA в РНК: исследование континуума растворителя, включая конформационную адаптацию». Nucleic Acids Res . 29 (19): 3910–8. doi : 10.1093/nar/29.19.3910. PMC 60250. PMID 11574672.
- ^ Panyutin IG, Biswas I, Hsieh P (апрель 1995). "Основная роль структуры соединения Холлидея в миграции ветвей ДНК". The EMBO Journal . 14 (8): 1819–26. doi :10.1002/j.1460-2075.1995.tb07170.x. PMC 398275. PMID 7737132 .
- ^ Fu TJ, Seeman NC (апрель 1993 г.). «ДНК-молекулы двойного кроссинговера». Биохимия . 32 (13): 3211–20. doi :10.1021/bi00064a003. PMID 8461289.
- ^ Watson JD, Crick FH (апрель 1953 г.). «Молекулярная структура нуклеиновых кислот; структура дезоксирибозонуклеиновой кислоты» (PDF) . Nature . 171 (4356): 737–738. Bibcode :1953Natur.171..737W. doi :10.1038/171737a0. PMID 13054692. S2CID 4253007.
- ^ Холли, Р. В., Апгар, Дж., Эверетт, ГА, Мэдисон, Дж. Т., Маргисс, М., Меррилл, Ш. Х., Пенвик, Дж. Р., Замир (март 1965 г.). «Структура рибонуклеиновой кислоты». Science . 147 (3664): 1462–5. Bibcode :1965Sci...147.1462H. doi :10.1126/science.147.3664.1462. PMID 14263761. S2CID 40989800.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ^ Kim SH, Quigley G, Suddath FL, Rich A (апрель 1971 г.). «Высокоразрешающие рентгеновские дифракционные картины кристаллической транспортной РНК, которые показывают спиральные области». Proc. Natl. Acad. Sci. USA . 68 (4): 841–5. doi : 10.1073/pnas.68.4.841 . PMC 389056 . PMID 5279525.
- ^ Shen LX, Cai Z, Tinoco I (август 1995). «Структура РНК с высоким разрешением». FASEB J . 9 (11): 1023–33. doi : 10.1096/fasebj.9.11.7544309 . PMID 7544309. S2CID 40621440.
- ^ Cech TR, Zaug AJ, Grabowski PJ (декабрь 1981 г.). «In vitro сплайсинг предшественника рибосомальной РНК Tetrahymena: участие гуанозинового нуклеотида в вырезании промежуточной последовательности». Cell . 27 (3 Pt 2): 487–96. doi :10.1016/0092-8674(81)90390-1. PMID 6101203. S2CID 17674600.
- ^ Stark BC, Kole R, Bowman EJ, Altman S (август 1978). «Рибонуклеаза P: фермент с существенным компонентом РНК». Proc. Natl. Acad. Sci. USA . 75 (8): 3717–21. Bibcode :1978PNAS...75.3717S. doi : 10.1073/pnas.75.8.3717 . PMC 392857 . PMID 358197.
- ^ Prody GA, Bakos JT, Buzayan JM, Schneider IR, Bruening G (март 1986 г.). «Автолитическая обработка РНК-сателлита димерных растительных вирусов». Science . 231 (4745): 1577–1580. Bibcode :1986Sci...231.1577P. doi :10.1126/science.231.4745.1577. PMID 17833317. S2CID 21563490.
- ^ Pley HW, Flaherty KM, McKay DB (ноябрь 1994). "Трехмерная структура рибозима молотковидной формы". Nature . 372 (6501): 68–74. Bibcode :1994Natur.372...68P. doi :10.1038/372068a0. PMID 7969422. S2CID 4333072.