ДНК-нанотехнология
| Часть серии статей на тему |
| Молекулярная самосборка |
|---|
 |
|
ДНК-нанотехнология — это проектирование и производство искусственных структур нуклеиновых кислот для технологических целей. В этой области нуклеиновые кислоты используются в качестве небиологических инженерных материалов для нанотехнологий, а не в качестве носителей генетической информации в живых клетках . Исследователи в этой области создали статические структуры, такие как двух- и трехмерные кристаллические решетки , нанотрубки , многогранники и произвольные формы, а также функциональные устройства, такие как молекулярные машины и ДНК-компьютеры . Область начинает использоваться в качестве инструмента для решения фундаментальных научных проблем в структурной биологии и биофизике , включая приложения в рентгеновской кристаллографии и ядерно-магнитной резонансной спектроскопии белков для определения структур. Также изучаются потенциальные приложения в молекулярной электронике и наномедицине .
Концептуальная основа ДНК-нанотехнологии была впервые заложена Надрианом Симаном в начале 1980-х годов, и область начала привлекать широкий интерес в середине 2000-х годов. Такое использование нуклеиновых кислот стало возможным благодаря их строгим правилам спаривания оснований , которые заставляют только части нитей с комплементарными последовательностями оснований связываться вместе, образуя прочные, жесткие структуры двойной спирали . Это позволяет рационально проектировать последовательности оснований , которые будут выборочно собираться, образуя сложные целевые структуры с точно контролируемыми наномасштабными характеристиками. Для создания этих структур используется несколько методов сборки, включая структуры на основе плиток, которые собираются из более мелких структур, складчатые структуры с использованием метода ДНК-оригами и динамически реконфигурируемые структуры с использованием методов смещения нитей. Название области конкретно ссылается на ДНК , но те же принципы использовались и с другими типами нуклеиновых кислот, что привело к периодическому использованию альтернативного названия нанотехнология нуклеиновых кислот .
История
Концептуальная основа ДНК-нанотехнологии была впервые заложена Надрианом Симаном в начале 1980-х годов. [2] Первоначальная мотивация Симана состояла в создании трехмерной решетки ДНК для ориентации других крупных молекул, что упростило бы их кристаллографическое исследование за счет устранения сложного процесса получения чистых кристаллов. Сообщается, что эта идея пришла ему в голову в конце 1980-х годов после осознания сходства между гравюрой на дереве Depth М. К. Эшера и массивом шестилучевых соединений ДНК. [3] [4] В то время было известно несколько естественных разветвленных структур ДНК, включая репликативную вилку ДНК и подвижное соединение Холлидея , но идея Симана заключалась в том, что неподвижные соединения нуклеиновых кислот могут быть созданы путем правильного проектирования последовательностей нитей для удаления симметрии в собранной молекуле, и что эти неподвижные соединения в принципе могут быть объединены в жесткие кристаллические решетки. Первая теоретическая работа, предлагающая эту схему, была опубликована в 1982 году, а первая экспериментальная демонстрация неподвижного соединения ДНК была опубликована в следующем году. [5] [6]

В 1991 году лаборатория Симана опубликовала отчет о синтезе куба из ДНК, первой синтетической трехмерной наноструктуры нуклеиновой кислоты, за которую он получил премию Фейнмана по нанотехнологиям 1995 года . За этим последовал усеченный октаэдр ДНК . Вскоре стало ясно, что эти структуры, многоугольные формы с гибкими соединениями в качестве вершин , недостаточно жесткие, чтобы образовывать протяженные трехмерные решетки. Симан разработал более жесткий структурный мотив двойного кроссовера (DX) , и в 1998 году в сотрудничестве с Эриком Уинфри опубликовал создание двумерных решеток из плиток DX. [3] [2] [7] Эти структуры на основе плиток имели то преимущество, что они обеспечивали возможность реализации ДНК-вычислений, что было продемонстрировано Уинфри и Полом Ротемундом в их статье 2004 года об алгоритмической самосборке структуры прокладки Серпинского, и за которую они разделили премию Фейнмана 2006 года в области нанотехнологий. Ключевое открытие Уинфри состояло в том, что плитки DX можно использовать как плитки Вана , что означает, что их сборка может выполнять вычисления. [2] Синтез трехмерной решетки был наконец опубликован Симаном в 2009 году, почти через тридцать лет после того, как он намеревался достичь этого. [8]
Новые возможности продолжали открываться для спроектированных структур ДНК на протяжении 2000-х годов. Первая ДНК-наномашина — мотив, который изменяет свою структуру в ответ на вход — была продемонстрирована в 1999 году Симаном. Улучшенная система, которая была первым устройством нуклеиновой кислоты, использующим смещение нити, опосредованное точкой опоры, была продемонстрирована Бернардом Юрке в 2000 году. [9] Следующим шагом вперед стало преобразование этого в механическое движение, и в 2004 и 2005 годах несколько систем ДНК-ходок были продемонстрированы группами Симана, Найлза Пирса , Эндрю Терберфилда и Чэндэ Мао. [10] Идея использования массивов ДНК для шаблонизации сборки других молекул, таких как наночастицы и белки, впервые предложенная Брюшем Робинсоном и Симаном в 1987 году, [11] была продемонстрирована в 2002 году Симаном, Килем и др. [12] и впоследствии многими другими группами.
В 2006 году Ротемунд впервые продемонстрировал метод ДНК-оригами для легкого и надежного формирования складчатых структур ДНК произвольной формы. Ротемунд задумал этот метод как концептуально промежуточный между решетками DX Зеемана, которые использовали много коротких нитей, и ДНК-октаэдром Уильяма Ши, который состоял в основном из одной очень длинной нити. ДНК-оригами Ротемунда содержит длинную нить, сворачиванию которой способствуют несколько коротких нитей. Этот метод позволил формировать гораздо более крупные структуры, чем это было возможно ранее, и которые менее технически сложны для проектирования и синтеза. [7] ДНК-оригами было главной темой журнала Nature 15 марта 2006 года. [13] За исследованиями Ротемунда, демонстрирующими двумерные структуры ДНК-оригами, последовала демонстрация Дугласом и др. сплошных трехмерных ДНК-оригами. в 2009 году [14] , в то время как лаборатории Йоргена Кьемса и Яна продемонстрировали полые трехмерные структуры, сделанные из двумерных граней. [8]
ДНК-нанотехнология изначально была встречена с некоторым скептицизмом из-за необычного небиологического использования нуклеиновых кислот в качестве материалов для строительства структур и выполнения вычислений, а также преобладания экспериментов по доказательству принципа , которые расширили возможности области, но были далеки от фактического применения. Статья Симана 1991 года о синтезе куба ДНК была отклонена журналом Science после того, как один рецензент похвалил ее оригинальность, а другой раскритиковал ее за отсутствие биологической значимости. [15] К началу 2010-х годов считалось, что область расширила свои возможности до такой степени, что приложения для фундаментальных научных исследований начали реализовываться, а практические приложения в медицине и других областях начали считаться осуществимыми. [8] [16] Область выросла с очень немногих активных лабораторий в 2001 году до по крайней мере 60 в 2010 году, что увеличило кадровый резерв и, таким образом, количество научных достижений в этой области за это десятилетие. [17]
Фундаментальные концепции


Свойства нуклеиновых кислот
Нанотехнология часто определяется как изучение материалов и устройств с характеристиками в масштабе ниже 100 нанометров . ДНК-нанотехнология, в частности, является примером молекулярной самосборки снизу вверх , в которой молекулярные компоненты спонтанно организуются в стабильные структуры; конкретная форма этих структур индуцируется физическими и химическими свойствами компонентов, выбранных дизайнерами. [19] В ДНК-нанотехнологии компонентными материалами являются нити нуклеиновых кислот, таких как ДНК; эти нити часто являются синтетическими и почти всегда используются вне контекста живой клетки. ДНК хорошо подходит для наномасштабного строительства, поскольку связывание между двумя нитями нуклеиновых кислот зависит от простых правил спаривания оснований , которые хорошо понятны, и образуют конкретную наномасштабную структуру двойной спирали нуклеиновой кислоты . Эти качества позволяют легко контролировать сборку структур нуклеиновых кислот с помощью дизайна нуклеиновых кислот . Это свойство отсутствует в других материалах, используемых в нанотехнологиях, включая белки , для которых проектирование белков очень сложно, и наночастицы , которые не обладают способностью к самостоятельной специфической сборке. [5]
Структура молекулы нуклеиновой кислоты состоит из последовательности нуклеотидов, отличающихся тем, какое нуклеиновое основание они содержат. В ДНК присутствуют четыре основания: аденин (A), цитозин (C), гуанин (G) и тимин (T). Нуклеиновые кислоты обладают свойством, что две молекулы будут связываться друг с другом, образуя двойную спираль, только если две последовательности комплементарны , что означает, что они образуют соответствующие последовательности пар оснований, при этом A связывается только с T, а C — только с G. [5] [20] Поскольку образование правильно соответствующих пар оснований энергетически выгодно , ожидается, что нити нуклеиновой кислоты в большинстве случаев будут связываться друг с другом в конформации, которая максимизирует количество правильно спаренных оснований. Таким образом, последовательности оснований в системе нитей определяют схему связывания и общую структуру легко контролируемым образом. В ДНК-нанотехнологии последовательности оснований нитей рационально проектируются исследователями таким образом, чтобы взаимодействия пар оснований приводили к сборке нитей в желаемой конформации. [3] [5] Хотя ДНК является доминирующим используемым материалом, также были созданы структуры, включающие другие нуклеиновые кислоты, такие как РНК и пептидонуклеиновая кислота (ПНК). [21] [22]
Подполя
ДНК-нанотехнологию иногда делят на два пересекающихся подполя: структурная ДНК-нанотехнология и динамическая ДНК-нанотехнология. Структурная ДНК-нанотехнология, иногда сокращенно SDN, фокусируется на синтезе и характеристике комплексов нуклеиновых кислот и материалов, которые собираются в статическое, равновесное конечное состояние. С другой стороны, динамическая ДНК-нанотехнология фокусируется на комплексах с полезным неравновесным поведением, таким как способность перестраиваться на основе химического или физического стимула. Некоторые комплексы, такие как наномеханические устройства нуклеиновых кислот, сочетают в себе черты как структурных, так и динамических подполей. [23] [24]
Комплексы, построенные в структурной ДНК-нанотехнологии, используют топологически разветвленные структуры нуклеиновых кислот, содержащие соединения. (В отличие от этого, большая часть биологической ДНК существует в виде неразветвленной двойной спирали .) Одной из простейших разветвленных структур является четырехплечевое соединение, которое состоит из четырех отдельных цепей ДНК, части которых комплементарны в определенном шаблоне. В отличие от естественных соединений Холлидея , каждое плечо в искусственном неподвижном четырехплечевом соединении имеет различную последовательность оснований , в результате чего точка соединения фиксируется в определенном положении. Несколько соединений могут быть объединены в одном комплексе, например, в широко используемом структурном мотиве двойного кроссовера (DX) , который содержит два параллельных двойных спиральных домена с отдельными цепями, пересекающимися между доменами в двух точках кроссовера. Каждая точка кроссовера топологически является четырехплечевым соединением, но ограничено одной ориентацией, в отличие от гибкого одиночного четырехплечевого соединения, что обеспечивает жесткость, которая делает мотив DX подходящим в качестве структурного строительного блока для более крупных комплексов ДНК. [3] [5]
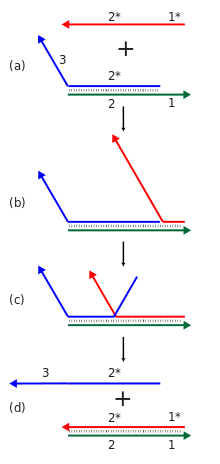
Динамическая ДНК-нанотехнология использует механизм, называемый смещением нити, опосредованным точкой опоры , чтобы позволить комплексам нуклеиновых кислот перестраиваться в ответ на добавление новой нити нуклеиновой кислоты. В этой реакции входящая нить связывается с одноцепочечной областью точки опоры двухцепочечного комплекса, а затем смещает одну из нитей, связанных в исходном комплексе, посредством процесса миграции ветвей . Общий эффект заключается в том, что одна из нитей в комплексе заменяется другой. [23] Кроме того, реконфигурируемые структуры и устройства могут быть созданы с использованием функциональных нуклеиновых кислот, таких как дезоксирибозимы и рибозимы , которые могут выполнять химические реакции, и аптамеры , которые могут связываться со специфическими белками или малыми молекулами. [25]
Структурная ДНК-нанотехнология
Структурная ДНК-нанотехнология, иногда сокращенно SDN, фокусируется на синтезе и характеристике комплексов нуклеиновых кислот и материалов, где сборка имеет статическую, равновесную конечную точку. Двойная спираль нуклеиновой кислоты имеет надежную, определенную трехмерную геометрию, которая позволяет моделировать, [26] предсказывать и проектировать структуры более сложных комплексов нуклеиновых кислот. Было создано много таких структур, включая двух- и трехмерные структуры, а также периодические, апериодические и дискретные структуры. [24]
Расширенные решетки

Небольшие комплексы нуклеиновых кислот могут быть снабжены липкими концами и объединены в более крупные двумерные периодические решетки, содержащие определенный мозаичный рисунок отдельных молекулярных плиток. [24] Самый ранний пример этого использовал комплексы двойного кроссинговера (DX) в качестве основных плиток, каждая из которых содержала четыре липких конца, разработанных с последовательностями, которые заставляли единицы DX объединяться в периодические двумерные плоские листы, которые по сути являются жесткими двумерными кристаллами ДНК. [30] [31] Двумерные массивы были сделаны также из других мотивов, включая ромбовидную решетку Холлидея [32] и различные массивы на основе DX, использующие схему двойной когезии. [33] [34] На двух верхних изображениях справа показаны примеры периодических решеток на основе плиток.
Двумерные массивы могут быть созданы для демонстрации апериодических структур, сборка которых реализует определенный алгоритм, демонстрируя одну из форм ДНК-вычислений. [17] Плитки DX могут иметь свои липкие конечные последовательности, выбранные так, чтобы они действовали как плитки Вана , что позволяет им выполнять вычисления. Был продемонстрирован массив DX, сборка которого кодирует операцию XOR ; это позволяет массиву ДНК реализовать клеточный автомат , который генерирует фрактал , известный как сальник Серпинского . Третье изображение справа показывает этот тип массива. [29] Другая система имеет функцию двоичного счетчика , отображая представление увеличивающихся двоичных чисел по мере его роста. Эти результаты показывают, что вычисления могут быть включены в сборку массивов ДНК. [35]
Массивы DX были созданы для формирования полых нанотрубок диаметром 4–20 нм , по сути двумерных решеток, которые изгибаются сами по себе. [36] Эти ДНК-нанотрубки по размеру и форме несколько похожи на углеродные нанотрубки , и хотя у них отсутствует электропроводность углеродных нанотрубок, ДНК-нанотрубки легче модифицировать и соединять с другими структурами. Одна из многих схем построения ДНК-нанотрубок использует решетку изогнутых плиток DX, которая закручивается вокруг себя и закрывается в трубку. [37] В альтернативном методе, который позволяет задавать окружность простым модульным способом с использованием одноцепочечных плиток, жесткость трубки является возникающим свойством . [38]
Формирование трехмерных решеток ДНК было самой ранней целью ДНК-нанотехнологии, но это оказалось одной из самых сложных для реализации. Успех с использованием мотива, основанного на концепции тенсегрити , баланса между силами растяжения и сжатия, был наконец зарегистрирован в 2009 году. [17] [39]
Дискретные структуры
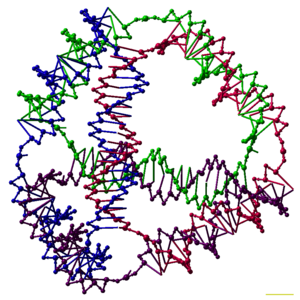
Исследователи синтезировали множество трехмерных комплексов ДНК, каждый из которых имеет связность многогранника , например, куба или октаэдра , что означает, что дуплексы ДНК отслеживают края многогранника с ДНК-соединением в каждой вершине. [6] Самые ранние демонстрации ДНК-многогранников были очень трудоемкими, требуя множественных лигирований и этапов твердофазного синтеза для создания катенированных многогранников. [40] Последующие работы дали многогранники, синтез которых был намного проще. К ним относятся ДНК-октаэдр, сделанный из длинной одиночной нити, предназначенной для складывания в правильную конформацию, [41] и тетраэдр, который можно получить из четырех нитей ДНК за один шаг, изображенный в верхней части этой статьи. [1]
Наноструктуры произвольных, нерегулярных форм обычно изготавливаются с использованием метода ДНК-оригами . Эти структуры состоят из длинной, естественной вирусной нити в качестве «леса», который складывается в желаемую форму с помощью вычислительно спроектированных коротких «скрепочных» нитей. Этот метод имеет преимущества в том, что его легко проектировать, так как последовательность оснований предопределена последовательностью нити леска, и он не требует высокой чистоты нити и точной стехиометрии , как большинство других методов ДНК-нанотехнологии. ДНК-оригами впервые было продемонстрировано для двумерных фигур, таких как смайлик , грубая карта Западного полушария и картина Моны Лизы. [6] [13] [42] Твердые трехмерные структуры могут быть созданы с использованием параллельных спиралей ДНК, расположенных в виде сот, [14] а структуры с двумерными гранями могут быть сложены в полую общую трехмерную форму, похожую на картонную коробку. Их можно запрограммировать на открытие и обнаружение или высвобождение молекулярного груза в ответ на стимул, что делает их потенциально полезными в качестве программируемых молекулярных клеток . [43] [44]
Шаблонная сборка
Структуры нуклеиновых кислот могут быть созданы для включения молекул, отличных от нуклеиновых кислот, иногда называемых гетероэлементами, включая белки, металлические наночастицы, квантовые точки , амины , [45] и фуллерены . Это позволяет создавать материалы и устройства с диапазоном функциональностей, намного большим, чем это возможно с одними нуклеиновыми кислотами. Цель состоит в том, чтобы использовать самосборку структур нуклеиновых кислот для шаблонизации сборки наночастиц, размещенных на них, контролируя их положение и в некоторых случаях ориентацию. [6] [46] Многие из этих схем используют схему ковалентного присоединения, используя олигонуклеотиды с амидными или тиольными функциональными группами в качестве химической ручки для связывания гетероэлементов. Эта схема ковалентного связывания использовалась для размещения золотых наночастиц на основе массива DX, [47] и для размещения молекул белка стрептавидина в определенных узорах на массиве DX. [48] Нековалентная схема размещения с использованием полиамидов Dervan на массиве DX была использована для размещения белков стрептавидина в определенном шаблоне на массиве DX. [49] Углеродные нанотрубки были размещены на массивах ДНК в шаблоне, позволяющем сборке действовать как молекулярное электронное устройство, полевой транзистор на основе углеродных нанотрубок . [50] Кроме того, существуют методы металлизации нуклеиновых кислот, в которых нуклеиновая кислота заменяется металлом, который принимает общую форму исходной структуры нуклеиновой кислоты, [51] и схемы использования наноструктур нуклеиновых кислот в качестве литографических масок, переносящих их шаблон на твердую поверхность. [52]
Динамическая ДНК-нанотехнология
Динамическая ДНК-нанотехнология фокусируется на формировании систем нуклеиновых кислот с разработанными динамическими функциями, связанными с их общими структурами, такими как вычисления и механическое движение. Существует некоторое совпадение между структурной и динамической ДНК-нанотехнологией, поскольку структуры могут быть сформированы посредством отжига, а затем динамически реконфигурированы или могут быть изначально сформированы динамически. [6] [10]
Наномеханические устройства
Были созданы комплексы ДНК, которые изменяют свою конформацию при некотором стимуле, что делает их одной из форм наноробототехники . Эти структуры изначально формируются таким же образом, как и статические структуры, созданные в структурной ДНК-нанотехнологии, но спроектированы таким образом, что динамическая реконфигурация возможна после первоначальной сборки. [23] [10] Самое раннее такое устройство использовало переход между формами B-ДНК и Z-ДНК для реагирования на изменение условий буфера путем совершения скручивающего движения. [53] Эта зависимость от условий буфера заставляла все устройства менять состояние одновременно. Последующие системы могли изменять состояние на основе наличия контрольных нитей, что позволяло нескольким устройствам независимо работать в растворе. Некоторые примеры таких систем - конструкция "молекулярного пинцета", которая имеет открытое и закрытое состояние, [54] устройство, которое может переключаться из конформации паранемического кроссовера (PX) в конформацию (JX2) с двумя непересекающимися сопоставлениями остова ДНК, совершая вращательное движение в процессе, [55] и двумерный массив, который может динамически расширяться и сжиматься в ответ на контрольные нити. [56] Также были созданы структуры, которые динамически открываются или закрываются, потенциально действуя как молекулярная клетка для высвобождения или раскрытия функционального груза при открытии. [43] [57] [58] В другом примере наноструктура ДНК-оригами была связана с РНК-полимеразой T7 и, таким образом, могла работать как двигатель, работающий на химической энергии, который может быть связан с пассивным последователем, который он затем приводит в движение. [59]
ДНК-ходоки — это класс наномашин нуклеиновых кислот, которые демонстрируют направленное движение по линейной дорожке. Было продемонстрировано большое количество схем. [10] Одна из стратегий заключается в управлении движением ходока по дорожке с помощью контрольных нитей, которые необходимо вручную добавлять в последовательности. [60] [61] Также возможно контролировать отдельные шаги ДНК-ходока путем облучения светом с разными длинами волн. [62] Другой подход заключается в использовании рестрикционных ферментов или дезоксирибозимов для расщепления нитей и приведения ходока в движение, что имеет преимущество автономного движения. [63] [64] Более поздняя система могла ходить по двумерной поверхности, а не по линейной дорожке, и продемонстрировала способность избирательно подбирать и перемещать молекулярный груз. [65] В 2018 году было показано, что связанная ДНК, которая использует транскрипцию катящегося кольца прикрепленной РНК-полимеразой T7, ходит по ДНК-пути, направляемая сгенерированной РНК-нитью. [66] Кроме того, был продемонстрирован линейный шагоход, который выполняет синтез на основе ДНК по мере продвижения шагохода по дорожке, что позволяет осуществлять автономный многоступенчатый химический синтез, направляемый шагоходом. [67] Функция синтетических шагоходов ДНК аналогична функции белков динеина и кинезина. [68]
Каскады смещения прядей
Каскады реакций смещения нитей могут использоваться как для вычислительных, так и для структурных целей. Отдельная реакция смещения нитей включает в себя обнаружение новой последовательности в ответ на присутствие некоторой инициирующей нити. Многие такие реакции могут быть связаны в каскад , где вновь обнаруженная выходная последовательность одной реакции может инициировать другую реакцию смещения нитей в другом месте. Это, в свою очередь, позволяет строить химические реакционные сети со многими компонентами, демонстрируя сложные вычислительные и информационные возможности обработки. Эти каскады делаются энергетически выгодными за счет образования новых пар оснований и прироста энтропии от реакций разборки. Каскады смещения нитей допускают изотермическую работу сборки или вычислительного процесса, в отличие от традиционного требования сборки нуклеиновых кислот для этапа термического отжига, где температура повышается, а затем медленно понижается, чтобы гарантировать правильное формирование желаемой структуры. Они также могут поддерживать каталитическую функцию видов инициатора, где менее одного эквивалента инициатора может привести к завершению реакции. [23] [69]
Комплексы смещения нитей могут быть использованы для создания молекулярных логических вентилей , способных выполнять сложные вычисления. [70] В отличие от традиционных электронных компьютеров, которые используют электрический ток в качестве входов и выходов, молекулярные компьютеры используют концентрации определенных химических видов в качестве сигналов. В случае цепей смещения нитей нуклеиновых кислот сигналом является наличие нитей нуклеиновых кислот, которые высвобождаются или потребляются посредством событий связывания и разъединения с другими нитями в комплексах смещения. Этот подход использовался для создания логических вентилей, таких как вентили И, ИЛИ и НЕ. [71] Совсем недавно была продемонстрирована четырехбитная схема, которая может вычислять квадратный корень целых чисел 0–15, используя систему вентилей, содержащую 130 нитей ДНК. [72]
Другое применение каскадов смещения нитей — создание динамически собранных структур. Они используют шпильковую структуру для реагентов, так что когда входная нить связывается, вновь выявленная последовательность находится на той же молекуле, а не разбирается. Это позволяет добавлять новые открытые шпильки к растущему комплексу. Этот подход использовался для создания простых структур, таких как трех- и четырехлучевые соединения и дендримеры . [69]
Приложения
ДНК-нанотехнология обеспечивает один из немногих способов формирования спроектированных сложных структур с точным контролем над наномасштабными характеристиками. Область начинает видеть применение для решения фундаментальных научных проблем в структурной биологии и биофизике . Самое раннее такое применение, предусмотренное для области, и одно все еще в разработке, - это кристаллография , где молекулы, которые трудно кристаллизовать в изоляции, могут быть расположены в трехмерной решетке нуклеиновой кислоты, что позволяет определять их структуру. Другое применение - использование стержней ДНК-оригами для замены жидких кристаллов в экспериментах по остаточному дипольному сопряжению в белковой ЯМР-спектроскопии ; использование ДНК-оригами выгодно, поскольку, в отличие от жидких кристаллов, они устойчивы к детергентам, необходимым для суспендирования мембранных белков в растворе. ДНК-ходоки использовались в качестве наномасштабных сборочных линий для перемещения наночастиц и прямого химического синтеза . Кроме того, структуры ДНК-оригами помогли в биофизических исследованиях функции ферментов и сворачивания белков . [24] [8]
ДНК-нанотехнология движется к потенциальным реальным приложениям. Способность массивов нуклеиновых кислот организовывать другие молекулы указывает на ее потенциальные применения в молекулярной электронике. Сборка структуры нуклеиновой кислоты может быть использована для шаблона сборки молекулярных электронных элементов, таких как молекулярные провода , предоставляя метод для нанометрового контроля размещения и общей архитектуры устройства, аналогичного молекулярному макету . [24] [6] ДНК-нанотехнологию сравнивают с концепцией программируемой материи из-за связи вычислений со свойствами ее материала. [73]
В исследовании, проведенном группой ученых из центров iNANO и CDNA в Университете Орхуса , исследователи смогли сконструировать небольшую многопереключаемую 3D ДНК-коробку-оригами. Предложенная наночастица была охарактеризована с помощью атомно-силовой микроскопии (АСМ), просвечивающей электронной микроскопии (ПЭМ) и резонансного переноса энергии Фёрстера (FRET). Было показано, что сконструированная коробка имеет уникальный механизм повторного закрытия, который позволяет ей многократно открываться и закрываться в ответ на уникальный набор ключей ДНК или РНК. Авторы предположили, что это «устройство ДНК может потенциально использоваться для широкого спектра приложений, таких как управление функцией отдельных молекул, контролируемая доставка лекарств и молекулярные вычисления». [74]
Существуют потенциальные приложения для ДНК-нанотехнологий в наномедицине, использующие ее способность выполнять вычисления в биосовместимом формате для создания «умных лекарств» для целевой доставки лекарств , а также для диагностических приложений. Одна из таких исследуемых систем использует полый ДНК-бокс, содержащий белки, которые вызывают апоптоз или гибель клеток, который открывается только при приближении к раковой клетке . [8] [75] Кроме того, был интерес к экспрессии этих искусственных структур в сконструированных живых бактериальных клетках, скорее всего, с использованием транскрибированной РНК для сборки, хотя неизвестно, способны ли эти сложные структуры эффективно складываться или собираться в цитоплазме клетки . В случае успеха это может обеспечить направленную эволюцию наноструктур нуклеиновых кислот. [6] Ученые из Оксфордского университета сообщили о самосборке четырех коротких нитей синтетической ДНК в клетку, которая может проникать в клетки и выживать в течение как минимум 48 часов. Было обнаружено, что тетраэдры ДНК с флуоресцентной меткой оставались нетронутыми в культивируемых в лаборатории клетках почек человека, несмотря на атаку клеточных ферментов через два дня. Этот эксперимент продемонстрировал потенциал доставки лекарств внутрь живых клеток с использованием «клетки» ДНК. [76] [77] Тетраэдр ДНК использовался для доставки РНК-интерференции (РНКi) в мышиной модели, сообщила группа исследователей из Массачусетского технологического института . Доставка интерферирующей РНК для лечения показала определенный успех с использованием полимера или липида , но существуют ограничения безопасности и неточное нацеливание, в дополнение к короткому сроку хранения в кровотоке. Наноструктура ДНК, созданная командой, состоит из шести нитей ДНК, образующих тетраэдр, с одной нитью РНК, прикрепленной к каждому из шести ребер. Тетраэдр дополнительно оснащен целевым белком, тремя молекулами фолиевой кислоты , которые направляют наночастицы ДНК к обильным рецепторам фолиевой кислоты, обнаруженным в некоторых опухолях. Результат показал, что экспрессия гена, на который нацелена РНК-интерференция, люцифераза , снизилась более чем наполовину. Это исследование показывает перспективность использования ДНК-нанотехнологии в качестве эффективного инструмента для доставки лечения с использованием новой технологии РНК-интерференции. [78] [79] Тетраэдр ДНК также использовался в попытке преодолеть явление множественной лекарственной устойчивости . Доксорубицин(DOX) был конъюгирован с тетраэдром и загружен в клетки рака молочной железы MCF-7, которые содержали насос для оттока препарата P-гликопротеина . Результаты эксперимента показали, что DOX не откачивался, и был достигнут апоптоз раковых клеток. Тетраэдр без DOX был загружен в клетки для проверки его биосовместимости, и структура не показала никакой цитотоксичности. [80] ДНК-тетраэдр также использовался в качестве штрих-кода для профилирования субклеточной экспрессии и распределения белков в клетках в диагностических целях. Тетраэдрально-наноструктурированный показал усиленный сигнал из-за более высокой эффективности и стабильности маркировки. [81]
Применение ДНК-нанотехнологий в наномедицине также сосредоточено на имитации структуры и функции природных мембранных белков с помощью разработанных ДНК-наноструктур. В 2012 году Лангекер и др. [82] представили структуру ДНК-оригами в форме пор, которая может самостоятельно встраиваться в липидные мембраны посредством гидрофобных модификаций холестерина и вызывать ионные токи через мембрану. За этой первой демонстрацией синтетического ионного канала ДНК последовало множество конструкций, индуцирующих поры , начиная от одиночного дуплекса ДНК [83] до небольших структур на основе плиток [84] [85] [86] [87] [88] и больших трансмембранных поринов ДНК-оригами [89] Подобно природным ионным каналам белков , этот ансамбль синтетических аналогов, созданных ДНК, тем самым охватывает несколько порядков величины проводимости. Изучение вставленного в мембрану одиночного дуплекса ДНК показало, что ток также должен протекать по интерфейсу ДНК-липид, поскольку в конструкции отсутствует просвет центрального канала, который позволяет ионам проходить через липидный бислой . Это указывает на то, что липидная пора, индуцированная ДНК, имеет тороидальную форму, а не цилиндрическую, поскольку липидные головные группы переориентируются в сторону вставленной в мембрану части ДНК. [83] Затем исследователи из Кембриджского университета и Иллинойсского университета в Урбане-Шампейне продемонстрировали, что такая тороидальная пора, индуцированная ДНК, может способствовать быстрому липидному флип-флопу между листками липидного бислоя. Используя этот эффект, они разработали синтетический фермент, построенный на основе ДНК , который переворачивает липиды в биологических мембранах на порядки быстрее, чем природные белки, называемые скрамблазами . [90] Эта разработка подчеркивает потенциал синтетических ДНК-наноструктур для персонализированных лекарств и терапевтических средств.
Дизайн
Наноструктуры ДНК должны быть рационально спроектированы так, чтобы отдельные нити нуклеиновых кислот собирались в желаемые структуры. Этот процесс обычно начинается с спецификации желаемой целевой структуры или функции. Затем определяется общая вторичная структура целевого комплекса, определяющая расположение нитей нуклеиновых кислот в структуре и то, какие части этих нитей должны быть связаны друг с другом. Последним шагом является проектирование первичной структуры , которое представляет собой спецификацию фактических последовательностей оснований каждой нити нуклеиновых кислот. [36] [91]
Структурное проектирование
Первым шагом в проектировании наноструктуры нуклеиновой кислоты является решение о том, как данная структура должна быть представлена определенным расположением нитей нуклеиновой кислоты. Этот шаг проектирования определяет вторичную структуру или положения пар оснований, которые удерживают отдельные нити вместе в желаемой форме. [36] Было продемонстрировано несколько подходов:
- Структуры на основе плиток. Этот подход разбивает целевую структуру на более мелкие единицы с сильной связью между нитями, содержащимися в каждой единице, и более слабыми взаимодействиями между единицами. Он часто используется для создания периодических решеток, но также может использоваться для реализации алгоритмической самосборки, делая их платформой для ДНК-вычислений . Это была доминирующая стратегия проектирования, использовавшаяся с середины 1990-х до середины 2000-х годов, когда была разработана методология ДНК-оригами. [36] [92]
- Складывающиеся структуры. Альтернатива подходу на основе плитки, складчатые подходы создают наноструктуру из одной длинной нити, которая может либо иметь разработанную последовательность, которая сворачивается из-за ее взаимодействия с собой, либо ее можно сложить в желаемую форму с помощью более коротких, «скрепочных» нитей. Этот последний метод называется ДНК-оригами , который позволяет формировать наномасштабные двух- и трехмерные формы (см. Дискретные структуры выше). [6] [13]
- Динамическая сборка. Этот подход напрямую контролирует кинетику самосборки ДНК, определяя все промежуточные этапы в механизме реакции в дополнение к конечному продукту. Это делается с использованием исходных материалов, которые принимают шпильковую структуру; затем они собираются в конечную конформацию в каскадной реакции в определенном порядке (см. каскады смещения нитей ниже). Этот подход имеет преимущество в том, что протекает изотермически , при постоянной температуре. Это отличается от термодинамических подходов, которые требуют этапа термического отжига , где изменение температуры требуется для запуска сборки и благоприятствования правильному формированию желаемой структуры. [6] [69]
Последовательный дизайн
После того, как любой из вышеперечисленных подходов использован для проектирования вторичной структуры целевого комплекса, должна быть разработана фактическая последовательность нуклеотидов, которая сформируется в желаемую структуру. Проектирование нуклеиновых кислот представляет собой процесс назначения определенной последовательности оснований нуклеиновых кислот каждой из составляющих цепей структуры, чтобы они ассоциировались в желаемую конформацию. Большинство методов имеют целью проектирование последовательностей таким образом, чтобы целевая структура имела самую низкую энергию и, таким образом, была наиболее термодинамически выгодной, в то время как неправильно собранные структуры имели более высокую энергию и, таким образом, были невыгодны. Это делается либо с помощью простых, быстрых эвристических методов, таких как минимизация симметрии последовательности, либо с помощью полной термодинамической модели ближайшего соседа , которая является более точной, но более медленной и более вычислительно интенсивной. Геометрические модели используются для изучения третичной структуры наноструктур и для обеспечения того, чтобы комплексы не были чрезмерно напряжены . [91] [93]
Дизайн нуклеиновых кислот имеет схожие цели с дизайном белков . В обоих случаях последовательность мономеров проектируется так, чтобы благоприятствовать желаемой целевой структуре и не благоприятствовать другим структурам. Дизайн нуклеиновых кислот имеет то преимущество, что он намного проще в вычислительном отношении, чем дизайн белков, поскольку простых правил спаривания оснований достаточно для прогнозирования энергетической благоприятности структуры, а подробная информация об общей трехмерной складке структуры не требуется. Это позволяет использовать простые эвристические методы, которые дают экспериментально надежные конструкции. Структуры нуклеиновых кислот менее универсальны, чем белки, в своей функции из-за повышенной способности белков складываться в сложные структуры и ограниченного химического разнообразия четырех нуклеотидов по сравнению с двадцатью протеиногенными аминокислотами . [93]
Материалы и методы
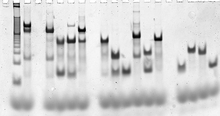
Последовательности цепей ДНК, составляющие целевую структуру, проектируются вычислительным путем с использованием программного обеспечения для молекулярного моделирования и термодинамического моделирования . [91] [93] Затем сами нуклеиновые кислоты синтезируются с использованием стандартных методов синтеза олигонуклеотидов , обычно автоматизированных в синтезаторе олигонуклеотидов , а цепи пользовательских последовательностей доступны в продаже. [94] При необходимости цепи можно очистить с помощью денатурирующего гель-электрофореза , [95] а точные концентрации определить с помощью любого из нескольких методов количественного определения нуклеиновых кислот с использованием ультрафиолетовой абсорбционной спектроскопии . [96]
Полностью сформированные целевые структуры можно проверить с помощью нативного гель-электрофореза, который дает информацию о размере и форме комплексов нуклеиновых кислот. Анализ сдвига электрофоретической подвижности может оценить, включает ли структура все желаемые нити. [97] Флуоресцентная маркировка и резонансный перенос энергии Фёрстера (FRET) иногда используются для характеристики структуры комплексов. [98]
Структуры нуклеиновых кислот могут быть напрямую визуализированы с помощью атомно-силовой микроскопии , которая хорошо подходит для расширенных двумерных структур, но менее полезна для дискретных трехмерных структур из-за взаимодействия кончика микроскопа с хрупкой структурой нуклеиновой кислоты; в этом случае часто используются просвечивающая электронная микроскопия и криоэлектронная микроскопия . Расширенные трехмерные решетки анализируются с помощью рентгеновской кристаллографии . [99] [100]
Смотрите также
- Международное общество нанотехнологий, вычислений и инжиниринга
- Сравнение программного обеспечения для моделирования нуклеиновых кислот
- Молекулярные модели ДНК
- Нанобиотехнология
Ссылки
- ^ ab ДНК-полиэдры: Goodman RP, Schaap IA, Tardin CF, Erben CM, Berry RM, Schmidt CF, Turberfield AJ (декабрь 2005 г.). «Быстрая хиральная сборка жестких строительных блоков ДНК для молекулярной нанофабрикации». Science . 310 (5754): 1661–1665. Bibcode :2005Sci...310.1661G. doi :10.1126/science.1120367. PMID 16339440. S2CID 13678773.
- ^ abc История: Pelesko JA (2007). Самосборка: наука о вещах, которые сами себя собирают . Нью-Йорк: Chapman & Hall/CRC. С. 201, 242, 259. ISBN 978-1-58488-687-7.
- ^ abcde Обзор: Seeman NC (июнь 2004 г.). «Нанотехнология и двойная спираль». Scientific American . 290 (6): 64–75. Bibcode : 2004SciAm.290f..64S. doi : 10.1038/scientificamerican0604-64. PMID 15195395.
- ^ История: См. «Текущий протокол кристаллизации». Лаборатория Надриана Симана.для постановки проблемы и «ДНК-клетки, содержащие ориентированных гостей». Лаборатория Надриана Симана.для предлагаемого решения.
- ^ abcde Обзор: Seeman NC (2010). «Наноматериалы на основе ДНК». Annual Review of Biochemistry . 79 : 65–87. doi :10.1146/annurev-biochem-060308-102244. PMC 3454582. PMID 20222824 .
- ^ abcdefghi Обзор: Pinheiro AV, Han D, Shih WM, Yan H (ноябрь 2011 г.). «Проблемы и возможности структурной ДНК-нанотехнологии». Nature Nanotechnology . 6 (12): 763–772. Bibcode :2011NatNa...6..763P. doi :10.1038/nnano.2011.187. PMC 3334823 . PMID 22056726.
- ^ ab DNA origami: Rothemund PW (2006). "Scaffolded DNA origami: from generalized multicrossovers to polygonal networks". В Chen J, Jonoska N, Rozenberg G (ред.). Nanotechnology: science and computing . Natural Computing Series. New York: Springer. стр. 3–21. CiteSeerX 10.1.1.144.1380 . doi :10.1007/3-540-30296-4_1. ISBN 978-3-540-30295-7.
- ^ abcde История/применение: Служба РФ (июнь 2011 г.). «ДНК-нанотехнология. ДНК-нанотехнология взрослеет». Science . 332 (6034): 1140–1, 1143. Bibcode :2011Sci...332.1140S. doi :10.1126/science.332.6034.1140. PMID 21636754.
- ^ Юрк, Бернард; Турберфилд, Эндрю Дж.; Миллс, Аллен П.; Зиммель, Фридрих К.; Нойманн, Дженнифер Л. (август 2000 г.). «Молекулярная машина, работающая на ДНК». Nature . 406 (6796): 605–608. Bibcode :2000Natur.406..605Y. doi :10.1038/35020524. ISSN 1476-4687. S2CID 2064216.
- ^ abcd ДНК-машины: Bath J, Turberfield AJ (май 2007 г.). «ДНК-наномашины». Nature Nanotechnology . 2 (5): 275–284. Bibcode : 2007NatNa...2..275B. doi : 10.1038/nnano.2007.104. PMID 18654284.
- ^ Наноархитектура: Robinson BH, Seeman NC (август 1987). «Проектирование биочипа: самоорганизующееся молекулярно-масштабное запоминающее устройство». Protein Engineering . 1 (4): 295–300. doi :10.1093/protein/1.4.295. PMID 3508280.
- ^ Наноархитектура: Xiao S, Liu F, Rosen AE, Hainfeld JF, Seeman NC, Musier-Forsyth K, Kiehl RA (август 2002 г.). «Самосборка массивов металлических наночастиц с помощью ДНК-скаффолдинга». Журнал исследований наночастиц . 4 (4): 313–317. Bibcode : 2002JNR.....4..313X. doi : 10.1023/A:1021145208328. S2CID 2257083.
- ^ abc DNA origami: Rothemund PW (март 2006). "Сворачивание ДНК для создания наноразмерных форм и узоров" (PDF) . Nature . 440 (7082): 297–302. Bibcode :2006Natur.440..297R. doi :10.1038/nature04586. PMID 16541064. S2CID 4316391.
- ^ ab DNA origami: Douglas SM, Dietz H, Liedl T, Högberg B, Graf F, Shih WM (май 2009). «Самосборка ДНК в наномасштабные трехмерные формы». Nature . 459 (7245): 414–418. Bibcode :2009Natur.459..414D. doi :10.1038/nature08016. PMC 2688462 . PMID 19458720.
- ↑ Служба РФ (июнь 2011 г.). «ДНК-нанотехнология. ДНК-нанотехнология взрослеет». Science . 332 (6034): 1140–1, 1143. Bibcode :2011Sci...332.1140S. doi :10.1126/science.332.6034.1140. PMID 21636754.
- ↑ История: Хопкин К (август 2011 г.). «Профиль: 3-D провидец». The Scientist . Архивировано из оригинала 10 октября 2011 г. Получено 8 августа 2011 г.
- ^ История abc : Seeman NC (июнь 2010 г.). «Структурная ДНК-нанотехнология: рост вместе с Nano Letters». Nano Letters . 10 (6): 1971–1978. Bibcode :2010NanoL..10.1971S. doi :10.1021/nl101262u. PMC 2901229 . PMID 20486672.
- ^ Обзор abc : Mao C (декабрь 2004 г.). «Возникновение сложности: уроки ДНК». PLOS Biology . 2 (12): e431. doi : 10.1371 /journal.pbio.0020431 . PMC 535573. PMID 15597116.
- ^ Предыстория: Pelesko JA (2007). Самосборка: наука о вещах, которые сами себя объединяют . Нью-Йорк: Chapman & Hall/CRC. С. 5, 7. ISBN 978-1-58488-687-7.
- ^ Предыстория: Long EC (1996). «Основы нуклеиновых кислот». В Hecht SM (ред.). Биоорганическая химия: нуклеиновые кислоты . Нью-Йорк: Oxford University Press. С. 4–10. ISBN 978-0-19-508467-2.
- ^ Нанотехнология РНК: Chworos A, Severcan I, Koyfman AY, Weinkam P, Oroudjev E, Hansma HG, Jaeger L (декабрь 2004 г.). «Создание программируемых головоломок с помощью РНК». Science . 306 (5704): 2068–2072. Bibcode :2004Sci...306.2068C. doi :10.1126/science.1104686. PMID 15604402. S2CID 9296608.
- ^ Нанотехнология РНК: Guo P (декабрь 2010 г.). «Развивающаяся область нанотехнологии РНК». Nature Nanotechnology . 5 (12): 833–842. Bibcode : 2010NatNa...5..833G. doi : 10.1038/nnano.2010.231. PMC 3149862. PMID 21102465 .
- ^ abcd Динамическая ДНК-нанотехнология: Zhang DY, Seelig G (февраль 2011 г.). «Динамическая ДНК-нанотехнология с использованием реакций смещения цепей». Nature Chemistry . 3 (2): 103–113. Bibcode :2011NatCh...3..103Z. doi :10.1038/nchem.957. PMID 21258382.
- ^ abcde Структурная ДНК-нанотехнология: Seeman NC (ноябрь 2007 г.). «Обзор структурной ДНК-нанотехнологии». Молекулярная биотехнология . 37 (3): 246–257. doi :10.1007/s12033-007-0059-4. PMC 3479651. PMID 17952671 .
- ^ Динамическая ДНК-нанотехнология: Lu Y, Liu J (декабрь 2006 г.). «Функциональная ДНК-нанотехнология: новые применения ДНКзимов и аптамеров». Current Opinion in Biotechnology . 17 (6): 580–588. doi :10.1016/j.copbio.2006.10.004. PMID 17056247.
- ^ Моделирование структур ДНК: Doye JP, Ouldridge TE, Louis AA, Romano F, Šulc P, Matek C и др. (декабрь 2013 г.). «Крупнозернистая ДНК для моделирования нанотехнологий ДНК». Physical Chemistry Chemical Physics . 15 (47): 20395–20414. arXiv : 1308.3843 . Bibcode :2013PCCP...1520395D. doi :10.1039/C3CP53545B. PMID 24121860. S2CID 15324396.
- ^ Другие массивы: Strong M (март 2004 г.). "Белковые наномашины". PLOS Biology . 2 (3): E73. doi : 10.1371 /journal.pbio.0020073 . PMC 368168. PMID 15024422.
- ^ Yan H, Park SH, Finkelstein G, Reif JH, LaBean TH (сентябрь 2003 г.). «ДНК-шаблонная самосборка белковых массивов и высокопроводящих нанопроводов». Science . 301 (5641): 1882–1884. Bibcode :2003Sci...301.1882Y. doi :10.1126/science.1089389. PMID 14512621. S2CID 137635908.
- ^ ab Алгоритмическая самосборка: Rothemund PW, Papadakis N, Winfree E (декабрь 2004 г.). "Алгоритмическая самосборка треугольников ДНК Серпинского". PLOS Biology . 2 (12): e424. doi : 10.1371/journal.pbio.0020424 . PMC 534809. PMID 15583715 .
- ^ Массивы DX: Winfree E, Liu F, Wenzler LA, Seeman NC (август 1998). «Проектирование и самосборка двумерных кристаллов ДНК». Nature . 394 (6693): 539–544. Bibcode :1998Natur.394..539W. doi :10.1038/28998. PMID 9707114. S2CID 4385579.
- ^ Массивы DX: Liu F, Sha R, Seeman NC (10 февраля 1999 г.). «Изменение поверхностных свойств двумерных кристаллов ДНК». Журнал Американского химического общества . 121 (5): 917–922. doi :10.1021/ja982824a.
- ↑ Другие массивы: Mao C, Sun W, Seeman NC (16 июня 1999 г.). «Спроектированные двумерные массивы ДНК Холлидея, визуализированные с помощью атомно-силовой микроскопии». Журнал Американского химического общества . 121 (23): 5437–5443. doi :10.1021/ja9900398.
- ^ Другие массивы: Constantinou PE, Wang T, Kopatsch J, Israel LB, Zhang X, Ding B и др. (сентябрь 2006 г.). «Двойная когезия в структурной ДНК-нанотехнологии». Органическая и биомолекулярная химия . 4 (18): 3414–3419. doi :10.1039/b605212f. PMC 3491902. PMID 17036134 .
- ↑ Другие массивы: Mathieu F, Liao S, Kopatsch J, Wang T, Mao C, Seeman NC (апрель 2005 г.). «Шестиспиральные пучки, созданные на основе ДНК». Nano Letters . 5 (4): 661–665. Bibcode :2005NanoL...5..661M. doi :10.1021/nl050084f. PMC 3464188 . PMID 15826105.
- ^ Алгоритмическая самосборка: Barish RD, Rothemund PW, Winfree E (декабрь 2005 г.). «Два вычислительных примитива для алгоритмической самосборки: копирование и подсчет». Nano Letters . 5 (12): 2586–2592. Bibcode :2005NanoL...5.2586B. CiteSeerX 10.1.1.155.676 . doi :10.1021/nl052038l. PMID 16351220.
- ^ abcd Design: Feldkamp U, Niemeyer CM (март 2006 г.). «Рациональный дизайн наноархитектур ДНК». Angewandte Chemie . 45 (12): 1856–1876. doi :10.1002/anie.200502358. PMID 16470892.
- ^ ДНК-нанотрубки: Rothemund PW, Ekani-Nkodo A, Papadakis N, Kumar A, Fygenson DK, Winfree E (декабрь 2004 г.). «Проектирование и характеристика программируемых ДНК-нанотрубок». Журнал Американского химического общества . 126 (50): 16344–16352. doi :10.1021/ja044319l. PMID 15600335.
- ^ Нанотрубки ДНК: Yin P, Hariadi RF, Sahu S, Choi HM, Park SH, Labean TH, Reif JH (август 2008 г.). «Программирование окружностей трубок ДНК». Science . 321 (5890): 824–826. Bibcode :2008Sci...321..824Y. doi :10.1126/science.1157312. PMID 18687961. S2CID 12100380.
- ^ Трехмерные массивы: Zheng J, Birktoft JJ, Chen Y, Wang T, Sha R, Constantinou PE и др. (сентябрь 2009 г.). «От молекулярного к макроскопическому через рациональный дизайн самоорганизующегося трехмерного кристалла ДНК». Nature . 461 (7260): 74–77. Bibcode :2009Natur.461...74Z. doi :10.1038/nature08274. PMC 2764300 . PMID 19727196.
- ^ Полиэдры ДНК: Zhang Y, Seeman NC (1 марта 1994 г.). «Построение ДНК-усеченного октаэдра». Журнал Американского химического общества . 116 (5): 1661–1669. doi :10.1021/ja00084a006.
- ^ Полиэдры ДНК: Shih WM, Quispe JD, Joyce GF (февраль 2004 г.). «Одноцепочечная ДНК размером 1,7 килобаз, которая сворачивается в наноразмерный октаэдр». Nature . 427 (6975): 618–621. Bibcode :2004Natur.427..618S. doi :10.1038/nature02307. PMID 14961116. S2CID 4419579.
- ^ Тихомиров Г., Петерсен П., Цянь Л. (декабрь 2017 г.). «Фрактальная сборка массивов ДНК-оригами микрометрового масштаба с произвольными узорами». Nature . 552 (7683): 67–71. Bibcode :2017Natur.552...67T. doi :10.1038/nature24655. PMID 29219965. S2CID 4455780.
- ^ ab DNA boxs: Andersen ES, Dong M, Nielsen MM, Jahn K, Subramani R, Mamdouh W и др. (май 2009 г.). «Самостоятельная сборка наноразмерного DNA box с управляемой крышкой». Nature . 459 (7243): 73–76. Bibcode :2009Natur.459...73A. doi :10.1038/nature07971. hdl : 11858/00-001M-0000-0010-9363-9 . PMID 19424153. S2CID 4430815.
- ^ ДНК-боксы: Ke Y, Sharma J, Liu M, Jahn K, Liu Y, Yan H (июнь 2009 г.). «Оригами ДНК-каркаса из молекулярного контейнера из тетраэдра ДНК». Nano Letters . 9 (6): 2445–2447. Bibcode : 2009NanoL...9.2445K. doi : 10.1021/nl901165f. PMID 19419184.
- ^ Заборова, ОВ; Войнова, АД; Шмыков, БД; Сергеев, ВГ (2021). «Твердые липидные наночастицы для инкапсуляции нуклеиновых кислот». Обзоры и достижения в химии . 11 (3–4): 178–188. doi :10.1134/S2079978021030055. ISSN 2634-8276. S2CID 246946068.
- ↑ Обзор: Endo M, Sugiyama H (октябрь 2009 г.). «Химические подходы к ДНК-нанотехнологии». ChemBioChem . 10 (15): 2420–2443. doi :10.1002/cbic.200900286. PMID 19714700. S2CID 205554125.
- ^ Наноархитектура: Zheng J, Constantinou PE, Micheel C, Alivisatos AP, Kiehl RA, Seeman NC (июль 2006 г.). «Двумерные массивы наночастиц демонстрируют организационную силу надежных мотивов ДНК». Nano Letters . 6 (7): 1502–1504. Bibcode :2006NanoL...6.1502Z. doi :10.1021/nl060994c. PMC 3465979 . PMID 16834438.
- ^ Наноархитектура: Park SH, Pistol C, Ahn SJ, Reif JH, Lebeck AR, Dwyer C, LaBean TH (январь 2006 г.). «Конечные по размеру, полностью адресуемые решетки ДНК-плиток, образованные иерархическими процедурами сборки». Angewandte Chemie . 45 (5): 735–739. Bibcode :2006AngCh.118.6759P. doi : 10.1002/ange.200690141 . PMID 16374784.
- ^ Наноархитектура: Cohen JD, Sadowski JP, Dervan PB (22 октября 2007 г.). «Addressing single Molecules on DNA nanostructures». Angewandte Chemie . 46 (42): 7956–7959. doi :10.1002/anie.200702767. PMID 17763481.
- ^ Наноархитектура: Maune HT, Han SP, Barish RD, Bockrath M, Goddard WA, Rothemund PW, Winfree E (январь 2010 г.). «Самосборка углеродных нанотрубок в двумерные геометрии с использованием шаблонов ДНК-оригами». Nature Nanotechnology . 5 (1): 61–66. Bibcode : 2010NatNa...5...61M. doi : 10.1038/nnano.2009.311. PMID 19898497.
- ^ Наноархитектура: Лю Дж., Гэн Ю., Паунд Э., Гьявали С., Эштон Дж.Р., Хики Дж. и др. (март 2011 г.). «Металлизация разветвленной ДНК-оригами для изготовления наноэлектронных схем». АСУ Нано . 5 (3): 2240–2247. дои : 10.1021/nn1035075. ПМИД 21323323.
- ^ Наноархитектура: Дэн З, Мао Ц (август 2004). «Молекулярная литография с ДНК-наноструктурами». Angewandte Chemie . 43 (31): 4068–4070. doi :10.1002/anie.200460257. PMID 15300697.
- ^ ДНК-машины: Mao C, Sun W, Shen Z, Seeman NC (январь 1999). «Наномеханическое устройство на основе BZ-перехода ДНК». Nature . 397 (6715): 144–146. Bibcode :1999Natur.397..144M. doi :10.1038/16437. PMID 9923675. S2CID 4406177.
- ^ ДНК-машины: Yurke B, Turberfield AJ, Mills AP, Simmel FC, Neumann JL (август 2000 г.). «Молекулярная машина, работающая на ДНК и сделанная из ДНК». Nature . 406 (6796): 605–608. Bibcode :2000Natur.406..605Y. doi :10.1038/35020524. PMID 10949296. S2CID 2064216.
- ^ ДНК-машины: Yan H, Zhang X, Shen Z, Seeman NC (январь 2002 г.). «Надежное механическое устройство ДНК, контролируемое гибридизационной топологией». Nature . 415 (6867): 62–65. Bibcode :2002Natur.415...62Y. doi :10.1038/415062a. PMID 11780115. S2CID 52801697.
- ^ ДНК-машины: Feng L, Park SH, Reif JH, Yan H (сентябрь 2003 г.). «Двухуровневая решетка ДНК, переключаемая наноактуатором ДНК». Angewandte Chemie . 42 (36): 4342–4346. Bibcode : 2003AngCh.115.4478F. doi : 10.1002/ange.200351818. PMID 14502706.
- ^ ДНК-машины: Goodman RP, Heilemann M, Doose S, Erben CM, Kapanidis AN, Turberfield AJ (февраль 2008 г.). «Реконфигурируемые, скрепленные, трехмерные ДНК-наноструктуры». Nature Nanotechnology . 3 (2): 93–96. Bibcode : 2008NatNa...3...93G. doi : 10.1038/nnano.2008.3. PMID 18654468.
- ^ Приложения: Douglas SM, Bachelet I, Church GM (февраль 2012 г.). «Логически управляемый наноробот для целевой транспортировки молекулярных грузов». Science . 335 (6070): 831–834. Bibcode :2012Sci...335..831D. doi :10.1126/science.1214081. PMID 22344439. S2CID 9866509.
- ^ Чентола, Матиас; Попплтон, Эрик; Рэй, Суджай; Чентола, Мартин; Велти, Робб; Валеро, Хулиан; Вальтер, Нильс Г.; Шульц, Петр; Фамулок, Майкл (2023-10-19). «Ритмично пульсирующий листовой пружинный ДНК-оригами нанодвигатель, который управляет пассивным последователем». Nature Nanotechnology : 1–11. doi : 10.1038/s41565-023-01516-x . ISSN 1748-3395. PMC 10873200 . PMID 37857824.
- ^ ДНК-ходоки: Шин Дж.С., Пирс Н.А. (сентябрь 2004 г.). «Синтетический ходок ДНК для молекулярного транспорта». Журнал Американского химического общества . 126 (35): 10834–10835. дои : 10.1021/ja047543j. ПМИД 15339155.
- ^ ДНК-ходки: Sherman WB, Seeman NC (июль 2004 г.). «Точно контролируемое ДНК-двуногое шагающее устройство». Nano Letters . 4 (7): 1203–1207. Bibcode : 2004NanoL...4.1203S. doi : 10.1021/nl049527q.
- ^ ДНК-ходоки: Шкугор М., Валеро Дж., Мураяма К., Центола М., Асанума Х., Фамулок М. (май 2019 г.). «Ортогонально фотоуправляемый неавтономный ДНК-ходок». Ангеванде Хеми . 58 (21): 6948–6951. дои : 10.1002/anie.201901272. PMID 30897257. S2CID 85446523.
- ^ DNA walkers: Tian Y, He Y, Chen Y, Yin P, Mao C (июль 2005 г.). «ДНКзим, который движется процессивно и автономно по одномерному пути». Angewandte Chemie . 44 (28): 4355–4358. Bibcode : 2005AngCh.117.4429T. doi : 10.1002/ange.200500703. PMID 15945114.
- ^ DNA walkers: Bath J, Green SJ, Turberfield AJ (июль 2005 г.). «Свободно работающий ДНК-мотор, работающий на ферменте никеля». Angewandte Chemie . 44 (28): 4358–4361. doi :10.1002/anie.200501262. PMID 15959864.
- ^ Функциональные ДНК-ходоки: Lund K, Manzo AJ, Dabby N, Michelotti N, Johnson-Buck A, Nangreave J, et al. (май 2010 г.). «Молекулярные роботы, направляемые предписывающими ландшафтами». Nature . 465 (7295): 206–210. Bibcode :2010Natur.465..206L. doi :10.1038/nature09012. PMC 2907518 . PMID 20463735.
- ^ Функциональные ДНК-ходоки: Valero J, Pal N, Dhakal S, Walter NG, Famulok M (июнь 2018 г.). «Биогибридный ДНК-ротор-статорный нанодвигатель, движущийся по предопределенным траекториям». Nature Nanotechnology . 13 (6): 496–503. Bibcode :2018NatNa..13..496V. doi :10.1038/s41565-018-0109-z. PMC 5994166 . PMID 29632399.
- ^ Функциональные ДНК-ходки: He Y, Liu DR (ноябрь 2010 г.). «Автономный многошаговый органический синтез в одном изотермическом растворе, опосредованный ДНК-ходком». Nature Nanotechnology . 5 (11): 778–782. Bibcode :2010NatNa...5..778H. doi :10.1038/nnano.2010.190. PMC 2974042 . PMID 20935654.
- ^ Pan J, Li F, Cha TG, Chen H, Choi JH (август 2015 г.). «Последний прогресс в области ДНК-ориентированных шагающих роботов». Current Opinion in Biotechnology . 34 : 56–64. doi : 10.1016/j.copbio.2014.11.017. PMID 25498478.
- ^ abc Кинетическая сборка: Yin P, Choi HM, Calvert CR, Pierce NA (январь 2008 г.). «Программирование путей биомолекулярной самосборки». Nature . 451 (7176): 318–322. Bibcode :2008Natur.451..318Y. doi :10.1038/nature06451. PMID 18202654. S2CID 4354536.
- ^ Нечеткие и булевы логические вентили на основе ДНК: Zadegan RM, Jepsen MD, Hildebrandt LL, Birkedal V, Kjems J (апрель 2015 г.). «Построение нечетких и булевых логических вентилей на основе ДНК». Small . 11 (15): 1811–1817. doi :10.1002/smll.201402755. PMID 25565140.
- ^ Каскады смещения нитей: Seelig G, Soloveichik D, Zhang DY, Winfree E (декабрь 2006 г.). «Безферментные логические схемы нуклеиновых кислот». Science . 314 (5805): 1585–1588. Bibcode :2006Sci...314.1585S. doi :10.1126/science.1132493. PMID 17158324. S2CID 10966324.
- ^ Каскадные смещения нитей: Qian L, Winfree E (июнь 2011 г.). «Масштабирование вычислений цифровых схем с каскадными смещениями нитей ДНК». Science . 332 (6034): 1196–1201. Bibcode :2011Sci...332.1196Q. doi :10.1126/science.1200520. PMID 21636773. S2CID 10053541.
- ^ Приложения: Rietman EA (2001). Молекулярная инженерия наносистем. Springer. С. 209–212. ISBN 978-0-387-98988-4. Получено 17 апреля 2011 г.
- ^ Задеган Р.М., Джепсен М.Д., Томсен К.Е., Охольм А.Х., Шафферт Д.Х., Андерсен Э.С. и др. (ноябрь 2012 г.). «Создание переключаемого 3D-ящика ДНК-оригами емкостью 4 зептолитра». АСУ Нано . 6 (11): 10050–10053. дои : 10.1021/nn303767b. ПМИД 23030709.
- ^ Приложения: Jungmann R, Renner S, Simmel FC (апрель 2008 г.). «От ДНК-нанотехнологии к синтетической биологии». Журнал HFSP . 2 (2): 99–109. doi :10.2976/1.2896331. PMC 2645571. PMID 19404476 .
- ^ Лови, Говард (5 июля 2011 г.). «ДНК-клетки могут высвобождать лекарства внутри клеток». violentdrugdelivery.com . Получено 22 сентября 2013 г.[ постоянная мертвая ссылка ]
- ^ Уолш AS, Инь H, Эрбен CM, Вуд MJ, Турберфилд AJ (июль 2011 г.). «Доставка ДНК-клеток в клетки млекопитающих». ACS Nano . 5 (7): 5427–5432. doi :10.1021/nn2005574. PMID 21696187.
- ^ Трафтон, Энн (4 июня 2012 г.). «Исследователи достигли РНК-интерференции в более легкой упаковке». MIT News . Получено 22 сентября 2013 г.
- ^ Lee H, Lytton-Jean AK, Chen Y, Love KT, Park AI, Karagiannis ED и др. (июнь 2012 г.). «Молекулярно самоорганизующиеся наночастицы нуклеиновых кислот для целенаправленной доставки siRNA in vivo». Nature Nanotechnology . 7 (6): 389–393. Bibcode :2012NatNa...7..389L. doi :10.1038/NNANO.2012.73. PMC 3898745 . PMID 22659608.
- ^ Ким КР, Ким ДР, Ли Т, Йи ДЖИ, Ким БС, Квон ИЦ, Ан ДР (март 2013 г.). «Доставка лекарств с помощью самоорганизующегося ДНК-тетраэдра для преодоления лекарственной устойчивости в клетках рака груди». Chemical Communications . 49 (20): 2010–2012. doi :10.1039/c3cc38693g. PMID 23380739.
- ^ Sundah NR, Ho NR, Lim GS, Natalia A, Ding X, Liu Y и др. (сентябрь 2019 г.). «Наноструктуры ДНК со штрих-кодом для мультиплексного профилирования субклеточного распределения белков». Nature Biomedical Engineering . 3 (9): 684–694. doi :10.1038/s41551-019-0417-0. PMID 31285580. S2CID 195825879.
- ^ Ионные каналы ДНК: Langecker M, Arnaut V, Martin TG, List J, Renner S, Mayer M и др. (ноябрь 2012 г.). «Синтетические липидные мембранные каналы, образованные спроектированными наноструктурами ДНК». Science . 338 (6109): 932–936. Bibcode :2012Sci...338..932L. doi :10.1126/science.1225624. PMC 3716461 . PMID 23161995.
- ^ ab ДНК ионные каналы: Göpfrich K, Li CY, Mames I, Bhamidimarri SP, Ricci M, Yoo J, et al. (Июль 2016 г.). «Ионные каналы, созданные из одного ДНК-дуплекса, охватывающего мембрану». Nano Letters . 16 (7): 4665–4669. Bibcode :2016NanoL..16.4665G. doi :10.1021/acs.nanolett.6b02039. PMC 4948918 . PMID 27324157.
- ^ Ионные каналы ДНК: Burns JR, Stulz E, Howorka S (июнь 2013 г.). «Самоорганизующиеся нанопоры ДНК, охватывающие липидные бислои». Nano Letters . 13 (6): 2351–2356. Bibcode :2013NanoL..13.2351B. CiteSeerX 10.1.1.659.7660 . doi :10.1021/nl304147f. PMID 23611515.
- ^ Ионные каналы ДНК: Burns JR, Göpfrich K, Wood JW, Thacker VV, Stulz E, Keyser UF, Howorka S (ноябрь 2013 г.). «Нанопоры ДНК, охватывающие липидный бислой, с бифункциональным порфириновым якорем». Angewandte Chemie . 52 (46): 12069–12072. doi :10.1002/anie.201305765. PMC 4016739 . PMID 24014236.
- ^ Ионные каналы ДНК: Seifert A, Göpfrich K, Burns JR, Fertig N, Keyser UF, Howorka S (февраль 2015 г.). «Нанопоры ДНК, охватывающие два слоя, с переключением напряжения между открытым и закрытым состоянием». ACS Nano . 9 (2): 1117–1126. doi :10.1021/nn5039433. PMC 4508203 . PMID 25338165.
- ^ Ионные каналы ДНК: Göpfrich K, Zettl T, Meijering AE, Hernández-Ainsa S, Kocabey S, Liedl T, Keyser UF (май 2015 г.). «Структуры ДНК-плиток индуцируют ионные токи через липидные мембраны». Nano Letters . 15 (5): 3134–3138. Bibcode :2015NanoL..15.3134G. doi :10.1021/acs.nanolett.5b00189. PMID 25816075.
- ^ Ионные каналы ДНК: Burns JR, Seifert A, Fertig N, Howorka S (февраль 2016 г.). «Биомиметический канал на основе ДНК для лиганд-контролируемого транспорта заряженных молекулярных грузов через биологическую мембрану». Nature Nanotechnology . 11 (2): 152–156. Bibcode :2016NatNa..11..152B. doi :10.1038/nnano.2015.279. PMID 26751170.
- ^ Ионные каналы ДНК: Гёпфрих К., Ли CY, Риччи М., Бхамидимарри С.П., Ю Дж., Гинес Б. и др. (сентябрь 2016 г.). «Трансмембранный порин с большой проводимостью, сделанный из ДНК-оригами». АСУ Нано . 10 (9): 8207–8214. doi : 10.1021/acsnano.6b03759. ПМК 5043419 . ПМИД 27504755.
- ^ ДНК-скрамблаза: Ohmann A, Li CY, Maffeo C, Al Nahas K, Baumann KN, Göpfrich K и др. (июнь 2018 г.). «Синтетический фермент, созданный из ДНК, переворачивает 107 липидов в секунду в биологических мембранах». Nature Communications . 9 (1): 2426. Bibcode :2018NatCo...9.2426O. doi :10.1038/s41467-018-04821-5. PMC 6013447 . PMID 29930243.
- ^ abc Design: Brenneman A, Condon A (25 сентября 2002 г.). «Конструкция цепей для биомолекулярных вычислений». Теоретическая информатика . 287 : 39–58. doi : 10.1016/S0304-3975(02)00135-4 .
- ^ Обзор: Lin C, Liu Y, Rinker S, Yan H (август 2006 г.). «Самосборка на основе ДНК-плиток: построение сложных наноархитектур». ChemPhysChem . 7 (8): 1641–1647. doi :10.1002/cphc.200600260. PMID 16832805.
- ^ abc Design: Dirks RM, Lin M, Winfree E, Pierce NA (15 февраля 2004 г.). «Парадигмы для вычислительного проектирования нуклеиновых кислот». Nucleic Acids Research . 32 (4): 1392–1403. doi :10.1093/nar/gkh291. PMC 390280. PMID 14990744 .
- ^ Методы: Эллингтон А., Поллард Дж. Д. (1 мая 2001 г.). «Синтез и очистка олигонуклеотидов». Current Protocols in Molecular Biology . 42 : 2.11.1–2.11.25. doi : 10.1002/0471142727.mb0211s42. ISBN 978-0471142720. PMID 18265179. S2CID 205152989.
- ^ Методы: Эллингтон А., Поллард Дж. Д. (1 мая 2001 г.). «Очистка олигонуклеотидов с использованием денатурирующего электрофореза в полиакриламидном геле». Current Protocols in Molecular Biology . 42 : Unit2.12. doi :10.1002/0471142727.mb0212s42. ISBN 978-0471142720. PMID 18265180. S2CID 27187583.
- ^ Методы: Gallagher SR, Desjardins P (1 июля 2011 г.). "Количественное определение нуклеиновых кислот и белков". Current Protocols Essential Laboratory Techniques . Том 5. doi :10.1002/9780470089941.et0202s5. ISBN 978-0470089934. S2CID 94329398.
- ^ Методы: Chory J, Pollard JD (1 мая 2001 г.). "Разделение малых фрагментов ДНК с помощью обычного гель-электрофореза". Current Protocols in Molecular Biology . 47 : Unit2.7. doi :10.1002/0471142727.mb0207s47. ISBN 978-0471142720. PMID 18265187. S2CID 43406338.
- ^ Методы: Walter NG (1 февраля 2003 г.). "Исследование структурной динамики и функции РНК с помощью флуоресцентного резонансного переноса энергии (FRET)". Current Protocols in Nucleic Acid Chemistry . 11 : 11.10.1–11.10.23. doi :10.1002/0471142700.nc1110s11. ISBN 978-0471142706. PMID 18428904. S2CID 9978415.
- ^ Методы: Lin C, Ke Y, Chhabra R, Sharma J, Liu Y, Yan H (2011). «Синтез и характеристика самоорганизующихся ДНК-наноструктур». В Zuccheri G, Samorì B (ред.). DNA Nanotechnology . Методы в молекулярной биологии. Т. 749. С. 1–11. doi :10.1007/978-1-61779-142-0_1. ISBN 978-1-61779-141-3. PMID 21674361.
- ^ Методы: Bloomfield VA, Crothers DM, Tinoco Jr I (2000). Нуклеиновые кислоты: структуры, свойства и функции . Sausalito, Calif: University Science Books. стр. 84–86, 396–407. ISBN 978-0-935702-49-1.
Дальнейшее чтение
Общий:
- Seeman NC (июнь 2004 г.). «Нанотехнология и двойная спираль». Scientific American . 290 (6): 64–75. Bibcode : 2004SciAm.290f..64S. doi : 10.1038/scientificamerican0604-64. PMID 15195395.—Статья, написанная для неспециалистов основателем этой области
- Seeman NC (июнь 2010 г.). «Структурная ДНК-нанотехнология: рост вместе с Nano Letters». Nano Letters . 10 (6): 1971–1978. Bibcode :2010NanoL..10.1971S. doi :10.1021/nl101262u. PMC 2901229 . PMID 20486672.—Обзор результатов за период 2001–2010 гг.
- Seeman NC (2010). «Наноматериалы на основе ДНК». Annual Review of Biochemistry . 79 : 65–87. doi :10.1146/annurev-biochem-060308-102244. PMC 3454582. PMID 20222824 .—Более полный обзор, включающий как старые, так и новые результаты в этой области
- Служба РФ (июнь 2011 г.). «ДНК-нанотехнология. ДНК-нанотехнология взрослеет». Наука . 332 (6034): 1140–1, 1143. Bibcode : 2011Sci...332.1140S. doi : 10.1126/science.332.6034.1140. PMID 21636754.и Служба РФ (июнь 2011 г.). «ДНК-нанотехнология. Следующий шаг: ДНК-роботы?». Наука . 332 (6034): 1142. doi :10.1126/science.332.6034.1142. PMID 21636755..—Новостная статья, посвященная истории области и разработке новых приложений.
- Zadegan RM, Norton ML (июнь 2012 г.). «Структурная ДНК-нанотехнология: от проектирования до применения». International Journal of Molecular Sciences . 13 (6): 7149–7162. doi : 10.3390/ijms13067149 . PMC 3397516. PMID 22837684 .—Совсем недавний и всеобъемлющий обзор в этой области
Конкретные подполя:
- Bath J, Turberfield AJ (май 2007 г.). «ДНК-наномашины». Nature Nanotechnology . 2 (5): 275–284. Bibcode : 2007NatNa...2..275B. doi : 10.1038/nnano.2007.104. PMID 18654284.—Обзор наномеханических устройств на основе нуклеиновых кислот
- Feldkamp U, Niemeyer CM (март 2006 г.). «Рациональный дизайн наноархитектур ДНК». Angewandte Chemie . 45 (12): 1856–1876. doi :10.1002/anie.200502358. PMID 16470892.—Обзор с точки зрения проектирования вторичной структуры
- Lin C, Liu Y, Rinker S, Yan H (август 2006 г.). «Самосборка на основе ДНК-плиток: построение сложных наноархитектур». ChemPhysChem . 7 (8): 1641–1647. doi :10.1002/cphc.200600260. PMID 16832805.— Мини-обзор, специально посвященный сборке на основе плитки
- Zhang DY, Seelig G (февраль 2011 г.). «Динамическая ДНК-нанотехнология с использованием реакций смещения цепей». Nature Chemistry . 3 (2): 103–113. Bibcode :2011NatCh...3..103Z. doi :10.1038/nchem.957. PMID 21258382.—Обзор систем ДНК, использующих механизмы смещения цепей
Внешние ссылки
- Что такое бионанотехнология? — видео-введение в ДНК-нанотехнологию


