Хеликобактер пилори
| Хеликобактер пилори | |
|---|---|
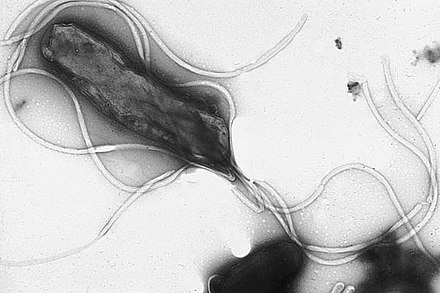 | |
| Электронная микрофотография H. pylori , обладающей множественными жгутиками ( негативное окрашивание ) | |
| Научная классификация | |
| Домен: | Бактерии |
| Тип: | Кампилобактеро́та |
| Сорт: | «Кампилобактерии» |
| Заказ: | Кампилобактерии |
| Семья: | Helicobacteraceae |
| Род: | Хеликобактер |
| Разновидность: | H. pylori |
| Биномиальное имя | |
| Хеликобактер пилори (Маршалл и др., 1985) Гудвин и др. , 1989 | |
| Синонимы | |
| |
Helicobacter pylori , ранее известная как Campylobacter pylori , является грамотрицательной , жгутиковой , спиральной бактерией . Мутанты могут иметь форму палочки или изогнутой палочки, которая проявляет меньшую вирулентность . [1] [2] Считается, что ее спиральное тело (от которогоназвание рода Helicobacter ) эволюционировало, чтобы проникать в слизистую оболочку желудкас помощью ее жгутиков и тем самым вызывать инфекцию. [3] [2] Бактерия была впервые идентифицирована как возбудитель язвы желудка в 1983 году австралийскими врачами-учеными Барри Маршаллом и Робином Уорреном . [4] [5] В 2005 году они были удостоены Нобелевской премии по физиологии и медицине за свое открытие. [6]
Инфицирование желудка H. pylori не обязательно вызывает заболевание: инфицировано более половины населения мира, но у большинства людей симптомы отсутствуют. [7] [8] Постоянная колонизация более вирулентными штаммами может вызвать ряд желудочных и нежелудочных расстройств. [9] Желудочные расстройства, вызванные инфекцией, начинаются с гастрита или воспаления слизистой оболочки желудка. [10] Когда инфекция сохраняется, длительное воспаление переходит в хронический гастрит . Первоначально это будет неатрофический гастрит, но повреждение, нанесенное слизистой оболочке желудка, может привести к развитию атрофического гастрита и язв в самом желудке или двенадцатиперстной кишке (ближайшей части кишечника). [10] На этой стадии риск развития рака желудка высок. [11] Однако развитие язвы двенадцатиперстной кишки сопряжено с сравнительно более низким риском развития рака. [12] Helicobacter pylori — это канцерогенные бактерии класса 1 , а потенциальные виды рака включают лимфому желудка MALT и рак желудка . [10] [11] Инфекция H. pylori является причиной примерно 89% всех случаев рака желудка и связана с развитием 5,5% всех случаев рака во всем мире. [13] [14] H. pylori — единственная известная бактерия, вызывающая рак. [15]
Экстрагастральные осложнения, которые связаны с H. pylori , включают анемию, вызванную дефицитом железа или витамина B12 , сахарный диабет , сердечно-сосудистые заболевания и некоторые неврологические расстройства. [16] Также была заявлена обратная связь с H. pylori , имеющим положительный защитный эффект против астмы , рака пищевода , воспалительных заболеваний кишечника (включая гастроэзофагеальную рефлюксную болезнь и болезнь Крона ) и других. [16]
Некоторые исследования показывают, что H. pylori играет важную роль в естественной экологии желудка, влияя на тип бактерий, которые колонизируют желудочно-кишечный тракт. [17] [18] Другие исследования показывают, что непатогенные штаммы H. pylori могут благотворно нормализовать секрецию желудочной кислоты и регулировать аппетит. [19]
По оценкам, в 2023 году около двух третей населения мира были инфицированы H. pylori , причем эта инфекция чаще встречается в развивающихся странах . [20] Распространенность снизилась во многих странах благодаря эрадикационной терапии антибиотиками и ингибиторами протонной помпы , а также повышению уровня жизни . [21] [22]
Микробиология
Helicobacter pylori — это вид грамотрицательных бактерий рода Helicobacter . [23] Около половины населения мира инфицировано H. pylori , но только несколько штаммов являются патогенными . H. pylori — это спиральная бактерия , имеющая преимущественно спиральную форму , также часто описываемую как имеющую спиральную или S- образную форму. [24] [25] Ее спиральная форма лучше подходит для продвижения через вязкую слизистую оболочку желудка и поддерживается рядом ферментов в пептидогликане клеточной стенки . [1] Бактерии достигают менее кислой слизистой оболочки с помощью своих жгутиков . [26] Три изученных штамма показали изменение длины от 2,8 до 3,3 мкм, но довольно постоянный диаметр 0,55–0,58 мкм. [24] H. pylori может трансформироваться из спиральной в неактивную кокковидную форму, которая может ускользать от иммунной системы и которая, возможно, может стать жизнеспособной, известной как жизнеспособная, но некультивируемая (VBNC). [27] [28]
Helicobacter pylori является микроаэрофильным – то есть, ему требуется кислород , но в более низкой концентрации, чем в атмосфере . Он содержит гидрогеназу , которая может вырабатывать энергию путем окисления молекулярного водорода (H2 ) , вырабатываемого кишечными бактериями . [29]
H. pylori можно обнаружить в тканях с помощью окраски по Граму , окраски по Гимзе , окраски гематоксилином и эозином , окраски серебром Уортина-Старри , окраски акридиновым оранжевым и фазово-контрастной микроскопии . Он способен образовывать биопленки . Биопленки помогают препятствовать действию антибиотиков и могут способствовать неэффективности лечения. [30] [31]
Для успешной колонизации хозяина H. pylori использует множество различных факторов вирулентности , включая оксидазу , каталазу и уреазу . [32] Уреаза является наиболее распространенным белком, ее экспрессия составляет около 10% от общей массы белка. [33]
H. pylori обладает пятью основными семействами белков внешней мембраны . [32] Самое большое семейство включает известные и предполагаемые адгезины . Другие четыре семейства — это порины , транспортеры железа, белки, ассоциированные со жгутиками , и белки неизвестной функции. Как и у других типичных грамотрицательных бактерий, внешняя мембрана H. pylori состоит из фосфолипидов и липополисахарида (ЛПС). О-антиген ЛПС может быть фукозилирован и имитировать антигены группы крови Льюиса, обнаруженные на желудочном эпителии. [32]
Геном
Helicobacter pylori состоит из большого разнообразия штаммов, и сотни геномов были полностью секвенированы . [34] [35] [36] Геном штамма 26695 состоит из около 1,7 миллионов пар оснований , с примерно 1576 генами. [37] [38] Пангеном , то есть объединенный набор из 30 секвенированных штаммов, кодирует 2239 семейств белков ( ортологичные группы OG). [39] Среди них 1248 OG сохраняются во всех 30 штаммах и представляют собой универсальное ядро . Остальные 991 OG соответствуют вспомогательному геному , в котором 277 OG являются уникальными для одного штамма. [40]
В геноме H. pylori имеется одиннадцать систем рестрикции и модификации . [38] Это необычно большое число, обеспечивающее защиту от бактериофагов . [38]
Транскриптом
Транскриптомика отдельных клеток с использованием РНК-секвенирования отдельных клеток дала полный транскриптом H. pylori , который был опубликован в 2010 году. Этот анализ его транскрипции подтвердил известную кислотную индукцию основных локусов вирулентности , включая оперон уреазы (ure) и остров патогенности Cag (PAI). [41] Всего было идентифицировано 1907 сайтов начала транскрипции, 337 первичных оперонов , 126 дополнительных подоперонов и 66 моноцистронов . До 2010 года у этого вида было известно только около 55 сайтов начала транскрипции (TSS). 27% первичных TSS также являются антисмысловыми TSS, что указывает на то, что, подобно E. coli , антисмысловая транскрипция происходит по всему геному H. pylori . По крайней мере один антисмысловой TSS связан примерно с 46% всех открытых рамок считывания , включая многие гены домашнего хозяйства . [41] Около 50% 5' - нетранслируемых последовательностей (лидерных последовательностей) имеют длину 20–40 нуклеотидов (нт) и поддерживают мотив AAGGag, расположенный примерно на 6 нт (срединное расстояние) выше стартовых кодонов, как консенсусную последовательность Шайна–Дальгарно в H. pylori . [41]
Протеом
Протеом H. pylori был систематически проанализирован, и более 70% его белков были обнаружены с помощью масс-спектрометрии и других методов. Около 50% протеома было количественно определено, что дает информацию о количестве копий белка в типичной клетке. [42]
Исследования интерактома выявили более 3000 взаимодействий белок-белок . Это дало информацию о том, как белки взаимодействуют друг с другом, либо в стабильных белковых комплексах , либо в более динамичных, временных взаимодействиях, что может помочь определить функции белка. Это, в свою очередь , помогает исследователям выяснить, какова функция нехарактеризованных белков, например, когда нехарактеризованный белок взаимодействует с несколькими белками рибосомы ( то есть, он, вероятно, также участвует в функции рибосомы). Около трети из всех ~1500 белков в H. pylori остаются нехарактеризованными, и их функция в значительной степени неизвестна. [43]
Инфекция

Инфекция Helicobacter pylori может либо не иметь симптомов, даже если длится всю жизнь, либо может повредить желудок и двенадцатиперстную кишку воспалительными реакциями , вызванными несколькими механизмами, связанными с рядом факторов вирулентности . Колонизация может изначально вызвать гастрит, вызванный H. pylori , воспаление слизистой оболочки желудка , которое стало перечисленным заболеванием в МКБ-11 . [44] [45] [46] Это будет прогрессировать до хронического гастрита, если его не лечить. Хронический гастрит может привести к атрофии слизистой оболочки желудка и развитию пептических язв (желудка или двенадцатиперстной кишки). Эти изменения можно рассматривать как этапы в развитии рака желудка , известного как каскад Корреа . [47] [48] Внежелудочные осложнения, которые были связаны с H. pylori , включают анемию, вызванную либо дефицитом железа, либо дефицитом витамина B12, сахарный диабет, сердечно-сосудистые и некоторые неврологические расстройства. [16]
Пептические язвы являются следствием воспаления, которое позволяет желудочной кислоте и пищеварительному ферменту пепсину подавлять защитные механизмы слизистых оболочек . Место колонизации H. pylori , которое влияет на место язвы, зависит от кислотности желудка. [49] У людей, вырабатывающих большое количество кислоты, H. pylori колонизирует вблизи пилорического отдела (выход в двенадцатиперстную кишку), чтобы избежать кислотопродуцирующих париетальных клеток на дне (около входа в желудок). [32] G-клетки экспрессируют относительно высокие уровни PD-L1 , который защищает эти клетки от иммунного разрушения, вызванного H. pylori . [50] У людей, вырабатывающих нормальное или сниженное количество кислоты, H. pylori также может колонизировать остальную часть желудка.

Воспалительная реакция, вызванная бактериями, колонизирующими около пилорического отдела желудка, побуждает G-клетки в антральном отделе желудка секретировать гормон гастрин , который через кровоток попадает в париетальные клетки дна желудка. [51] Гастрин стимулирует париетальные клетки к секреции большего количества кислоты в просвет желудка и со временем также увеличивает количество париетальных клеток. [52] Повышенная кислотная нагрузка повреждает двенадцатиперстную кишку, что в конечном итоге может привести к образованию язв.
Helicobacter pylori является канцерогеном I класса , и потенциальные виды рака включают лимфомы , связанные со слизистой оболочкой желудка (MALT) , и рак желудка . [10] [11] [53] Реже риск представляет диффузная крупноклеточная В-клеточная лимфома желудка. [54] Инфекция H. pylori является причиной около 89 процентов всех случаев рака желудка и связана с развитием 5,5 процентов всех случаев рака во всем мире. [13] [14] Хотя данные различаются в разных странах, в целом около 1–3 % людей, инфицированных Helicobacter pylori, заболевают раком желудка в течение жизни по сравнению с 0,13 % людей, у которых не было инфекции H. pylori . [55] [32] Рак желудка, вызванный H. pylori , является третьей по величине причиной смертности от рака в мире по состоянию на 2018 год. [56] Из-за обычного отсутствия симптомов, когда рак желудка наконец диагностируется, он часто находится на довольно поздней стадии. Более половины пациентов с раком желудка имеют метастазы в лимфатических узлах, когда им изначально ставят диагноз. [57]
Хроническое воспаление, которое является признаком развития рака, характеризуется инфильтрацией нейтрофилов и макрофагов в эпителий желудка, что способствует накоплению провоспалительных цитокинов , активных форм кислорода (ROS) и активных форм азота (RNS), которые вызывают повреждение ДНК . [58] Окислительное повреждение ДНК и уровни окислительного стресса могут быть обозначены биомаркером 8-oxo-dG . [58] [59] Другие повреждения ДНК включают двухцепочечные разрывы . [60]
Небольшие желудочные и колоректальные полипы — это аденомы , которые чаще всего встречаются в связи с повреждением слизистой оболочки, вызванным гастритом H. pylori . [61] [62] Более крупные полипы со временем могут стать раковыми. [63] [61] Была установлена умеренная связь H. pylori с развитием колоректального рака , но по состоянию на 2020 год причинно-следственная связь еще не была доказана. [64] [63]
Признаки и симптомы
У большинства людей, инфицированных H. pylori, никогда не возникают какие-либо симптомы или осложнения, но у них есть 10–20% риск развития пептической язвы или 0,5–2% риск рака желудка. [8] [65] Гастрит, вызванный H. pylori, может проявляться как острый гастрит с болью в животе , тошнотой и продолжающейся диспепсией (несварением желудка), которая иногда сопровождается депрессией и тревогой. [8] [66] Когда гастрит переходит в хронический гастрит или язву, симптомы те же и могут включать несварение желудка, боли в желудке или животе, тошноту, вздутие живота , отрыжку , чувство голода по утрам, чувство быстрого насыщения, а иногда и рвоту , изжогу, неприятный запах изо рта и потерю веса. [67] [68]
Осложнения язвы могут вызывать серьезные признаки и симптомы, такие как черный или дегтеобразный стул, указывающий на кровотечение в желудок или двенадцатиперстную кишку; кровь - либо красная, либо цвета кофейной гущи в рвоте; постоянная острая или сильная боль в животе; головокружение и учащенное сердцебиение. [67] [68] Кровотечение является наиболее распространенным осложнением. В случаях, вызванных H. pylori, наблюдалась большая потребность в гемостазе, часто требующая резекции желудка. [69] Длительное кровотечение может вызвать анемию, приводящую к слабости и утомляемости. Воспаление пилорического отдела желудка, который соединяет желудок с двенадцатиперстной кишкой, с большей вероятностью приведет к язве двенадцатиперстной кишки, в то время как воспаление тела желудка может привести к язве желудка.
Рак желудка может вызывать тошноту, рвоту, диарею, запор и необъяснимую потерю веса. [70] Полипы желудка — это аденомы , которые обычно бессимптомны и доброкачественны, но могут быть причиной диспепсии, изжоги, желудочного кровотечения и, редко, желудочной обструкции. [61] [71] Более крупные полипы могут стать раковыми . [61] Колоректальные полипы могут быть причиной ректального кровотечения, анемии, запора, диареи, потери веса и боли в животе. [72]
Патофизиология
Факторы вирулентности помогают патогену избегать иммунного ответа хозяина и успешно колонизировать . Многие факторы вирулентности H. pylori включают его жгутики, продукцию уреазы, адгезинов, сериновой протеазы HtrA (требование высокой температуры A) и основные экзотоксины CagA и VacA . [30] [73] Наличие VacA и CagA связано с более поздними результатами . [74] CagA — это онкобелок, связанный с развитием рака желудка. [7]

_Crossing_Mucus_Layer_of_Stomach.jpg/440px-Ulcer-causing_Bacterium_(H.Pylori)_Crossing_Mucus_Layer_of_Stomach.jpg)
Инфекция H. pylori связана с эпигенетически сниженной эффективностью механизма репарации ДНК , что способствует накоплению мутаций и геномной нестабильности, а также желудочному канцерогенезу. [75] Было показано, что экспрессия двух белков репарации ДНК, ERCC1 и PMS2 , была значительно снижена, как только инфекция H. pylori прогрессировала и стала причиной диспепсии . [76] Диспепсия встречается примерно у 20% инфицированных людей. [77] Также очевидно эпигенетически сниженное экспрессирование белков репарации ДНК MLH1 , MGMT и MRE11 . Снижение репарации ДНК при наличии повышенного повреждения ДНК увеличивает канцерогенные мутации и, вероятно, является значимой причиной желудочного канцерогенеза. [59] [78] [79] Эти эпигенетические изменения обусловлены метилированием CpG-сайтов в промоторах генов, вызванным H. pylori [78], и измененной экспрессией множественных микроРНК , вызванной H. pylori . [79]
Были предложены два связанных механизма, посредством которых H. pylori может способствовать развитию рака. Один механизм включает повышенную продукцию свободных радикалов вблизи H. pylori и повышенную скорость мутации клеток-хозяев . Другой предложенный механизм был назван «перигенетическим путем» [80] и включает усиление фенотипа трансформированных клеток-хозяев посредством изменений в клеточных белках, таких как белки адгезии . Было предложено, что H. pylori вызывает воспаление и локально высокие уровни фактора некроза опухоли (ФНО), также известного как фактор некроза опухоли альфа (ФНОα)), и/или интерлейкина 6 (ИЛ-6). [81] Согласно предложенному перигенетическому механизму, связанные с воспалением сигнальные молекулы, такие как ФНО, могут изменять адгезию эпителиальных клеток желудка и приводить к дисперсии и миграции мутировавших эпителиальных клеток без необходимости дополнительных мутаций в генах-супрессорах опухолей , таких как гены, которые кодируют белки клеточной адгезии. [82]
Жгутик
Первым фактором вирулентности Helicobacter pylori , который обеспечивает колонизацию, является его жгутик . [83] H. pylori имеет от двух до семи жгутиков в одном и том же полярном месте , что обеспечивает ему высокую подвижность. Жгутиковые нити имеют длину около 3 мкм и состоят из двух сополимеризованных флагеллинов , FlaA и FlaB, кодируемых генами flaA и flaB . [26] [73] Малый флагеллин FlaB расположен в проксимальной области, а основной флагеллин FlaA составляет остальную часть жгутика. [84] Жгутики покрыты оболочкой в продолжении бактериальной наружной мембраны, которая обеспечивает защиту от желудочной кислотности. Оболочка также является местом происхождения везикул наружной мембраны, которая обеспечивает защиту бактерии от бактериофагов. [84]
Подвижность жгутиков обеспечивается движущей силой протонов , обеспечиваемой гидролизом под действием уреазы, что позволяет осуществлять хемотаксические движения в направлении менее кислого градиента pH в слизистой оболочке. [30] Толщина слоя слизи составляет около 300 мкм , а спиральная форма H. pylori, поддерживаемая ее жгутиками, помогает ей прорываться через этот слой, где она колонизирует узкую область размером около 25 мкм, наиболее близкую к слою эпителиальных клеток, где pH близок к нейтральному. Они далее колонизируют желудочные ямки и живут в желудочных железах . [1] [84] [85] Иногда бактерии обнаруживаются внутри самих эпителиальных клеток. [86] Использование бактериями кворумного зондирования позволяет формировать биопленку, которая способствует стойкой колонизации. В слоях биопленки H. pylori может избегать действия антибиотиков, а также быть защищенной от иммунных реакций хозяина. [87] [88] В биопленке H. pylori может изменять жгутики, превращаясь в адгезивные структуры. [89]
Уреаза

Помимо использования хемотаксиса для избегания областей с высокой кислотностью (низким pH), H. pylori также вырабатывает большое количество уреазы , фермента , который расщепляет мочевину, присутствующую в желудке, для производства аммиака и бикарбоната , которые высвобождаются в бактериальный цитозоль и окружающую среду, создавая нейтральную область. [90] Пониженная кислотность (более высокий pH) изменяет слой слизи из гелеобразного состояния в более вязкое состояние, что облегчает жгутикам перемещение бактерий через слизистую оболочку и прикрепление к эпителиальным клеткам желудка. [90] Helicobacter pylori является одним из немногих известных типов бактерий, которые имеют цикл мочевины , который уникально настроен в бактерии. [91] 10% клетки состоит из азота , баланс, который необходимо поддерживать. Любой избыток хранится в мочевине, выделяемой в цикле мочевины. [91]
Конечным ферментом цикла мочевины является аргиназа , фермент, который имеет решающее значение для патогенеза H. pylori . Аргиназа производит орнитин и мочевину, которые фермент уреаза расщепляет на угольную кислоту и аммиак. Уреаза является самым распространенным белком бактерии, составляя 10–15% от общего содержания белка бактерии. Его экспрессия необходима не только для установления начальной колонизации при расщеплении мочевины на угольную кислоту и аммиак, но и необходима для поддержания хронической инфекции. [92] [65] Аммиак снижает кислотность желудка, позволяя бактериям закрепляться локально. Аргиназа способствует сохранению инфекции, потребляя аргинин; аргинин используется макрофагами для производства оксида азота, который обладает сильным антимикробным действием. [91] [93] Аммиак, вырабатываемый для регуляции pH , токсичен для эпителиальных клеток. [94]
Адгезины
H. pylori должен прикрепиться к эпителиальным клеткам, чтобы предотвратить его смытие постоянным движением и обновлением слизи. Чтобы обеспечить им эту адгезию, вырабатываются бактериальные наружные мембранные белки как факторы вирулентности, называемые адгезинами . [95] BabA (адгезин, связывающий антиген группы крови) наиболее важен во время начальной колонизации, а SabA (адгезин, связывающий сиаловую кислоту) важен для персистенции. BabA прикрепляется к гликанам и муцинам в эпителии. [95] BabA (кодируемый геном babA2 ) также связывается с антигеном Льюиса b, отображаемым на поверхности эпителиальных клеток. [96] Адгезия через BabA чувствительна к кислоте и может быть полностью отменена при снижении pH. Было высказано предположение, что кислотная чувствительность BabA обеспечивает адгезию, а также позволяет эффективно избегать неблагоприятной среды, такой как низкий pH, который вреден для организма. [97] SabA (кодируемый геном sabA ) связывается с повышенными уровнями антигена сиалил-Льюис X , экспрессируемого на слизистой оболочке желудка. [98]
Холестерин глюкозид
Внешняя мембрана содержит холестеринглюкозид , стеролглюкозид, который H. pylori гликозилирует из холестерина в клетках желудочных желез и вставляет его в свою внешнюю мембрану. [99] Этот холестеринглюкозид важен для стабильности мембраны, морфологии и уклонения от иммунного ответа и редко встречается у других бактерий. [100] [101]
Фермент, ответственный за это, — холестерил α-глюкозилтрансфераза (αCgT или Cgt), кодируемая геном HP0421 . [102] Основным эффектом истощения холестерина хозяина с помощью Cgt является разрушение богатых холестерином липидных рафтов в эпителиальных клетках. Липидные рафты участвуют в передаче сигналов клетками, и их разрушение вызывает снижение иммунного воспалительного ответа, в частности, за счет снижения интерферона гамма . [103] Cgt также секретируется системой секреции типа IV и секретируется селективно, так что создаются желудочные ниши, где может процветать патоген. [102] Было показано, что его недостаток делает бактерии уязвимыми к стрессу окружающей среды, а также нарушает взаимодействия, опосредованные CagA. [99]
каталаза
Колонизация вызывает интенсивную противовоспалительную реакцию как первую линию защиты иммунной системы. Фагоцитарные лейкоциты и моноциты проникают в место инфекции, и вырабатываются антитела. [104] H. pylori способен прикрепляться к поверхности фагоцитов и препятствовать их действию. На это фагоцит реагирует образованием и высвобождением метаболитов кислорода в окружающее пространство. H. pylori может пережить эту реакцию благодаря активности каталазы при ее прикреплении к поверхности фагоцитарной клетки. Каталаза разлагает перекись водорода на воду и кислород, защищая бактерии от токсичности. Было показано, что каталаза почти полностью подавляет фагоцитарную окислительную реакцию. [104] Она кодируется геном katA . [105]
Типα
TNF-индуцирующий белок альфа (Tipα) — это канцерогенный белок, кодируемый HP0596, уникальный для H. pylori , который индуцирует экспрессию фактора некроза опухоли . [82] [106] Tipα проникает в клетки рака желудка, где он связывается с нуклеолином на поверхности клетки и индуцирует экспрессию виментина . Виментин играет важную роль в эпителиально-мезенхимальном переходе , связанном с прогрессированием опухолей. [107]
CagA
CagA (антиген А, ассоциированный с цитотоксином) является основным фактором вирулентности H. pylori , онкопротеином , который кодируется геном cagA . Бактериальные штаммы с геном cagA связаны со способностью вызывать язвы, лимфомы MALT и рак желудка. [108] [109] Ген cagA кодирует относительно длинный (1186 аминокислот ) белок. Остров патогенности cag (PAI) имеет около 30 генов, часть из которых кодирует сложную систему секреции типа IV (T4SS или TFSS). Низкое содержание GC в cag PAI относительно остальной части генома Helicobacter предполагает, что остров был приобретен путем горизонтального переноса от другого вида бактерий. [38] Сериновая протеаза HtrA также играет важную роль в патогенезе H. pylori . Белок HtrA позволяет бактерии перемещаться через эпителий клеток хозяина, а также необходим для транслокации CagA. [110]
Вирулентность H. pylori может быть повышена генами острова патогенности cag ; около 50–70% штаммов H. pylori в западных странах несут его. [111] Западные люди, инфицированные штаммами, несущими cag PAI, имеют более сильную воспалительную реакцию в желудке и подвергаются большему риску развития пептической язвы или рака желудка, чем те, кто инфицирован штаммами, не имеющими этого острова. [32] После прикрепления H. pylori к эпителиальным клеткам желудка система секреции типа IV, экспрессируемая cag PAI, «впрыскивает» вызывающий воспаление агент, пептидогликан, из их собственных клеточных стенок в эпителиальные клетки. Введенный пептидогликан распознается цитоплазматическим рецептором распознавания образов (иммунным сенсором) Nod1, который затем стимулирует экспрессию цитокинов , способствующих воспалению. [112]
Аппарат секреции типа IV также вводит белок CagA, кодируемый cag PAI, в эпителиальные клетки желудка, где он нарушает цитоскелет , прилипание к соседним клеткам, внутриклеточную сигнализацию, полярность клеток и другие клеточные активности. [113] Попав внутрь клетки, белок CagA фосфорилируется по остаткам тирозина с помощью тирозинкиназы (TK), связанной с мембраной клетки-хозяина . Затем CagA аллостерически активирует протеинтирозинфосфатазу / протоонкоген Shp2 . [114] Эти белки напрямую токсичны для клеток, выстилающих желудок, и сильно сигнализируют иммунной системе о том, что происходит вторжение. В результате присутствия бактерий нейтрофилы и макрофаги обосновываются в ткани, чтобы бороться с атакой бактерий. [115] Было показано, что патогенные штаммы H. pylori активируют рецептор эпидермального фактора роста (EGFR), мембранный белок с доменом TK . Активация EGFR H. pylori связана с измененной передачей сигнала и экспрессией генов в эпителиальных клетках хозяина, что может способствовать патогенезу. Также предполагается, что C-концевая область белка CagA (аминокислоты 873–1002) способна регулировать транскрипцию генов клетки хозяина , независимо от фосфорилирования тирозина белка. [109] Существует большое разнообразие между штаммами H. pylori , и штамм, который инфицирует человека, может предсказать результат.
ВакА
VacA (вакуолизирующий цитотоксиновый аутотранспортер) является еще одним основным фактором вирулентности, кодируемым геном vacA . [116] Все штаммы H. pylori несут этот ген, но существует большое разнообразие, и только 50% продуцируют кодируемый цитотоксин. [92] [33] Четыре основных подтипа vacA — это s1/m1, s1/m2, s2/m1 и s2/m2 . Известно, что s1/m1 и s1/m2 вызывают повышенный риск рака желудка. [117] VacA — это олигомерный белковый комплекс, который вызывает прогрессирующую вакуолизацию в эпителиальных клетках, приводящую к их гибели. [118] Вакуолизация также связана с продвижением внутриклеточных резервуаров H. pylori путем нарушения клеточной мембраны кальциевого канала TRPML1 . [119] Было показано, что VacA повышает уровень COX2 , повышающей регуляции, которая увеличивает выработку простагландина, что указывает на сильную воспалительную реакцию клетки-хозяина. [118] [120]
Белки и везикулы внешней мембраны
Около 4% генома кодирует белки внешней мембраны , которые можно сгруппировать в пять семейств. [121] Самое большое семейство включает бактериальные адгезины . Остальные четыре семейства — порины , транспортеры железа, белки, ассоциированные со жгутиками , и белки неизвестной функции. Как и у других типичных грамотрицательных бактерий, внешняя мембрана H. pylori состоит из фосфолипидов и липополисахарида (ЛПС). О-антиген ЛПС может быть фукозилирован и имитировать антигены группы крови Льюиса , обнаруженные на желудочном эпителии. [32]
H. pylori образует пузырьки из внешней мембраны, которые отщепляются как везикулы внешней мембраны, обеспечивая альтернативную систему доставки факторов вирулентности, включая CagA. [99]
Известно, что богатый цистеином белок Helicobacter HcpA запускает иммунный ответ, вызывая воспаление. [122] Фактор вирулентности Helicobacter pylori DupA связан с развитием язвы двенадцатиперстной кишки. [123]
Механизмы толерантности
Необходимость выживания привела к развитию различных механизмов толерантности, которые обеспечивают устойчивость H. pylori . [124] Эти механизмы также могут помочь преодолеть эффекты антибиотиков. [124] H. pylori должен не только выживать в условиях высокой кислотности желудка, но и в условиях непрерывной перистальтики , вымывания слизи и фагоцитарной атаки, сопровождающейся высвобождением активных форм кислорода . [125] Все организмы кодируют генетические программы для реагирования на стрессовые условия, включая те, которые вызывают повреждение ДНК. [126] Стрессовые условия активируют механизмы реакции бактерий, которые регулируются белками, экспрессируемыми генами-регуляторами . [124] Окислительный стресс может вызывать потенциально летальные мутагенные аддукты ДНК в его геноме. Выживание при таком повреждении ДНК поддерживается рекомбинационной репарацией , опосредованной трансформацией , которая способствует успешной колонизации. [127] [128] H. pylori от природы способен к трансформации. В то время как многие организмы компетентны только в определенных условиях окружающей среды, таких как голодание, H. pylori компетентна на протяжении всего логарифмического роста. [126]
Трансформация (перенос ДНК из одной бактериальной клетки в другую через промежуточную среду), по-видимому, является частью адаптации к репарации ДНК . [126] Гомологичная рекомбинация необходима для восстановления двухцепочечных разрывов (DSB). Комплекс геликазы и нуклеазы AddAB рассекает DSB и загружает RecA на одноцепочечную ДНК (ssDNA), которая затем опосредует обмен цепями, что приводит к гомологичной рекомбинации и репарации. Требование RecA плюс AddAB для эффективной колонизации желудка предполагает, что H. pylori либо подвергается повреждению двухцепочечной ДНК, которое необходимо восстановить, либо требует какого-либо другого события, опосредованного рекомбинацией. В частности, естественная трансформация усиливается повреждением ДНК в H. pylori , и существует связь между реакцией на повреждение ДНК и поглощением ДНК в H. pylori . [126] Эта естественная компетентность способствует персистенции H. pylori . H. pylori имеет гораздо более высокие показатели рекомбинации и мутации, чем другие бактерии. [3] Генетически различные штаммы могут быть обнаружены у одного и того же хозяина, а также в разных областях желудка. [129] Общая реакция на множественные стрессоры может быть результатом взаимодействия механизмов. [124]
Белки RuvABC необходимы для процесса рекомбинационной репарации, поскольку они разрешают промежуточные продукты в этом процессе, называемые соединениями Холлидея . Мутанты H. pylori , которые дефектны в RuvC, имеют повышенную чувствительность к агентам, повреждающим ДНК, и к окислительному стрессу, демонстрируют сниженную выживаемость в макрофагах и неспособны установить успешную инфекцию в мышиной модели. [130] Аналогичным образом, белок RecN играет важную роль в репарации DSB. [131] Мутант H. pylori recN демонстрирует ослабленную способность колонизировать желудки мышей, подчеркивая важность рекомбинационной репарации ДНК для выживания H. pylori в организме хозяина. [131]
Биопленка
Эффективным устойчивым ответом колонизации является образование биопленки . Сначала прикрепившись к клеточным поверхностям, бактерии производят и секретируют внеклеточное полимерное вещество (ЭПС). ЭПС в основном состоит из биополимеров и обеспечивает каркас для структуры биопленки. [90] H. pylori помогает формированию биопленки, изменяя свои жгутики в адгезивные структуры, которые обеспечивают адгезию между клетками. [89] Слои агрегированных бактерий в виде микроколоний накапливаются, утолщая биопленку.
Матрица EPS предотвращает проникновение антибиотиков и иммунных клеток, а также обеспечивает защиту от тепла и конкуренции со стороны других микроорганизмов. [90] Между клетками в матрице биопленки образуются каналы, позволяющие транспортировать питательные вещества, ферменты, метаболиты и отходы. [90] Клетки в глубоких слоях могут быть лишены питания и перейти в состояние, подобное коккоидному покою. [132] [133] При изменении формы бактерии на коккоидную форму воздействие ЛПС (на которое направлены антибиотики) становится ограниченным и, таким образом, избегает обнаружения иммунной системой. [134] Также было показано, что остров патогенности cag остается нетронутым в коккоидной форме. [134] Некоторые из этих устойчивых к антибиотикам клеток могут оставаться в хозяине как персистирующие клетки . После эрадикации персистирующие клетки могут вызвать рецидив инфекции. [132] [133] Бактерии могут отделяться от биопленки, перемещаться и колонизировать другие участки желудка, образуя другие биопленки. [90]
Диагноз

Колонизация H. pylori не всегда приводит к заболеванию, но связана с рядом заболеваний желудка . [32] Тестирование рекомендуется в случаях язвенной болезни или низкосортной желудочной MALT-лимфомы ; после эндоскопической резекции раннего рака желудка ; для родственников первой степени родства с раком желудка и в некоторых случаях расстройства желудка. Другие показания, побуждающие к тестированию на H. pylori , включают длительное использование аспирина или других нестероидных противовоспалительных препаратов , необъяснимую железодефицитную анемию или в случаях иммунной тромбоцитопенической пурпуры . [135] Существует несколько методов тестирования, как инвазивных, так и неинвазивных.
Неинвазивные тесты на инфекцию H. pylori включают серологические тесты на антитела , анализы кала и дыхательные тесты с мочевиной . Дыхательные тесты с мочевиной включают использование углерода-13 или радиоактивного углерода-14, производящего меченый углекислый газ, который можно обнаружить в дыхании. [136] Дыхательные тесты с мочевиной имеют высокую чувствительность и специфичность для диагностики H. pylori . [136]
Ингибиторы протонной помпы и антибиотики следует прекратить как минимум за 30 дней до тестирования на инфекцию H. pylori или ее эрадикацию, поскольку оба агента подавляют рост H. pylori и могут привести к ложноотрицательным результатам. [135] Тестирование для подтверждения эрадикации рекомендуется проводить через 30 дней или более после завершения лечения инфекции H. pylori . Дыхательный тест на H. pylori или тестирование на антигены кала являются разумными тестами для подтверждения эрадикации. [135] Серологическое тестирование на H. pylori , включая антитела IgG , не рекомендуется в качестве теста на эрадикацию, поскольку они могут оставаться повышенными в течение многих лет после успешного лечения инфекции. [135]
Эндоскопическая биопсия является инвазивным методом проверки на инфекцию H. pylori . Инфекции низкого уровня могут быть пропущены при биопсии, поэтому рекомендуется несколько образцов. Наиболее точным методом выявления инфекции H. pylori является гистологическое исследование из двух участков после эндоскопической биопсии в сочетании с быстрым уреазным тестом или микробной культурой. [137] Как правило, повторная эндоскопия не рекомендуется для подтверждения эрадикации H. pylori , если нет особых показаний для повторения процедуры. [135]
Передача инфекции
Helicobacter pylori заразен и передается через прямой контакт либо со слюной (орально-оральный путь), либо с калом ( фекально-оральный путь ), но в основном через орально-оральный путь. [8] В соответствии с этими путями передачи бактерии были выделены из кала , слюны и зубного налета . [138] H. pylori также может передаваться при употреблении зараженной пищи или воды. [139] Передача происходит в основном внутри семей в развитых странах, но также и от более широкого сообщества в развивающихся странах. [140]
Профилактика
Для предотвращения развития заболеваний, связанных с H. pylori , при подозрении на инфекцию рекомендуются схемы терапии на основе антибиотиков для уничтожения бактерий . [46] В случае успеха прогрессирование заболевания останавливается. Терапия первой линии рекомендуется, если диагностирована низкосортная лимфома желудка MALT, независимо от доказательств H. pylori . Однако, если достигается тяжелое состояние атрофического гастрита с поражениями желудка, схемы лечения на основе антибиотиков не рекомендуются, поскольку такие поражения часто необратимы и будут прогрессировать до рака желудка. [46] Если рак удается вылечить, рекомендуется следовать программе эрадикации, чтобы предотвратить рецидив инфекции или уменьшить рецидив рака, известного как метахронный. [46] [141] [142]
Из-за роли H. pylori как основной причины некоторых заболеваний (особенно рака) и его постоянно растущей устойчивости к антибиотикотерапии , существует очевидная потребность в альтернативных методах лечения. [143] Вакцина, нацеленная на развитие рака желудка, включая MALT-лимфому, также предотвратит развитие язвы желудка. [5] Главными целями являются вакцина, которая будет профилактической для использования у детей, и вакцина, которая будет терапевтической позже. Проблемы в этом направлении заключаются в чрезвычайном геномном разнообразии, демонстрируемом H. pylori , и сложных иммунных реакциях хозяина. [143] [144]
Предыдущие исследования в Нидерландах и США показали, что такая профилактическая программа вакцинации будет в конечном итоге экономически эффективной. [145] [146] Однако по состоянию на конец 2019 года не было ни одной перспективной вакцины-кандидата, и только одна вакцина находилась в фазе I клинических испытаний. Кроме того, разработка вакцины против H. pylori не была приоритетом для крупных фармацевтических компаний. [147] Ключевой целью для потенциальной терапии является протон-зависимый мочевинный канал , поскольку секреция уреазы обеспечивает выживание бактерии. [148]
Уход
В докладе Маастрихтского консенсуса 2022 года гастрит, вызванный H. pylori, был признан гастритом, вызванным Helicobacter pylori , и был включен в МКБ-11 . [44] [45] [46] Первоначально инфекция имеет тенденцию быть поверхностной, локализованной в верхних слоях слизистой оболочки желудка. [149] Интенсивность хронического воспаления связана с цитотоксичностью штамма H. pylori . Более высокая цитотоксичность приведет к изменению неатрофического гастрита на атрофический гастрит с потерей слизистых желез . Это состояние является предвестником развития пептических язв и аденокарциномы желудка. [149]
Для лечения инфекции, в том числе при прогрессировании язвенной болезни , рекомендуется искоренение H. pylori . Рекомендации по лечению первой линии — это четырехкомпонентная терапия, состоящая из ингибитора протонной помпы , амоксициллина , кларитромицина и метронидазола . Перед лечением рекомендуется провести тестирование для выявления любой ранее существовавшей резистентности к антибиотикам. Наблюдался высокий уровень резистентности к метронидазолу. В районах с известной резистентностью к кларитромицину терапия первой линии заменяется на схему на основе висмута , включающую тетрациклин и метронидазол на 14 дней. Если один из этих курсов лечения не дает результата, предлагается использовать альтернативный вариант. [44]
Неудача лечения обычно может быть связана с устойчивостью к антибиотикам или недостаточным подавлением кислоты ингибиторами протонной помпы. [150] После клинических испытаний использование калий-конкурентного блокатора кислоты вонопразан , который обладает более сильным подавляющим кислоту действием, было одобрено для использования в США в 2022 году. [151] [150] Его рекомендуется использовать в сочетании с амоксициллином, с кларитромицином или без него. Было показано, что он имеет более быстрое действие и может использоваться с пищей или без нее. [150] Успешные схемы эрадикации произвели революцию в лечении пептических язв. [152] [153] Эрадикация H. pylori также связана с последующим снижением риска рецидива язвы двенадцатиперстной кишки или желудка. [135]
Растительные экстракты и пробиотические продукты питания все чаще используются в качестве дополнений к обычному лечению. Пробиотические йогурты, содержащие молочнокислые бактерии Bifidobacteria и Lactobacillus, оказывают подавляющее действие на инфекцию H. pylori , и было показано, что их использование улучшает показатели искоренения. [14] Некоторые комменсальные кишечные бактерии как часть кишечной микробиоты производят бутират , который действует как пребиотик и усиливает иммунный барьер слизистой оболочки. Их использование в качестве пробиотиков может помочь сбалансировать дисбактериоз кишечника, который сопровождает использование антибиотиков. [154] Было показано, что некоторые пробиотические штаммы обладают бактерицидной и бактериостатической активностью против H. pylori , а также помогают сбалансировать дисбактериоз кишечника. [155] [134] Антибиотики оказывают негативное влияние на желудочно-кишечную микробиоту и вызывают тошноту, диарею и недомогание , которые могут облегчить пробиотики. [134]
Устойчивость к антибиотикам
Повышение устойчивости к антибиотикам является основной причиной первоначальной неудачи лечения. Факторы, связанные с устойчивостью, включают мутации, эффлюксные насосы и образование биопленок . [156] [157] Одним из основных антибиотиков, используемых в эрадикационной терапии, является кларитромицин , но штаммы, устойчивые к кларитромицину, стали общепризнанными, и необходимо рассмотреть возможность использования альтернативных антибиотиков. К счастью, стали доступны неинвазивные анализы кала на кларитромицин, которые позволяют отбирать пациентов, которые, вероятно, отреагируют на терапию. [158] Множественная лекарственная устойчивость также возросла. [157] Могут использоваться дополнительные раунды антибиотиков или другие методы лечения. [159] [160] [161] Секвенирование следующего поколения рассматривается для выявления первоначальной специфической устойчивости к антибиотикам, что поможет в определении более эффективного лечения. [162]
В 2018 году ВОЗ включила H. pylori в список высокоприоритетных патогенов для исследований и разработки новых лекарств и методов лечения. [163] Растущая устойчивость к антибиотикам стимулировала интерес к разработке альтернативных методов лечения с использованием ряда растительных соединений. [164] [165] Растительные соединения имеют меньше побочных эффектов, чем синтетические препараты. Большинство растительных экстрактов содержат сложную смесь компонентов, которые сами по себе могут не действовать как противомикробные препараты, но могут работать вместе с антибиотиками для улучшения лечения и преодоления устойчивости. [164] Растительные соединения имеют другой механизм действия, который оказался полезным в борьбе с устойчивостью к противомикробным препаратам. Например, различные соединения могут действовать, ингибируя ферменты, такие как уреаза, и ослабляя адгезию к слизистой оболочке. [166] Было показано, что серосодержащие соединения из растений с высокой концентрацией полисульфидов, кумаринов и терпенов эффективны против H. pylori . [164]
H. pylori обнаруживается в слюне и зубном налете . Известно, что его передача происходит через ротовую полость, что позволяет предположить, что биопленка зубного налета может выступать в качестве резервуара для бактерий. Поэтому пародонтальная терапия или скалинг и выравнивание корней были предложены в качестве дополнительного лечения для повышения показателей эрадикации, но необходимы дополнительные исследования. [139] [167]
Раковые заболевания
Рак желудка
Helicobacter pylori является фактором риска развития аденокарциномы желудка . [168] Лечение очень агрессивное, даже локализованное заболевание лечится последовательно химиотерапией и радиотерапией перед хирургической резекцией. [169] Поскольку этот рак, однажды развившийся, не зависит от инфекции H. pylori , схемы эрадикации не применяются. [170]
Желудочная лимфома MALT и DLBCL
MALT-лимфомы — это злокачественные новообразования лимфоидной ткани, ассоциированной со слизистой оболочкой . Ранние желудочные MALTомы, вызванные H. pylori , можно успешно лечить (в 70–95% случаев) с помощью одной или нескольких программ эрадикации . [14] У 50–80% пациентов, у которых удалось эрадикации возбудителя, в течение 3–28 месяцев развивается ремиссия и долгосрочный клинический контроль над лимфомой. Лучевая терапия желудка и окружающих (т. е. перигастральных) лимфатических узлов также использовалась для успешного лечения этих локализованных случаев. Пациентов с нелокализованным (т. е. системным заболеванием III и IV стадии по шкале Энн-Арбор) заболеванием, у которых отсутствуют симптомы, лечили методом бдительного ожидания или, в случае наличия симптомов, иммунотерапевтическим препаратом ритуксимабом (в течение 4 недель) в сочетании с химиотерапевтическим препаратом хлорамбуцилом в течение 6–12 месяцев; 58% этих пациентов достигают 58%-ной выживаемости без прогрессирования в течение 5 лет. Пациенты со слабой стадией III/IV успешно лечились ритуксимабом или химиотерапевтическим препаратом циклофосфамидом в отдельности. [171] Терапия эрадикацией антибиотиком-ингибитором протонной помпы и локализованная лучевая терапия успешно применялись для лечения MALT-лимфом прямой кишки, положительных по H. pylori; однако лучевая терапия дала несколько лучшие результаты и поэтому была предложена в качестве предпочтительного метода лечения заболевания. [172] Однако общепризнанным методом выбора для пациентов с системным поражением являются различные химиотерапевтические препараты, часто в сочетании с ритуксимабом.
MALT-лимфома может редко трансформироваться в более агрессивную диффузную крупноклеточную В-клеточную лимфому (DLBCL). [173] Если это связано с инфекцией H. pylori , DLBCL менее агрессивна и более поддается лечению. [174] [175] [176] Если она ограничена желудком, ее иногда успешно лечат с помощью программ по эрадикации H. pylori . [54] [175] [177] [176] Если она не отвечает или наблюдается ухудшение, можно рассмотреть более традиционную химиотерапию ( CHOP ), иммунотерапию или локальную лучевую терапию, и любая из этих процедур или их комбинация успешно лечат эти более запущенные типы. [175] [176]
Прогноз
Helicobacter pylori колонизирует желудок на протяжении десятилетий у большинства людей и вызывает хронический гастрит, длительное воспаление желудка. В большинстве случаев симптомы не проявляются, но примерно у 10–20% инфицированных в конечном итоге развиваются язвы желудка и двенадцатиперстной кишки, и у них есть возможный риск рака желудка в течение жизни в 1–2%. [65]
H. pylori процветает в диете с высоким содержанием соли, которая рассматривается как экологический фактор риска для ее связи с раком желудка. Диета с высоким содержанием соли усиливает колонизацию, усиливает воспаление, увеличивает экспрессию факторов вирулентности H. pylori и усиливает хронический гастрит. [178] [179] Как это ни парадоксально, экстракты кимчи , соленой пробиотической пищи, как было обнаружено, оказывают профилактическое действие на желудочный канцерогенез, связанный с H. pylori . [180]
При отсутствии лечения инфекция H. pylori обычно сохраняется на всю жизнь. [181] Инфекция может исчезнуть у пожилых людей, поскольку слизистая оболочка желудка становится все более атрофичной и неприветливой к колонизации. Некоторые исследования на маленьких детях до двух лет показали, что инфекция может быть транзиторной в этой возрастной группе. [182] [183]
H. pylori может повторно появиться у человека после эрадикации. Этот рецидив может быть вызван исходным штаммом ( рецидив ) или другим штаммом ( реинфекция ). Метаанализ 2017 года показал, что глобальные годовые показатели рецидива, реинфекции и рецидива на человека составляют 4,3%, 3,1% и 2,2% соответственно. Неясно, каковы основные факторы риска. [184]
Растущее количество доказательств свидетельствует о том, что H. pylori играет важную роль в защите от некоторых заболеваний. [16] Частота возникновения кислотного рефлюкса , пищевода Барретта и рака пищевода резко возросла в то же время, когда присутствие H. pylori уменьшилось . [185] В 1996 году Мартин Дж. Блейзер выдвинул гипотезу о том, что H. pylori оказывает благотворное влияние, регулируя кислотность содержимого желудка. [51] [185] Эта гипотеза не является общепринятой, поскольку несколько рандомизированных контролируемых исследований не смогли продемонстрировать ухудшения симптомов кислотного рефлюкса после эрадикации H. pylori . [186] [187] Тем не менее, Блейзер подтвердил свою точку зрения о том, что H. pylori является членом нормальной желудочной микробиоты . [17] Он постулирует, что изменения в физиологии желудка, вызванные потерей H. pylori , объясняют недавнее увеличение заболеваемости несколькими заболеваниями, включая диабет 2 типа , ожирение и астму. [17] [188] Его группа недавно показала, что колонизация H. pylori связана с более низкой заболеваемостью астмой у детей. [189]
Эпидемиология
По оценкам, в 2023 году около двух третей населения мира были инфицированы инфекцией H. pylori , которая чаще встречается в развивающихся странах . [20] Инфекция H. pylori более распространена в Южной Америке, странах Африки к югу от Сахары и на Ближнем Востоке. [153] Глобальная распространенность заметно снизилась в десятилетие после 2010 года, особенно в Африке. [21]
Возраст, когда кто-то приобретает эту бактерию, по-видимому, влияет на патологический исход инфекции. Люди, инфицированные в раннем возрасте, вероятно, разовьют более интенсивное воспаление, которое может сопровождаться атрофическим гастритом с более высоким последующим риском язвы желудка, рака желудка или и того, и другого. Приобретение в более старшем возрасте приводит к различным желудочным изменениям, которые с большей вероятностью приведут к язве двенадцатиперстной кишки. [181] Инфекции обычно приобретаются в раннем детстве во всех странах. [32] Однако уровень инфицирования детей в развивающихся странах выше, чем в промышленно развитых странах , вероятно, из-за плохих санитарных условий, возможно, в сочетании с более низким использованием антибиотиков для лечения не связанных патологий. В развитых странах в настоящее время редко встречаются инфицированные дети, но процент инфицированных людей увеличивается с возрастом. Более высокая распространенность среди пожилых людей отражает более высокие показатели инфицирования в детстве. [32] В Соединенных Штатах распространенность, по-видимому, выше среди афроамериканского и латиноамериканского населения, скорее всего, из-за социально-экономических факторов. [190] [191] Более низкий уровень инфицирования на Западе в значительной степени объясняется более высокими стандартами гигиены и широким использованием антибиотиков. Несмотря на высокие показатели инфицирования в некоторых регионах мира, общая частота заражения H. pylori снижается. [192] Однако у H. pylori появляется устойчивость к антибиотикам ; многие штаммы, устойчивые к метронидазолу и кларитромицину, встречаются в большинстве регионов мира. [193]
История
Helicobacter pylori мигрировала из Африки вместе со своим хозяином-человеком около 60 000 лет назад. [194] Исследования показали, что генетическое разнообразие H. pylori , как и у его хозяина, уменьшается с географическим расстоянием от Восточной Африки . Используя данные о генетическом разнообразии, исследователи создали симуляции, которые указывают на то, что бактерии, по-видимому, распространились из Восточной Африки около 58 000 лет назад. Их результаты показывают, что современные люди уже были инфицированы H. pylori до их миграции из Африки, и с тех пор она оставалась связанной с хозяевами-людьми. [195]
H. pylori был впервые обнаружен в желудках пациентов с гастритом и язвой в 1982 году Барри Маршаллом и Робином Уорреном из Перта, Западная Австралия . В то время общепринятым было мнение, что ни одна бактерия не может жить в кислой среде человеческого желудка. В знак признания их открытия Маршалл и Уоррен были награждены Нобелевской премией по физиологии и медицине 2005 года . [196]
До исследований Маршалла и Уоррена немецкие ученые обнаружили спиралевидные бактерии в слизистой оболочке человеческого желудка в 1875 году, но они не смогли их культивировать , и результаты были в конечном итоге забыты. [185] Итальянский исследователь Джулио Биццоцеро описал бактерии похожей формы, живущие в кислой среде желудка собак в 1893 году. [197] Профессор Валерий Яворский из Ягеллонского университета в Кракове исследовал осадки желудочных промывных вод, полученных при лаваже у людей в 1899 году. Среди некоторых палочковидных бактерий он также обнаружил бактерии с характерной спиралевидной формой, которые он назвал Vibrio rugula . Он был первым, кто предположил возможную роль этого организма в патогенезе желудочных заболеваний. Его работа была включена в Справочник по желудочным заболеваниям , но она не имела большого влияния, так как была опубликована только на польском языке. [198] Несколько небольших исследований, проведенных в начале 20-го века, продемонстрировали наличие изогнутых стержней в желудках многих людей с язвенной болезнью и раком желудка. [199] Однако интерес к бактериям угас, когда американское исследование, опубликованное в 1954 году, не смогло обнаружить бактерии в 1180 биопсиях желудка. [200]
Интерес к пониманию роли бактерий в заболеваниях желудка возродился в 1970-х годах с визуализацией бактерий в желудках людей с язвой желудка. [201] Бактерии также были обнаружены в 1979 году Робином Уорреном, который исследовал их далее с Барри Маршаллом с 1981 года. После безуспешных попыток культивирования бактерий из желудка им, наконец, удалось визуализировать колонии в 1982 году, когда они непреднамеренно оставили свои чашки Петри инкубироваться в течение пяти дней во время пасхальных выходных. В своей оригинальной статье Уоррен и Маршалл утверждали, что большинство язв желудка и гастритов были вызваны бактериальной инфекцией, а не стрессом или острой пищей , как предполагалось ранее. [202]
Первоначально высказывался некоторый скептицизм, но в течение нескольких лет несколько исследовательских групп подтвердили связь H. pylori с гастритом и, в меньшей степени, язвами. [203] Чтобы продемонстрировать, что H. pylori вызывает гастрит, а не является просто свидетелем, Маршалл выпил стакан культуры H. pylori . Через несколько дней он заболел тошнотой и рвотой. Эндоскопия через 10 дней после инокуляции выявила признаки гастрита и наличие H. pylori . Эти результаты предполагали, что возбудителем является H. pylori . Маршалл и Уоррен продолжили демонстрировать эффективность антибиотиков при лечении многих случаев гастрита. В 1994 году Национальные институты здравоохранения заявили, что большинство рецидивирующих язв двенадцатиперстной кишки и желудка были вызваны H. pylori , и рекомендовали включать антибиотики в схему лечения. [204]
Первоначально бактерия была названа Campylobacter pyloridis , а затем переименована в C. pylori в 1987 году ( pylori — родительный падеж слова pylorus , круглого отверстия, ведущего из желудка в двенадцатиперстную кишку, от древнегреческого слова πυλωρός , что означает привратник [205] ). [206] Когда в 1989 году секвенирование гена рибосомальной РНК 16S и другие исследования показали, что бактерия не принадлежит к роду Campylobacter , ее поместили в собственный род , Helicobacter, от древнегреческого έλιξ ( hělix ) «спираль» или «катушка». [205] [207]
В октябре 1987 года группа экспертов встретилась в Копенгагене, чтобы основать Европейскую группу по изучению Helicobacter (EHSG), международную многопрофильную исследовательскую группу и единственное учреждение, сосредоточенное на H. pylori . [208] Группа участвует в Ежегодном международном семинаре по Helicobacter и родственным бактериям, [209] (переименованном в Европейскую группу по изучению Helicobacter и микробиоты [210] ), Маастрихтском консенсусном докладе (европейский консенсус по управлению H. pylori ), [211] [212] [213] [214] и других образовательных и исследовательских проектах, включая два международных долгосрочных проекта:
- Европейский реестр по лечению H. pylori (Hp-EuReg) – база данных, систематически регистрирующая рутинную клиническую практику европейских гастроэнтерологов. [215]
- Оптимальное лечение H. pylori в первичной медико-санитарной помощи (OptiCare) – долгосрочный образовательный проект, направленный на распространение рекомендаций Маастрихтского консенсуса IV, основанных на фактических данных, среди врачей первичной медико-санитарной помощи в Европе, финансируемый за счет образовательного гранта от Объединенной европейской гастроэнтерологии . [216] [217]
Исследовать
Результаты исследований in vitro показывают, что жирные кислоты , в основном полиненасыщенные жирные кислоты , оказывают бактерицидное действие против H. pylori , но их эффекты in vivo не были доказаны. [218]
Устойчивость к антибиотикам, обеспечиваемая биопленками, побудила провести множество исследований, направленных на изучение механизмов кворумного восприятия, используемых при формировании биопленок. [88]
Подходящая вакцина для H. pylori , профилактическая или терапевтическая, является текущей целью исследований. [8] Детский научно-исследовательский институт Мердока работает над созданием вакцины, которая вместо того, чтобы специально воздействовать на бактерии, будет направлена на подавление вызванного воспаления, которое приводит к связанным с ними заболеваниям. [147]
Желудочные органоиды могут быть использованы в качестве моделей для изучения патогенеза H. pylori . [95]
Смотрите также
Ссылки
- ^ abc Martínez LE, O'Brien VP, Leverich CK, Knoblaugh SE, Salama NR (июль 2019 г.). «Неспиральные мутанты Helicobacter pylori демонстрируют измененную колонизацию желез и вызывают меньшую патологию желудка, чем спиральные бактерии во время хронической инфекции». Infect Immun . 87 (7). doi :10.1128/IAI.00904-18. PMC 6589060. PMID 31061142.
- ^ ab Salama NR (апрель 2020 г.). «Морфология клеток как детерминанта вирулентности: уроки Helicobacter pylori». Curr Opin Microbiol . 54 : 11– 17. doi : 10.1016/j.mib.2019.12.002. PMC 7247928. PMID 32014717 .
- ^ ab Rust M, Schweinitzer T, Josenhans C (2008). "Helicobacter Flagella, Motility and Chemotaxis". В Yamaoka, Y. (ред.).Helicobacter pylori : Молекулярная генетика и клеточная биология . Caister Academic Press. ISBN 978-1-904455-31-8. Архивировано из оригинала 18 августа 2016 . Получено 1 апреля 2008 .
- ^ Уоррен Дж. Р., Маршалл Б. (июнь 1983 г.). «Неопознанные изогнутые бациллы на эпителии желудка при активном хроническом гастрите». Lancet . 1 (8336): 1273– 5. doi :10.1016/S0140-6736(83)92719-8. PMID 6134060. S2CID 1641856.
- ^ ab FitzGerald R, Smith SM (2021). «Обзор инфекции Helicobacter pylori». Helicobacter Pylori . Methods Mol Biol. Vol. 2283. pp. 1– 14. doi :10.1007/978-1-0716-1302-3_1. ISBN 978-1-0716-1301-6. PMID 33765303. S2CID 232365068.
- ^ Уоттс Г. (октябрь 2005 г.). «Нобелевская премия присуждается врачам, открывшим H. pylori». BMJ . 331 (7520): 795. doi :10.1136/bmj.331.7520.795. PMC 1246068 . PMID 16210262.
- ^ ab "Helicobacter pylori (H. pylori) и рак - NCI". www.cancer.gov . 25 сентября 2013 г. Архивировано из оригинала 19 октября 2023 г. Получено 18 октября 2023 г.
- ^ abcde de Brito BB, да Силва Ф.А., Соареш А.С., Перейра В.А., Сантос М.Л., Сампайо М.М. и др. (октябрь 2019 г.). «Патогенез и клиническое лечение желудочной инфекции Helicobacter pylori». Мир Дж Гастроэнтерол . 25 (37): 5578–5589 . doi : 10.3748/wjg.v25.i37.5578 . ПМК 6785516 . ПМИД 31602159.
- ^ Chen CC, Liou JM, Lee YC, Hong TC, El-Omar EM, Wu MS (2021). «Взаимодействие между Helicobacter pylori и желудочно-кишечной микробиотой». Gut Microbes . 13 (1): 1– 22. doi :10.1080/19490976.2021.1909459. PMC 8096336. PMID 33938378 .
- ^ abcd Matsuo Y, Kido Y, Yamaoka Y (март 2017 г.). "Патогенез, связанный с белком наружной мембраны Helicobacter pylori". Токсины . 9 (3): 101. doi : 10.3390/toxins9030101 . PMC 5371856. PMID 28287480 .
- ^ abc Marghalani AM, Bin Salman TO, Faqeeh FJ, Asiri MK, Kabel AM (июнь 2020 г.). «Рак желудка: взгляд на факторы риска, методы диагностики, возможные направления лечения и роль первичной медико-санитарной помощи». J Family Med Prim Care . 9 (6): 2659– 2663. doi : 10.4103/jfmpc.jfmpc_527_20 . PMC 7491774. PMID 32984103 .
- ^ Koga Y (декабрь 2022 г.). «Микробиота желудка и применение пробиотиков при гастродуоденальных заболеваниях». World J Gastroenterol . 28 (47): 6702– 6715. doi : 10.3748/wjg.v28.i47.6702 . PMC 9813937. PMID 36620346.
- ^ ab Shin WS, Xie F, Chen B, Yu J, Lo KW, Tse GM и др. (октябрь 2023 г.). «Изучение микробиома при раке желудка: оценка потенциальных последствий и контекстуализация микроорганизмов, помимо H. pylori и вируса Эпштейна-Барр». Cancers . 15 (20): 4993. doi : 10.3390/cancers15204993 . PMC 10605912 . PMID 37894360.
- ^ abcd Виолета Филип П., Кучуриану Д., Сорина Диакону Л., Мария Владареану А., Сильвия Поп К. (2018). «Лимфома MALT: эпидемиология, клиническая диагностика и лечение». Журнал медицины и жизни . 11 (3): 187– 193. doi : 10.25122 /jml-2018-0035. PMC 6197515. PMID 30364585.
- ^ Ruggiero P (ноябрь 2014 г.). «Использование пробиотиков в борьбе с Helicobacter pylori». World J Gastrointest Pathophysiol . 5 (4): 384–91 . doi : 10.4291 /wjgp.v5.i4.384 . PMC 4231502. PMID 25400981.
- ^ abcd Сантос М.Л., де Бриту Б.Б., да Силва Ф.А., Сампайо М.М., Маркес Х.С., Оливейра Э. и др. (июль 2020 г.). «Инфекция Helicobacter pylori: помимо желудочных проявлений». Мир Дж Гастроэнтерол . 26 (28): 4076–4093 . doi : 10.3748/wjg.v26.i28.4076 . ПМЦ 7403793 . ПМИД 32821071.
- ^ abc Blaser MJ (октябрь 2006 г.). «Кто мы? Местные микробы и экология человеческих заболеваний». EMBO Reports . 7 (10): 956– 60. doi :10.1038/sj.embor.7400812. PMC 1618379. PMID 17016449 .
- ^ Gravina AG, Zagari RM, De Musis C, Romano L, Loguercio C, Romano M (август 2018 г.). «Helicobacter pylori и внежелудочные заболевания: обзор». World Journal of Gastroenterology (обзор). 24 (29): 3204–3221 . doi : 10.3748/wjg.v24.i29.3204 . PMC 6079286. PMID 30090002 .
- ^ Ackerman J (июнь 2012 г.). «Идеальная социальная сеть». Scientific American . Т. 306, № 6. С. 36–43 . doi :10.1038/scientificamerican0612-36. PMID 22649992.
- ^ ab "Helicobacter pylori | CDC Yellow Book 2024". wwwnc.cdc.gov . Архивировано из оригинала 22 октября 2023 г. Получено 20 октября 2023 г.
- ^ ab Li Y, Choi H, Leung K, Jiang F, Graham DY, Leung WK (19 апреля 2023 г.). «Глобальная распространенность инфекции Helicobacter pylori в период с 1980 по 2022 год: систематический обзор и метаанализ». The Lancet Gastroenterology & Hepatology . 8 (6): 553– 564. doi :10.1016/S2468-1253(23)00070-5. PMID 37086739. S2CID 258272798.
- ^ Hooi JK, Lai WY, Ng WK, Suen MM, Underwood FE, Tanyingoh D и др. (август 2017 г.). «Глобальная распространенность инфекции Helicobacter pylori: систематический обзор и метаанализ». Гастроэнтерология . 153 (2): 420–429 . doi : 10.1053/j.gastro.2017.04.022 . PMID 28456631.
- ^ Goodwin CS, Armstrong JA, Chilvers T и др. (1989). «Передача Campylobacter pylori и Campylobacter mustelae в Helicobacter gen. nov. как Helicobacter pylori comb. nov. и Helicobacter mustelae comb. nov., соответственно». Int. J. Syst. Bacteriol . 39 (4): 397– 405. doi : 10.1099/00207713-39-4-397 .
- ^ ab Martínez LE, Hardcastle JM, Wang J, Pincus Z, Tsang J, Hoover TR и др. (январь 2016 г.). «Штамм Helicobacter pylori изменяет форму клеток и количество жгутиков для поддержания устойчивой подвижности в вязких средах». Mol Microbiol . 99 (1): 88– 110. doi :10.1111/mmi.13218. PMC 4857613 . PMID 26365708.
- ^ O'Rourke J, Bode G (2001). Морфология и ультраструктура. ASM Press. ISBN 978-1-55581-213-3. PMID 21290748.
- ^ ab Kao CY, Sheu BS, Wu JJ (февраль 2016 г.). «Инфекция Helicobacter pylori: обзор факторов бактериальной вирулентности и патогенеза». Biomedical Journal . 39 (1): 14– 23. doi :10.1016/j.bj.2015.06.002. PMC 6138426 . PMID 27105595.
- ^ Иерарди Э., Лосурдо Г., Милети А., Паолильо Р., Джорджио Ф., Принципи М. и др. (май 2020 г.). «Загадка коккоидных форм Helicobacter pylori: за пределами фундаментальной науки». Антибиотики . 9 (6): 293. doi : 10.3390/antibiotics9060293 . ПМЦ 7345126 . ПМИД 32486473.
- ^ Luo Q, Liu N, Pu S, Zhuang Z, Gong H, Zhang D (2023). «Обзор хода исследований немедикаментозной терапии Helicobacter pylori». Front Microbiol . 14 : 1134254. doi : 10.3389/fmicb.2023.1134254 . PMC 10063898. PMID 37007498 .
- ^ Olson JW, Maier RJ (ноябрь 2002 г.). «Молекулярный водород как источник энергии для Helicobacter pylori». Science . 298 (5599): 1788– 90. Bibcode :2002Sci...298.1788O. doi :10.1126/science.1077123. PMID 12459589. S2CID 27205768.
- ^ abc Baj J, Forma A, Sitarz M, Portincasa P, Garruti G, Krasowska D и др. (декабрь 2020 г.). "Факторы вирулентности Helicobacter pylori — механизмы патогенности бактерий в желудочной микросреде". Cells . 10 (1): 27. doi : 10.3390/cells10010027 . PMC 7824444 . PMID 33375694.
- ^ Elshenawi Y, Hu S, Hathroubi S (июль 2023 г.). «Биопленка Helicobacter pylori: жизненный цикл, особенности и варианты лечения». Антибиотики . 12 (8): 1260. doi : 10.3390/antibiotics12081260 . PMC 10451559. PMID 37627679 .
- ^ abcdefghij Kusters JG, ван Влит AH, Kuipers EJ (июль 2006 г.). «Патогенез инфекции Helicobacter pylori». Обзоры клинической микробиологии . 19 (3): 449–90 . doi :10.1128/CMR.00054-05. ПМЦ 1539101 . ПМИД 16847081.
- ^ ab Alzahrani S, Lina TT, Gonzalez J, Pinchuk IV, Beswick EJ, Reyes VE (сентябрь 2014 г.). «Влияние Helicobacter pylori на эпителиальные клетки желудка». World J Gastroenterol . 20 (36): 12767– 80. doi : 10.3748/wjg.v20.i36.12767 . PMC 4177462. PMID 25278677 .
- ^ "Genome information for the H. pylori 26695 and J99 strains". Institut Pasteur. 2002. Архивировано из оригинала 26 ноября 2017 года . Получено 1 сентября 2008 года .
- ^ "Helicobacter pylori J99, полный геном". Национальный центр биотехнологической информации. Архивировано из оригинала 6 апреля 2011 года . Получено 1 сентября 2008 года .
- ^ Oh JD, Kling-Bäckhed H, Giannakis M, Xu J, Fulton RS, Fulton LA и др. (июнь 2006 г.). «Полная последовательность генома штамма Helicobacter pylori при хроническом атрофическом гастрите: эволюция во время прогрессирования заболевания». Труды Национальной академии наук Соединенных Штатов Америки . 103 (26): 9999– 10004. Bibcode : 2006PNAS..103.9999O. doi : 10.1073/pnas.0603784103 . PMC 1480403. PMID 16788065 .
- ^ "Сборка генома Helicobacter pylori 26695 ASM30779v1". NCBI . Получено 4 июня 2024 г. .
- ^ abcd Tomb JF, White O, Kerlavage AR, Clayton RA, Sutton GG, Fleischmann RD и др. (август 1997 г.). «Полная последовательность генома желудочного патогена Helicobacter pylori». Nature . 388 (6642): 539– 47. Bibcode :1997Natur.388..539T. doi : 10.1038/41483 . PMID 9252185. S2CID 4411220.
- ^ van Vliet AH (январь 2017 г.). «Использование пангеномного анализа для идентификации генов Helicobacter pylori, специфичных для определенной линии». FEMS Microbiology Letters . 364 (2): fnw296. doi : 10.1093/femsle/fnw296 . PMID 28011701.
- ^ Uchiyama I, Albritton J, Fukuyo M, Kojima KK, Yahara K, Kobayashi I (9 августа 2016 г.). «Новый подход к пангеномному анализу Helicobacter pylori для идентификации геномных островов». PLOS ONE . 11 (8): e0159419. Bibcode : 2016PLoSO..1159419U. doi : 10.1371/journal.pone.0159419 . PMC 4978471. PMID 27504980 .
- ^ abc Sharma CM, Hoffmann S, Darfeuille F, Reignier J, Findeiss S, Sittka A и др. (март 2010 г.). «Первичный транскриптом основного человеческого патогена Helicobacter pylori». Nature . 464 (7286): 250– 5. Bibcode :2010Natur.464..250S. doi :10.1038/nature08756. PMID 20164839. S2CID 205219639.
- ^ Müller SA, Pernitzsch SR, Haange SB, Uetz P, von Bergen M, Sharma CM и др. (3 августа 2015 г.). «Стабильная изотопная маркировка аминокислотами в протеомике на основе клеточной культуры выявляет различия в содержании белков между спиральными и кокковидными формами желудочного патогена Helicobacter pylori». Journal of Proteomics . 126 : 34–45 . doi :10.1016/j.jprot.2015.05.011. ISSN 1874-3919. PMID 25979772. S2CID 415255. Архивировано из оригинала 27 июля 2021 г. . Получено 26 июля 2021 г. .
- ^ Wuchty S, Müller SA, Caufield JH, Häuser R, Aloy P, Kalkhof S, et al. (Май 2018). «Протеомные данные улучшают прогнозирование функции белка в интерактоме Helicobacter pylori». Mol Cell Proteomics . 17 (5): 961– 973. doi : 10.1074/mcp.RA117.000474 . PMC 5930399 . PMID 29414760.
- ^ abc Malfertheiner P, Megraud F, Rokkas T, Gisbert JP, Liou JM, Schulz C и др. (август 2022 г.). «Лечение инфекции Helicobacter pylori: консенсусный отчет Маастрихт VI/Флоренция». Gut . 71 (9): 1724– 1762. doi :10.1136/gutjnl-2022-327745. hdl : 10486/714546 . PMID 35944925.
- ^ ab "ICD-11 for Mortality and Morbidity Statistics". icd.who.int . Архивировано из оригинала 15 октября 2023 г. Получено 9 января 2024 г.
- ^ abcde "Изменения, внесенные в новый экспертный консенсус по H. pylori". Medscape . Архивировано из оригинала 9 января 2024 г. Получено 9 января 2024 г.
- ^ Repetto O, Vettori R, Steffan A, Cannizzaro R, De Re V (ноябрь 2023 г.). «Циркулирующие белки как диагностические маркеры рака желудка». Int J Mol Sci . 24 (23): 16931. doi : 10.3390/ijms242316931 . PMC 10706891. PMID 38069253 .
- ^ Ливзан МА, Мозговой СИ, Гаус О.В., Шиманская АГ, Кононов АВ (июль 2023 г.). "Гистопатологическая оценка атрофии слизистой оболочки желудка для прогнозирования риска рака желудка: проблемы и решения". Диагностика . 13 (15): 2478. doi : 10.3390/diagnostics13152478 . PMC 10417051. PMID 37568841 .
- ^ Dixon MF (февраль 2000 г.). «Модели воспаления, связанные с язвенной болезнью». Baillière's Best Practice & Research. Клиническая гастроэнтерология . 14 (1): 27– 40. doi :10.1053/bega.1999.0057. PMID 10749087.
- ^ Моммерстег MC, Ю Б.Т., ван ден Бош Т.П., фон дер Тюзен Дж.Х., Койперс Э.Дж., Дукас М. и др. (октябрь 2022 г.). «Конститутивная экспрессия лиганда запрограммированной смерти 1 защищает G-клетки желудка от воспаления, вызванного Helicobacter pylori». Хеликобактер . 27 (5): e12917. дои : 10.1111/hel.12917. ПМЦ 9542424 . PMID 35899973. S2CID 251132578.
- ^ ab Blaser MJ, Atherton JC (февраль 2004 г.). «Персистенция Helicobacter pylori: биология и болезнь». Журнал клинических исследований . 113 (3): 321– 33. doi : 10.1172/JCI20925. PMC 324548. PMID 14755326 .
- ^ Schubert ML, Peura DA (июнь 2008 г.). «Контроль секреции желудочной кислоты в норме и при заболеваниях». Гастроэнтерология . 134 (7): 1842– 60. doi :10.1053/j.gastro.2008.05.021. PMID 18474247. S2CID 206210451.
- ^ Аббас Х., Ниази М., Маккер Дж. (май 2017 г.). «Лимфома, ассоциированная со слизистой оболочкой (MALT) толстой кишки: отчет о случае и обзор литературы». Американский журнал отчетов о случаях . 18 : 491–497 . doi :10.12659/AJCR.902843. PMC 5424574. PMID 28469125 .
- ^ ab Paydas S (апрель 2015 г.). «Эрадикация Helicobacter pylori при диффузной крупноклеточной лимфоме желудка». World Journal of Gastroenterology . 21 (13): 3773– 6. doi : 10.3748/wjg.v21.i13.3773 . PMC 4385524. PMID 25852262.
- ^ Kuipers EJ (март 1999). «Обзорная статья: изучение связи между Helicobacter pylori и раком желудка». Alimentary Pharmacology & Therapeutics . 13 (Suppl 1): 3– 11. doi :10.1046/j.1365-2036.1999.00002.x. PMID 10209681. S2CID 19231673.
- ^ Ferlay J, Colombet M, Soerjomataram I, Mathers C, Parkin DM, Piñeros M и др. (апрель 2019 г.). «Оценка глобальной заболеваемости раком и смертности в 2018 г.: источники и методы GLOBOCAN». International Journal of Cancer . 144 (8): 1941–1953 . doi : 10.1002/ijc.31937 . PMID 30350310.
- ^ Дэн JY, Лян H (апрель 2014 г.). «Клиническое значение метастазов в лимфатические узлы при раке желудка». World Journal of Gastroenterology . 20 (14): 3967–75 . doi : 10.3748/wjg.v20.i14.3967 . PMC 3983452. PMID 24744586 .
- ^ ab Valenzuela MA, Canales J, Corvalán AH, Quest AF (декабрь 2015 г.). «Helicobacter pylori-индуцированное воспаление и эпигенетические изменения во время желудочного канцерогенеза». World Journal of Gastroenterology . 21 (45): 12742– 56. doi : 10.3748/wjg.v21.i45.12742 . PMC 4671030. PMID 26668499.
- ^ ab Raza Y, Khan A, Farooqui A, Mubarak M, Facista A, Akhtar SS и др. (октябрь 2014 г.). «Окислительное повреждение ДНК как потенциальный ранний биомаркер канцерогенеза, связанного с Helicobacter pylori». Pathology & Oncology Research . 20 (4): 839– 46. doi : 10.1007/s12253-014-9762-1. PMID 24664859. S2CID 18727504.
- ^ Koeppel M, Garcia-Alcalde F, Glowinski F, Schlaermann P, Meyer TF (июнь 2015 г.). «Инфекция Helicobacter pylori вызывает характерные паттерны повреждения ДНК в клетках человека». Cell Reports . 11 (11): 1703– 13. doi : 10.1016/j.celrep.2015.05.030 . PMID 26074077.
- ^ abcd Markowski AR, Markowska A, Guzinska-Ustymowicz K (октябрь 2016 г.). «Патофизиологические и клинические аспекты гиперпластических полипов желудка». World Journal of Gastroenterology . 22 (40): 8883– 8891. doi : 10.3748 /wjg.v22.i40.8883 . PMC 5083793. PMID 27833379.
- ^ Dong YF, Guo T, Yang H, Qian JM, Li JN (февраль 2019 г.). «[Корреляция между желудочной инфекцией Helicobacter pylori и колоректальными полипами или раком]». Zhonghua Nei Ke Za Zhi (на китайском языке). 58 (2): 139– 142. doi :10.3760/cma.j.issn.0578-1426.2019.02.011. PMID 30704201.
- ^ ab Zuo Y, Jing Z, Bie M, Xu C, Hao X, Wang B (сентябрь 2020 г.). «Связь между инфекцией Helicobacter pylori и риском колоректального рака: систематический обзор и метаанализ». Medicine (Балтимор) . 99 (37): e21832. doi :10.1097/MD.0000000000021832. PMC 7489651. PMID 32925719 .
- ^ Папастергиу В., Каратапанис С., Георгопулос С.Д. (январь 2016 г.). «Helicobacter pylori и колоректальная неоплазия: есть ли причинно-следственная связь?». World J Gastroenterol . 22 (2): 649–58 . doi : 10.3748/wjg.v22.i2.649 . PMC 4716066. PMID 26811614 .
- ^ abc Debowski AW, Walton SM, Chua EG, Tay AC, Liao T, Lamichhane B и др. (июнь 2017 г.). «Подавление гена Helicobacter pylori in vivo демонстрирует, что уреаза необходима для хронической инфекции». PLOS Pathogens . 13 (6): e1006464. doi : 10.1371/journal.ppat.1006464 . PMC 5500380. PMID 28644872 .
- ^ Al Quraan AM, Beriwal N, Sangay P, Namgyal T (октябрь 2019 г.). «Психотическое воздействие гастрита Helicobacter pylori и функциональной диспепсии на депрессию: систематический обзор». Cureus . 11 (10): e5956. doi : 10.7759/cureus.5956 . PMC 6863582 . PMID 31799095.
- ^ ab "Тесты на Helicobacter Pylori (H. Pylori): медицинский тест MedlinePlus". medlineplus.gov . Архивировано из оригинала 16 февраля 2024 г. . Получено 16 февраля 2024 г. .
- ^ ab "Симптомы и причины пептических язв (язвы желудка или двенадцатиперстной кишки) - NIDDK". Национальный институт диабета, болезней пищеварения и почек . Архивировано из оригинала 17 февраля 2024 года . Получено 17 февраля 2024 года .
- ^ Popa DG, Obleagă CV, Socea B, Serban D, Ciurea ME, Diaconescu M и др. (октябрь 2021 г.). «Роль Helicobacter pylori в возникновении и развитии геморрагических гастродуоденальных поражений». Exp Ther Med . 22 (4): 1147. doi :10.3892/etm.2021.10582. PMC 8392874. PMID 34504592 .
- ^ Аль-Азри М, Аль-Кинди Дж, Аль-Харти Т, Аль-Дахри М, Панчатчарам СМ, Аль-Манири А (июнь 2019 г.). «Осведомленность о факторах риска рака желудка и колоректального рака, симптомах и времени, затраченном на обращение за медицинской помощью среди населения, посещающего первичную медицинскую помощь в мухафазе Маскат, Оман». Журнал онкологического образования . 34 (3): 423– 434. doi :10.1007/s13187-017-1266-8. ISSN 0885-8195. PMID 28782080. S2CID 4017466. Архивировано из оригинала 24 февраля 2024 г. Получено 20 января 2024 г.
- ^ Wu Q, Yang ZP, Xu P, Gao LC, Fan DM (июль 2013 г.). «Связь между инфекцией Helicobacter pylori и риском колоректальной неоплазии: систематический обзор и метаанализ». Колоректальные заболевания . 15 (7): e352-64. doi :10.1111/codi.12284. PMID 23672575. S2CID 5444584.
- ^ Soetikno RM, Kaltenbach T, Rouse RV, Park W, Maheshwari A, Sato T и др. (март 2008 г.). «Распространенность неполиповидных (плоских и вдавленных) колоректальных новообразований у бессимптомных и симптоматических взрослых». JAMA . 299 (9): 1027–35 . doi : 10.1001/jama.299.9.1027 . PMID 18319413.
- ^ аб Ямаока Ю., Саруулджавхлан Б., Альфарай Р.И., Линц Б. (2023). «Патогеномика Helicobacter pylori». Хеликобактер пилори и рак желудка . Актуальные темы микробиологии и иммунологии. Том. 444. С. 117–155 . doi : 10.1007/978-3-031-47331-9_5. ISBN 978-3-031-47330-2. PMID 38231217.
- ^ Альфарук К.О., Башир А.Х., Альжарбу А.Н., Рамадан А.М., Муддатир А.К., АльХуфи С.Т. и др. (22 февраля 2019 г.). «Helicobacter pylori при раке желудка и его лечении». Границы онкологии . 9:75 . doi : 10.3389/fonc.2019.00075 . ПМК 6395443 . ПМИД 30854333.
- ^ Santos JC, Ribeiro ML (август 2015 г.). «Эпигенетическая регуляция механизмов репарации ДНК при желудочном канцерогенезе, вызванном Helicobacter pylori». World Journal of Gastroenterology . 21 (30): 9021–37 . doi : 10.3748/wjg.v21.i30.9021 . PMC 4533035. PMID 26290630 .
- ^ Raza Y, Ahmed A, Khan A, Chishti AA, Akhter SS, Mubarak M и др. (май 2020 г.). «Helicobacter pylori значительно снижает экспрессию белков репарации ДНК PMS2 и ERCC1 при гастрите и раке желудка». DNA Repair . 89 : 102836. doi : 10.1016/j.dnarep.2020.102836 . PMID 32143126.
- ^ Доре МП, Пес ГМ, Бассотти Г, Усаи-Сатта П (2016). «Диспепсия: когда и как проводить тест на инфекцию Helicobacter pylori». Гастроэнтерологические исследования и практика . 2016 : 8463614. doi : 10.1155/2016/8463614 . PMC 4864555. PMID 27239194 .
- ^ ab Мухаммад Дж. С., Эладл МА, Ходер Г. (февраль 2019 г.). «Метилирование ДНК, вызванное Helicobacter pylori, как эпигенетический модулятор рака желудка: последние результаты и будущее направление». Патогены . 8 ( 1): 23. doi : 10.3390/pathogens8010023 . PMC 6471032. PMID 30781778.
- ^ ab Noto JM, Peek RM (2011). "Роль микроРНК в патогенезе Helicobacter pylori и канцерогенезе желудка". Frontiers in Cellular and Infection Microbiology . 1 : 21. doi : 10.3389/fcimb.2011.00021 . PMC 3417373. PMID 22919587.
- ^ Tsuji S, Kawai N, Tsujii M, Kawano S, Hori M (июль 2003 г.). «Обзорная статья: связанное с воспалением содействие желудочно-кишечному канцерогенезу — перигенетический путь». Alimentary Pharmacology & Therapeutics . 18 (Suppl 1): 82– 9. doi : 10.1046/j.1365-2036.18.s1.22.x . PMID 12925144. S2CID 22646916.
- ^ Yu B, de Vos D, Guo X, Peng S, Xie W, Peppelenbosch MP и др. (апрель 2024 г.). «IL-6 способствует перекрестному взаимодействию между эпителиальными клетками и макрофагами, ассоциированными с опухолью, при канцерогенезе желудка, связанном с Helicobacter pylori». Neoplasia . 50 : 100981. doi : 10.1016/j.neo.2024.100981 . PMC 10912637 . PMID 38422751.
- ^ ab Suganuma M, Yamaguchi K, Ono Y, Matsumoto H, Hayashi T, Ogawa T и др. (июль 2008 г.). «ФНО-альфа-индуцирующий белок, канцерогенный фактор, секретируемый H. pylori, проникает в клетки рака желудка». International Journal of Cancer . 123 (1): 117– 22. doi : 10.1002/ijc.23484 . PMID 18412243. S2CID 5532769.
- ^ Duan Q, Zhou M, Zhu L, Zhu G (январь 2013 г.). «Жгутики и патогенность бактерий». J Basic Microbiol . 53 (1): 1– 8. doi :10.1002/jobm.201100335. PMID 22359233. S2CID 22002199.
- ^ abc Nedeljković M, Sastre DE, Sundberg EJ (июль 2021 г.). «Бактериальная жгутиковая нить: супрамолекулярная многофункциональная наноструктура». Int J Mol Sci . 22 (14): 7521. doi : 10.3390/ijms22147521 . PMC 8306008. PMID 34299141 .
- ^ Elbehiry A, Marzouk E, Aldubaib M, Abalkhail A, Anagreyyah S, Anajirih N и др. (январь 2023 г.). «Инфекция Helicobacter pylori: текущее состояние и будущие перспективы диагностики, терапии и контроля». Антибиотики . 12 (2): 191. doi : 10.3390/antibiotics12020191 . PMC 9952126. PMID 36830102 .
- ^ Petersen AM, Krogfelt KA (май 2003 г.). «Helicobacter pylori: вторгающийся микроорганизм? Обзор». FEMS Immunology and Medical Microbiology (Обзор). 36 (3): 117–26 . doi : 10.1016/S0928-8244(03)00020-8 . PMID 12738380.
- ^ Али А, Аль-Хуссаини КИ (январь 2024 г.). «Helicobacter pylori: современный взгляд на патогенез, диагностику и стратегии лечения». Микроорганизмы . 12 (1): 222. doi : 10.3390/microorganisms12010222 . PMC 10818838. PMID 38276207 .
- ^ ab Zafer MM, Mohamed GA, Ibrahim SR, Ghosh S, Bornman C, Elfaky MA (февраль 2024 г.). «Инфекции, опосредованные биопленкой, вызванные микробами с множественной лекарственной устойчивостью: всестороннее исследование и перспективы». Arch Microbiol . 206 (3): 101. Bibcode : 2024ArMic.206..101Z. doi : 10.1007/s00203-023-03826-z. PMC 10867068. PMID 38353831.
- ^ ab Sun Q, Yuan C, Zhou S, Lu J, Zeng M, Cai X и др. (2023). «Инфекция Helicobacter pylori: динамический процесс от диагностики до лечения». Front Cell Infect Microbiol . 13 : 1257817. doi : 10.3389/fcimb.2023.1257817 . PMC 10621068. PMID 37928189 .
- ^ abcdef Lin Q, Lin S, Fan Z, Liu J, Ye D, Guo P (май 2024 г.). «Обзор механизмов бактериальной колонизации кишечника млекопитающих». Микроорганизмы . 12 (5): 1026. doi : 10.3390/microorganisms12051026 . PMC 11124445. PMID 38792855 .
- ^ abc Hernández VM, Arteaga A, Dunn MF (ноябрь 2021 г.). «Разнообразие, свойства и функции бактериальных аргиназ». FEMS Microbiol Rev. 45 ( 6). doi :10.1093/femsre/fuab034. PMID 34160574.
- ^ ab Li S, Zhao W, Xia L, Kong L, Yang L (2023). «Сколько времени потребуется, чтобы запустить эффективную вакцину против Helicobacter pylori для людей?». Infect Drug Resist . 16 : 3787–3805 . doi : 10.2147/IDR.S412361 . PMC 10278649. PMID 37342435 .
- ^ Джордж Г, Комбрабайл М, Ранинга Н, Сау АК (март 2017 г.). «Аргиназа возбудителей желудочно-кишечных заболеваний Helicobacter использует уникальный набор некаталитических остатков для катализа». Biophysical Journal . 112 (6): 1120– 1134. Bibcode :2017BpJ...112.1120G. doi :10.1016/j.bpj.2017.02.009. PMC 5376119 . PMID 28355540.
- ^ Smoot DT (декабрь 1997 г.). «Как Helicobacter pylori вызывает повреждение слизистой оболочки? Прямые механизмы». Гастроэнтерология . 113 (6 Suppl): S31-4, обсуждение S50. doi : 10.1016/S0016-5085(97)80008-X . PMID 9394757.
- ^ abc Doohan D, Rezkitha YA, Waskito LA, Yamaoka Y, Miftahussurur M (июль 2021 г.). "Helicobacter pylori BabA-SabA Key Roles in the Adherence Phase: The Synergic Mechanism for Successful Colonization and Disease Development". Токсины . 13 (7): 485. doi : 10.3390/toxins13070485 . PMC 8310295. PMID 34357957 .
- ^ Рад Р., Герхард М., Ланг Р., Шёнигер М., Рёш Т., Шепп В. и др. (15 марта 2002 г.). «Адгезин, связывающий антиген группы крови Helicobacter pylori, облегчает бактериальную колонизацию и усиливает неспецифический иммунный ответ». Журнал иммунологии . 168 (6): 3033–3041 . doi : 10.4049/jimmunol.168.6.3033 . PMID 11884476.
- ^ Bugaytsova JA, Björnham O, Chernov YA, Gideonsson P, Henriksson S, Mendez M и др. (март 2017 г.). «Helicobacter pylori адаптируется к хронической инфекции и желудочному заболеванию с помощью pH-чувствительной BabA-опосредованной адгезии». Cell Host & Microbe . 21 (3): 376– 389. doi :10.1016/j.chom.2017.02.013. PMC 5392239 . PMID 28279347.
- ^ Махдави Дж., Соден Б., Хуртиг М., Ольфат Ф.О., Форсберг Л., Рош Н. и др. (июль 2002 г.). «Адгезин SabA Helicobacter pylori при персистирующей инфекции и хроническом воспалении». Наука . 297 (5581): 573–8 . Бибкод : 2002Sci...297..573M. дои : 10.1126/science.1069076. ПМК 2570540 . ПМИД 12142529.
- ^ abc Testerman TL, Morris J (сентябрь 2014 г.). «За пределами желудка: обновленный взгляд на патогенез, диагностику и лечение Helicobacter pylori». World Journal of Gastroenterology (обзор). 20 (36): 12781– 808. doi : 10.3748/wjg.v20.i36.12781 . PMC 4177463 . PMID 25278678.
- ^ Zhang L, Xie J (сентябрь 2023 г.). «Биосинтез, структура и биологическая функция глюкозида холестерина в Helicobacter pylori: обзор». Medicine (Балтимор) . 102 (36): e34911. doi :10.1097/MD.0000000000034911. PMC 10489377. PMID 37682174 .
- ^ Ridyard KE, Overhage J (май 2021 г.). «Потенциал человеческого пептида LL-37 как противомикробного и противобиопленочного агента». Антибиотики . 10 (6): 650. doi : 10.3390/antibiotics10060650 . PMC 8227053. PMID 34072318 .
- ^ ab Hsu CY, Yeh JY, Chen CY, Wu HY, Chiang MH, Wu CL и др. (декабрь 2021 г.). «Холестерино-α-глюкозилтрансфераза Helicobacter pylori манипулирует холестерином для бактериальной адгезии к эпителиальным клеткам желудка». Вирулентность . 12 ( 1): 2341– 2351. doi :10.1080/21505594.2021.1969171. PMC 8437457. PMID 34506250.
- ^ Morey P, Pfannkuch L, Pang E, Boccellato F, Sigal M, Imai-Matsushima A и др. (апрель 2018 г.). «Helicobacter pylori снижает уровень холестерина в желудочных железах, предотвращая передачу сигналов интерферона гамма и избегая воспалительной реакции». Гастроэнтерология . 154 (5): 1391–1404.e9. doi : 10.1053/j.gastro.2017.12.008. hdl : 21.11116/0000-0001-3B12-9 . PMID 29273450.
- ^ ab Ramarao N, Gray-Owen SD, Meyer TF (октябрь 2000 г.). «Helicobacter pylori вызывает, но выживает при внеклеточном высвобождении радикалов кислорода из профессиональных фагоцитов, используя свою каталазную активность». Mol Microbiol . 38 (1): 103– 13. doi :10.1046/j.1365-2958.2000.02114.x. hdl : 11858/00-001M-0000-000E-C7AD-8 . PMID 11029693.
- ^ "UniProt". www.uniprot.org . Получено 20 марта 2024 г. .
- ^ "ФНО-альфа индуцирующий белок". www.uniprot.org . Получено 8 апреля 2024 г. .
- ^ Watanabe T, Takahashi A, Suzuki K, Kurusu-Kanno M, Yamaguchi K, Fujiki H и др. (15 мая 2014 г.). «Эпителиально-мезенхимальный переход в клеточных линиях рака желудка человека, индуцированный индуцирующим белком TNF-α Helicobacter pylori: миграция клеток, индуцированная Tipα H. pylori». International Journal of Cancer . 134 (10): 2373– 2382. doi :10.1002/ijc.28582. PMID 24249671.
- ^ Wallden K, Rivera-Calzada A, Waksman G (сентябрь 2010 г.). «Системы секреции типа IV: универсальность и разнообразие функций». Cell Microbiol . 12 (9): 1203– 12. doi :10.1111/j.1462-5822.2010.01499.x. PMC 3070162. PMID 20642798 .
- ^ ab Broutet N, Marais A, Lamouliatte H, de Mascarel A, Samoyeau R, Salamon R и др. (апрель 2001 г.). "cagA-статус и результаты эрадикационной терапии тройной терапией против Helicobacter pylori у пациентов с неязвенной диспепсией". Журнал клинической микробиологии . 39 (4): 1319– 22. doi : 10.1128 /JCM.39.4.1319-1322.2001. PMC 87932. PMID 11283049.
- ^ Завилак-Павлик А., Зажецка У., Жила-Уклеевич Д., Лах Дж., Страпагель Д., Тегтмейер Н. и др. (август 2019 г.). «Появление мутантов сериновой протеазы htrA у Helicobacter pylori связано с мутациями secA». Научные отчеты . 9 (1): 11794. Бибкод : 2019NatSR...911794Z. дои : 10.1038/s41598-019-48030-6. ПМК 6692382 . ПМИД 31409845.
- ^ Peek RM, Crabtree JE (январь 2006 г.). «Инфекция Helicobacter и неоплазия желудка». Журнал патологии . 208 (2): 233–48 . doi : 10.1002/path.1868 . PMID 16362989. S2CID 31718278.
- ^ Viala J, Chaput C, Boneca IG, Cardona A, Girardin SE, Moran AP и др. (ноябрь 2004 г.). «Nod1 реагирует на пептидогликан, доставляемый островом патогенности Helicobacter pylori cag». Nature Immunology . 5 (11): 1166–74 . doi :10.1038/ni1131. PMID 15489856. S2CID 2898805.
- ^ Backert S, Selbach M (август 2008). «Роль секреции типа IV в патогенезе Helicobacter pylori». Cellular Microbiology . 10 (8): 1573– 81. doi : 10.1111/j.1462-5822.2008.01156.x . PMID 18410539. S2CID 37626.
- ^ Хатакеяма М (сентябрь 2004 г.). «Онкогенные механизмы белка CagA Helicobacter pylori». Nature Reviews. Cancer . 4 (9): 688–94 . doi :10.1038/nrc1433. PMID 15343275. S2CID 1218835.
- ^ Ким В., Мосс С.Ф. (2008). «Роль Helicobacter pylori в патогенезе злокачественных новообразований желудка». Oncology Reviews . 2 (3): 131– 140. doi :10.1007/s12156-008-0068-y.
- ^ "UniProt". www.uniprot.org . Получено 21 марта 2024 г. .
- ^ Miehlke S, Yu J, Schuppler M, Frings C, Kirsch C, Negraszus N, et al. (апрель 2001 г.). «Статус Helicobacter pylori vacA, iceA и cagA и характер гастрита у пациентов со злокачественными и доброкачественными гастродуоденальными заболеваниями». The American Journal of Gastroenterology . 96 (4): 1008– 13. doi : 10.1111/j.1572-0241.2001.03685.x. PMID 11316139. S2CID 24024542. Архивировано из оригинала 23 февраля 2022 г. Получено 24 июня 2020 г.
- ^ ab Hisatsune J, Yamasaki E, Nakayama M, Shirasaka D, Kurazono H, Katagata Y и др. (сентябрь 2007 г.). "Helicobacter pylori VacA усиливает выработку простагландина E2 посредством индукции экспрессии циклооксигеназы 2 посредством каскада митоген-активируемой протеинкиназы p38/активирующего фактора транскрипции 2 в клетках AZ-521". Infect Immun . 75 (9): 4472– 81. doi :10.1128/IAI.00500-07. PMC 1951161. PMID 17591797 .
- ^ Capurro MI, Greenfield LK, Prashar A, Xia S, Abdullah M, Wong H и др. (август 2019 г.). «VacA создает защитный внутриклеточный резервуар для Helicobacter pylori, который устраняется активацией лизосомального кальциевого канала TRPML1». Nature Microbiology . 4 (8): 1411– 1423. doi :10.1038/s41564-019-0441-6. PMC 6938649 . PMID 31110360.
- ^ Sajib S, Zahra FT, Lionakis MS, German NA, Mikelis CM (февраль 2018 г.). «Механизмы ангиогенеза при воспалительных и неопластических состояниях, регулируемых микробами». Angiogenesis . 21 (1): 1– 14. doi :10.1007/s10456-017-9583-4. PMID 29110215. S2CID 3346742.
- ^ da Costa DM, Pereira Edos S, Rabenhorst SH (октябрь 2015 г.). «Что существует за пределами cagA и vacA? Гены Helicobacter pylori при желудочных заболеваниях». World J Gastroenterol . 21 (37): 10563–72 . doi : 10.3748/wjg.v21.i37.10563 . PMC 4588078. PMID 26457016 .
- ^ Dumrese C, Slomianka L, Ziegler U, Choi SS, Kalia A, Fulurija A и др. (май 2009 г.). «Секретируемый хеликобактерный цистеин-богатый белок A вызывает адгезию человеческих моноцитов и дифференциацию в макрофагоподобный фенотип». FEBS Letters . 583 (10): 1637– 43. Bibcode : 2009FEBSL.583.1637D. doi : 10.1016/j.febslet.2009.04.027. PMC 2764743. PMID 19393649 .
- ^ Alam J, Sarkar A, Karmakar BC, Ganguly M, Paul S, Mukhopadhyay AK (август 2020 г.). «Новый фактор вирулентности dupA Helicobacter pylori как важный фактор риска проявления заболевания: обзор». World J Gastroenterol . 26 (32): 4739– 4752. doi : 10.3748/wjg.v26.i32.4739 . PMC 7459207. PMID 32921954 .
- ^ abcd Трастой Р., Мансо Т., Фернандес-Гарсиа Л., Бласко Л., Амброа А., Перес Дель Молино М.Л. и др. (октябрь 2018 г.). «Механизмы толерантности и устойчивости бактерий в желудочно-кишечной и респираторной среде». Клин Микробиол Ред . 31 (4). дои : 10.1128/CMR.00023-18. ПМК 6148185 . ПМИД 30068737.
- ^ Olczak AA, Olson JW, Maier RJ (июнь 2002 г.). «Мутанты устойчивости к окислительному стрессу Helicobacter pylori». Журнал бактериологии . 184 (12): 3186–93 . doi : 10.1128 /JB.184.12.3186-3193.2002. PMC 135082. PMID 12029034.
- ^ abcd Dorer MS, Fero J, Salama NR (июль 2010 г.). Blanke SR (ред.). «Повреждение ДНК запускает генетический обмен у Helicobacter pylori». PLOS Pathogens . 6 (7): e1001026. doi : 10.1371/journal.ppat.1001026 . PMC 2912397. PMID 20686662 .
- ^ O'Rourke EJ, Chevalier C, Pinto AV, Thiberge JM, Ielpi L, Labigne A и др. (март 2003 г.). «Патогенная ДНК как мишень для окислительного стресса, создаваемого хозяином: роль в восстановлении повреждений бактериальной ДНК при колонизации Helicobacter pylori». Труды Национальной академии наук Соединенных Штатов Америки . 100 (5): 2789– 94. Bibcode : 2003PNAS..100.2789O . doi : 10.1073/pnas.0337641100 . PMC 151419. PMID 12601164.
- ^ Michod RE, Bernstein H, Nedelcu AM (май 2008). «Адаптивное значение пола у микробных патогенов». Инфекция, генетика и эволюция . 8 (3): 267– 85. Bibcode :2008InfGE...8..267M. doi :10.1016/j.meegid.2008.01.002. PMID 18295550.
- ^ Ailloud F, Didelot X, Woltemate S, Pfaffinger G, Overmann J, Bader RC и др. (май 2019 г.). «Внутрихозяйственная эволюция Helicobacter pylori, сформированная нишево-специфической адаптацией, внутрижелудочными миграциями и селективными выметаниями». Nat Commun . 10 (1): 2273. Bibcode : 2019NatCo..10.2273A. doi : 10.1038/s41467-019-10050-1. PMC 6531487. PMID 31118420.
- ^ Loughlin MF, Barnard FM, Jenkins D, Sharples GJ, Jenks PJ (апрель 2003 г.). «Мутанты Helicobacter pylori, дефектные в RuvC Holliday junction resolvase, демонстрируют снижение выживаемости макрофагов и спонтанного очищения от слизистой оболочки желудка мышей». Инфекция и иммунитет . 71 (4): 2022– 31. doi :10.1128 / IAI.71.4.2022-2031.2003. PMC 152077. PMID 12654822.
- ^ ab Wang G, Maier RJ (январь 2008 г.). «Критическая роль RecN в рекомбинационной репарации ДНК и выживании Helicobacter pylori». Инфекция и иммунитет . 76 (1): 153– 60. doi :10.1128/IAI.00791-07. PMC 2223656. PMID 17954726 .
- ^ аб Бахманинежад П., Гафурян С., Махмуди М., Малеки А., Садегифард Н., Бадахш Б. (апрель 2021 г.). «Персистерные клетки как возможная причина неудачи антибиотикотерапии при Helicobacter pylori». JGH Открыть . 5 (4): 493–497 . doi : 10.1002/jgh3.12527. ПМЦ 8035453 . ПМИД 33860100.
- ^ ab Cammarota G, Sanguinetti M, Gallo A, Posteraro B (август 2012 г.). «Обзорная статья: образование биопленки H elicobacter pylori как цель для искоренения резистентной инфекции». Alimentary Pharmacology & Therapeutics . 36 (3): 222– 230. doi :10.1111/j.1365-2036.2012.05165.x. PMID 22650647. S2CID 24026187 . Получено 3 марта 2024 г. .
- ^ abcd Шадвар Н., Акрами С., Мусави Сагарчи С.М., Аскандар Р.Х., Мерати А., Агаяри М. и др. (7 мая 2024 г.). «Обзор лечения Helicobacter pylori без антибиотиков: новое понимание». Границы микробиологии . 15 . дои : 10.3389/fmicb.2024.1379209 . ISSN 1664-302X. ПМЦ 11106852 . ПМИД 38774508.
- ^ abcdef Crowe SE (21 марта 2019 г.). «Инфекция Helicobacter pylori». New England Journal of Medicine . 380 (12): 1158– 1165. doi : 10.1056/NEJMcp1710945. PMID 30893536. S2CID 84843669.
- ^ ab Jambi LK (7 октября 2022 г.). «Систематический обзор и метаанализ чувствительности и специфичности дыхательных тестов с мочевиной (13)C/(14)C в диагностике инфекции Helicobacter pylori». Диагностика . 12 (10): 2428. doi : 10.3390/diagnostics12102428 . PMC 9600925. PMID 36292117 .
- ^ Логан РП, Уокер ММ (октябрь 2001 г.). «ABC верхнего желудочно-кишечного тракта: эпидемиология и диагностика инфекции Helicobacter pylori». BMJ . 323 (7318): 920– 2. doi :10.1136/bmj.323.7318.920. PMC 1121445 . PMID 11668141.
- ^ Решетняк ВИ, Бурмистров АИ, Маев ИВ (февраль 2021 г.). «Helicobacter pylori: комменсал, симбионт или патоген?». World J Gastroenterol . 27 (7): 545–560 . doi : 10.3748 /wjg.v27.i7.545 . PMC 7901052. PMID 33642828.
- ^ ab Rahat M, Saqib M, Ahmed M, Suleman M, Ismail SM, Mumtaz H и др. (июнь 2023 г.). «Использование эрадикационной терапии в дополнение к пародонтальной терапии по сравнению с ее применением в качестве монотерапии для лечения инфекций Helicobacter pylori: мини-обзор». Ann Med Surg (Лондон) . 85 (6): 2756– 2760. doi : 10.1097/MS9.00000000000000741. PMC 10289787. PMID 37363585 .
- ^ Delport W, van der Merwe SW (2007). «Передача Helicobacter pylori: влияние метода анализа и исследуемой популяции на выводы». Best Practice & Research. Clinical Gastroenterology . 21 (2): 215–36 . doi :10.1016/j.bpg.2006.10.001. hdl : 2263/4083 . PMID 17382274.
- ^ Tsukamoto T, Nakagawa M, Kiriyama Y, Toyoda T, Cao X (август 2017 г.). «Профилактика рака желудка: искоренение Helicobacter Pylori и не только». International Journal of Molecular Sciences . 18 (8): 1699. doi : 10.3390/ijms18081699 . PMC 5578089. PMID 28771198 .
- ^ Ли Л, Ю Ч (2019). «Инфекция Helicobacter pylori после эндоскопической резекции раннего рака желудка». BioMed Research International . 2019 : 1– 6. doi : 10.1155/2019/9824964 . PMC 6816031. PMID 31737682.
- ^ ab Talebi Bezmin Abadi A (март 2016 г.). «Вакцина против Helicobacter pylori: неизбежный подход». World J Gastroenterol . 22 (11): 3150– 7. doi : 10.3748/wjg.v22.i11.3150 . PMC 4789989. PMID 27003991 .
- ^ Blanchard TG, Nedrud JG (2010). "9. Вакцины против Helicobacter pylori". В Sutton P, Mitchell H (ред.).Helicobacter pylori в 21 веке . CABI. стр. 167–189 . ISBN 978-1-84593-594-8. Получено 7 августа 2013 г.
- ^ de Vries R, Klok RM, Brouwers JR, Postma MJ (февраль 2009 г.). «Экономическая эффективность потенциальной будущей вакцины против Helicobacter pylori в Нидерландах: влияние изменения ставки дисконтирования на здоровье». Vaccine . 27 (6): 846– 52. doi :10.1016/j.vaccine.2008.11.081. PMID 19084566. Архивировано из оригинала 10 мая 2021 г. Получено 7 августа 2013 г.
- ^ Rupnow MF, Chang AH, Shachter RD, Owens DK, Parsonnet J (октябрь 2009 г.). «Экономическая эффективность потенциальной профилактической вакцины против Helicobacter pylori в Соединенных Штатах». Журнал инфекционных заболеваний . 200 (8): 1311– 7. doi : 10.1086/605845 . PMID 19751153.
- ^ ab Sutton P, Boag JM (ноябрь 2019 г.). «Состояние исследований и разработок вакцин против Helicobacter pylori». Вакцина . 37 (50): 7295– 7299. doi :10.1016/j.vaccine.2018.01.001. PMC 6892279. PMID 29627231 .
- ^ "PDB101: Молекула месяца: протон-управляемый мочевинный канал". RCSB: PDB-101 . Архивировано из оригинала 6 ноября 2023 . Получено 6 ноября 2023 .
- ^ аб Азер С.А., Ахонди Х (2019). "Гастрит". СтатПерлз . ПМИД 31334970.
- ^ abc Ширли М (март 2024 г.). «Vonoprazan: A Review in Helicobacter pylori Infection». Drugs . 84 (3): 319– 327. doi :10.1007/s40265-023-01991-5. PMC 11090951 . PMID 38388872.
- ^ «Два новых режима получили одобрение FDA для лечения инфекции H. Pylori». www.medpagetoday.com . 4 мая 2022 г. Архивировано из оригинала 25 марта 2023 г. Получено 25 марта 2023 г.
- ^ Rauws EA, Tytgat GN (май 1990). «Лечение язвы двенадцатиперстной кишки, связанное с эрадикацией Helicobacter pylori». Lancet . 335 (8700): 1233– 5. doi :10.1016/0140-6736(90)91301-P. PMID 1971318. S2CID 41888935.
- ^ ab Burkitt MD, Duckworth CA, Williams JM, Pritchard DM (февраль 2017 г.). «Helicobacter pylori-индуцированная патология желудка: выводы из моделей in vivo и ex vivo». Модели и механизмы заболеваний . 10 ( 2): 89– 104. doi :10.1242/dmm.027649. PMC 5312008. PMID 28151409.
- ^ Zhu LB, Zhang YC, Huang HH, Lin J (сентябрь 2021 г.). «Перспективы клинического применения бактерий, продуцирующих бутират». World J Clin Pediatr . 10 (5): 84–92 . doi : 10.5409/wjcp.v10.i5.84 . PMC 8465514. PMID 34616650 .
- ^ Saracino IM, Pavoni M, Saccomanno L, Fiorini G, Pesci V, Foschi C и др. (Май 2020 г.). «Антимикробная эффективность пяти пробиотических штаммов против Helicobacter pylori». Антибиотики . 9 (5): 244. doi : 10.3390/antibiotics9050244 . PMC 7277513. PMID 32403331 .
- ^ Soto SM (апрель 2013 г.). «Роль эффлюксных насосов в устойчивости бактерий, встроенных в биопленку, к антибиотикам». Вирулентность . 4 (3): 223– 9. doi :10.4161/viru.23724. PMC 3711980. PMID 23380871 .
- ^ ab Cai Y, Wang C, Chen Z, Xu Z, Li H, Li W и др. (август 2020 г.). «Транспортеры HP0939, HP0497 и HP0471 участвуют в формировании внутренней множественной лекарственной устойчивости и биопленки у Helicobacter pylori, усиливая отток лекарств». Helicobacter . 25 (4): e12715. doi :10.1111/hel.12715. PMID 32548895. S2CID 219726485. Архивировано из оригинала 15 февраля 2024 г. . Получено 15 февраля 2024 г. .
- ^ Mommersteeg MC, Nieuwenburg SA, Wolters LM, Roovers BH, van Vuuren HA, Verhaar AP и др. (ноябрь 2023 г.). «Использование неинвазивных тестов кала для проверки эрадикации Helicobacter pylori и устойчивости к кларитромицину». Объединенный Европейский Гастроэнтерол Дж . 11 (9): e894-903. дои : 10.1002/ueg2.12473 . ПМЦ 10637120 . ПМИД 37854002.
- ^ Stenström B, Mendis A, Marshall B (август 2008 г.). «Helicobacter pylori — новейшие достижения в диагностике и лечении». Australian Family Physician . 37 (8): 608–12 . PMID 18704207.
- ^ Fischbach L, Evans EL (август 2007 г.). «Метаанализ: влияние статуса устойчивости к антибиотикам на эффективность тройной и четверной терапии первой линии для Helicobacter pylori». Alimentary Pharmacology & Therapeutics (метаанализ). 26 (3): 343–57 . doi :10.1111/j.1365-2036.2007.03386.x. PMID 17635369. S2CID 20973127.
- ^ Graham DY, Shiotani A (июнь 2008 г.). «Новые концепции резистентности при лечении инфекций Helicobacter pylori». Nature Clinical Practice. Гастроэнтерология и гепатология . 5 (6): 321– 31. doi :10.1038/ncpgasthep1138. PMC 2841357. PMID 18446147 .
- ^ Pohl D, Keller PM, Bordier V, Wagner K (август 2019 г.). «Обзор современных методов диагностики и достижений в диагностике Helicobacter pylori в эпоху секвенирования следующего поколения». World J Gastroenterol . 25 (32): 4629– 4660. doi : 10.3748/wjg.v25.i32.4629 . PMC 6718044. PMID 31528091 .
- ^ Sukri A, Hanafiah A, Patil S, Lopes BS (апрель 2023 г.). «Потенциал альтернативных методов лечения и вакцин-кандидатов против Helicobacter pylori». Pharmaceuticals . 16 (4): 552. doi : 10.3390/ph16040552 . PMC 10141204. PMID 37111309 .
- ^ abc Vaou N, Stavropoulou E, Voidarou C, Tsigalou C, Bezirtzoglou E (сентябрь 2021 г.). «На пути к достижениям в области антимикробной активности лекарственных растений: обзорное исследование проблем и будущих перспектив». Microorganisms . 9 (10): 2041. doi : 10.3390/microorganisms9102041 . PMC 8541629 . PMID 34683362.
- ^ Moon JK, Kim JR, Ahn YJ, Shibamoto T (июнь 2010 г.). «Анализ и антихеликобактерная активность сульфорафана и родственных соединений, присутствующих в ростках брокколи (Brassica oleracea L.)». Журнал сельскохозяйственной и пищевой химии . 58 (11): 6672– 7. Bibcode : 2010JAFC...58.6672M. doi : 10.1021/jf1003573. PMID 20459098.
- ^ Sathianarayanan S, Ammanath AV, Biswas R, BA, Sukumaran S, Venkidasamy B (июль 2022 г.). «Новый подход к борьбе с Helicobacter pylori с использованием растений и их компонентов: обзорное исследование». Microb Pathog . 168 : 105594. doi :10.1016/j.micpath.2022.105594. PMID 35605740. S2CID 248975163.
- ^ Moradi Y, Majidi L, Khateri S, Azh N, Gheshlagh RG, Saniee N и др. (Июль 2023 г.). «Связь между заболеваниями пародонта и helicobacter pylori: обновленный метаанализ наблюдательных исследований». BMC Oral Health . 23 (1): 523. doi : 10.1186/s12903-023-03232-3 . PMC 10369707 . PMID 37496045.
- ^ Смит Э.К., Нильссон М., Грабш Х.И., ван Грикен, Северная Каролина, Лордик Ф. (август 2020 г.). «Рак желудка». Ланцет . 396 (10251): 635–648 . doi :10.1016/S0140-6736(20)31288-5. ПМИД 32861308.
- ^ Badgwell B, Das P, Ajani J (август 2017 г.). «Лечение локализованной желудочной и гастроэзофагеальной аденокарциномы: роль точного стадирования и предоперационной терапии». Журнал гематологии и онкологии . 10 (1): 149. doi : 10.1186/s13045-017-0517-9 . PMC 5558742. PMID 28810883 .
- ^ Laird-Fick HS, Saini S, Hillard JR (август 2016 г.). «Аденокарцинома желудка: роль Helicobacter pylori в патогенезе и профилактических мероприятиях». Postgraduate Medical Journal . 92 (1090): 471– 7. doi :10.1136/postgradmedj-2016-133997. PMID 27222587. S2CID 20739020.
- ^ Брон Д., Мейлеман Н. (сентябрь 2019 г.). «Лимфомы маргинальной зоны: вторые по частоте лимфомы у пожилых пациентов». Current Opinion in Oncology . 31 (5): 386–393 . doi :10.1097/CCO.00000000000000554. PMID 31246587. S2CID 195765608.
- ^ Kobayashi T, Takahashi N, Hagiwara Y, Tamaru J, Kayano H, Jin-nai I и др. (январь 2008 г.). «Успешная радиотерапия у пациента с первичной лимфомой, связанной со слизистой прямой кишки, без гена слияния API2-MALT1: отчет о случае и обзор литературы». Leukemia Research . 32 (1): 173– 5. doi :10.1016/j.leukres.2007.04.017. PMID 17570523.
- ^ Matysiak-Budnik T, Priadko K, Bossard C, Chapelle N, Ruskoné-Fourmestraux A (июль 2023 г.). «Клиническое ведение пациентов с лимфомой MALT желудка: точка зрения гастроэнтеролога». Раковые заболевания . 15 (15): 3811. doi : 10.3390/cancers15153811 . PMC 10417821. PMID 37568627 .
- ^ Casulo C, Friedberg J (2017). «Трансформация лимфомы маргинальной зоны (и связь с другими лимфомами)». Best Practice & Research. Clinical Hematology . 30 ( 1– 2): 131– 138. doi : 10.1016/j.beha.2016.08.029. PMID 28288708.
- ^ abc Kuo SH, Yeh KH, Chen LT, Lin CW, Hsu PN, Hsu C и др. (июнь 2014 г.). «Диффузная крупноклеточная В-клеточная лимфома желудка, связанная с Helicobacter pylori: отдельная сущность с более низкой агрессивностью и более высокой химиочувствительностью». Blood Cancer Journal . 4 (6): e220. doi :10.1038/bcj.2014.40. PMC 4080211 . PMID 24949857.
- ^ abc Cheng Y, Xiao Y, Zhou R, Liao Y, Zhou J, Ma X (август 2019 г.). "Прогностическое значение инфекции helicobacter pylori при диффузной крупноклеточной В-клеточной лимфоме желудка". BMC Cancer . 19 (1): 842. doi : 10.1186/s12885-019-6067-5 . PMC 6712724 . PMID 31455250.
- ^ Tsai HJ, Tai JJ, Chen LT, Wu MS, Yeh KH, Lin CW и др. (июль 2020 г.). «Многоцентровое проспективное исследование антибиотикотерапии первой линии при лимфоме лимфоидной ткани, ассоциированной со слизистой оболочкой желудка, на ранней стадии и диффузной крупноклеточной В-клеточной лимфоме с гистологическим подтверждением лимфоидной ткани, ассоциированной со слизистой оболочкой». Haematologica . 105 (7): e349 – e354 . doi : 10.3324/haematol.2019.228775 . PMC 7327622 . PMID 31727764.
- ^ Balendra V, Amoroso C, Galassi B, Esposto J, Bareggi C, Luu J и др. (август 2023 г.). «Диета с высоким содержанием соли обостряет инфекцию H. pylori и увеличивает риск рака желудка». J Pers Med . 13 (9): 1325. doi : 10.3390/jpm13091325 . PMC 10533117. PMID 37763093 .
- ^ Jaroenlapnopparat A, Bhatia K, Coban S (июнь 2022 г.). «Воспаление и рак желудка». Заболевания . 10 (3): 35. doi : 10.3390/diseases10030035 . PMC 9326573. PMID 35892729 .
- ^ Park JM, Han YM, Oh JY, Lee DY, Choi SH, Hahm KB (сентябрь 2021 г.). «Профилирование транскриптома, вовлеченное в полезные действия экстрактов кимчи против инфекции Helicobacter pylori». J Clin Biochem Nutr . 69 (2): 171– 187. doi :10.3164/jcbn.20-116. PMC 8482382. PMID 34616109 .
- ^ ab Brown LM (2000). «Helicobacter pylori: эпидемиология и пути передачи». Epidemiologic Reviews . 22 (2): 283–97 . doi : 10.1093/oxfordjournals.epirev.a018040 . PMID 11218379.
- ^ Pacifico L, Osborn JF, Bonci E, Romaggioli S, Baldini R, Chiesa C (январь 2014 г.). «Пробиотики для лечения инфекции Helicobacter pylori у детей». World J Gastroenterol . 20 (3): 673–83 . doi : 10.3748/wjg.v20.i3.673 . PMC 3921477. PMID 24574741 .
- ^ Goodman KJ, O'rourke K, Day RS, Wang C, Nurgalieva Z, Phillips CV и др. (декабрь 2005 г.). «Динамика инфекции Helicobacter pylori в когорте США и Мексики в течение первых двух лет жизни». International Journal of Epidemiology . 34 (6): 1348–55 . doi : 10.1093/ije/dyi152 . PMID 16076858.
- ^ Ли Р., Чжан П., Ху З., Йи И., Чэнь Л., Чжан Х. (14 мая 2021 г.). «Повторное инфицирование Helicobacter pylori и его факторы риска после первоначальной эрадикации: протокол систематического обзора и метаанализа». Медицина . 100 (19): e25949. doi : 10.1097/MD.0000000000025949 . PMC 8133036. PMID 34106668 .
- ^ abc Blaser MJ (февраль 2005 г.). «Исчезающий вид в желудке». Scientific American . 292 (2): 38– 45. Bibcode : 2005SciAm.292b..38B. doi : 10.1038/scientificamerican0205-38. PMID 15715390.
- ^ Graham DY, Yamaoka Y, Malaty HM (ноябрь 2007 г.). «Размышления о будущем без Helicobacter pylori и гипотезы ужасных последствий». Helicobacter . 12 (Suppl 2): 64– 8. doi :10.1111/j.1523-5378.2007.00566.x. PMC 3128250 . PMID 17991179.
- ^ Delaney B, McColl K (август 2005 г.). «Обзорная статья: Helicobacter pylori и гастроэзофагеальная рефлюксная болезнь». Alimentary Pharmacology & Therapeutics (обзор). 22 (Suppl 1): 32– 40. doi :10.1111/j.1365-2036.2005.02607.x. PMID 16042657. S2CID 34921548.
- ^ Blaser MJ, Chen Y, Reibman J (май 2008 г.). «Защищает ли Helicobacter pylori от астмы и аллергии?». Gut . 57 ( 5): 561– 7. doi :10.1136/gut.2007.133462. PMC 3888205. PMID 18194986.
- ^ Chen Y, Blaser MJ (август 2008 г.). «Колонизация Helicobacter pylori обратно пропорциональна детской астме». Журнал инфекционных заболеваний . 198 (4): 553– 60. doi : 10.1086/590158. PMC 3902975. PMID 18598192 .
- ^ Smoak BL, Kelley PW, Taylor DN (март 1994). «Серопревалентность инфекций Helicobacter pylori в когорте новобранцев армии США». American Journal of Epidemiology . 139 (5): 513– 9. doi :10.1093/oxfordjournals.aje.a117034. PMID 8154475.
- ^ Эверхарт Дж. Э., Крузон-Моран Д., Перес-Перес ГИ, Тралка ТС, МакКуиллан Г. (апрель 2000 г.). «Серопревалентность и этнические различия в инфекции Helicobacter pylori среди взрослых в Соединенных Штатах». Журнал инфекционных заболеваний . 181 (4): 1359–63 . doi : 10.1086/315384 . PMID 10762567.
- ^ Malaty HM (2007). «Эпидемиология инфекции Helicobacter pylori». Передовая практика и исследования. Клиническая гастроэнтерология . 21 (2): 205–14 . doi :10.1016/j.bpg.2006.10.005. PMID 17382273.
- ^ Mégraud F (сентябрь 2004 г.). «Устойчивость H. pylori к антибиотикам: распространенность, важность и достижения в тестировании». Gut . 53 (9): 1374– 84. doi :10.1136/gut.2003.022111. PMC 1774187 . PMID 15306603.
- ^ Correa P, Piazuelo MB (январь 2012 г.). «Эволюционная история генома Helicobacter pylori: значение для желудочного канцерогенеза». Gut and Liver . 6 (1): 21– 8. doi : 10.5009/gnl.2012.6.1.21 . PMC 3286735. PMID 22375167.
- ^ Linz B, Balloux F, Moodley Y, Manica A, Liu H, Roumagnac P, et al. (Февраль 2007). «Африканское происхождение тесной связи между людьми и Helicobacter pylori». Nature . 445 (7130): 915– 918. Bibcode :2007Natur.445..915L. doi :10.1038/nature05562. PMC 1847463 . PMID 17287725.
- ^ "Нобелевская премия по физиологии и медицине 2005 года". Архивировано из оригинала 23 мая 2020 года . Получено 30 августа 2018 года .
- ^ Биззозеро G (1893). «Ueber die schlauchförmigen Drüsen des Magendarmkanals und die Beziehungen ihres Epitheles zu dem Oberflächenepithel der Schleimhaut». Архив для микроскопической анатомии . 42 : 82–152 . doi : 10.1007/BF02975307. S2CID 85338121. Архивировано из оригинала 2 декабря 2020 года . Проверено 29 июня 2019 г.
- ^ Konturek JW (декабрь 2003 г.). «Открытие Яворским Helicobacter pylori и его патогенетической роли при язвенной болезни, гастрите и раке желудка» (PDF) . Journal of Physiology and Pharmacology . 54 (Suppl 3): 23– 41. PMID 15075463. Архивировано из оригинала (PDF) 30 сентября 2004 г. . Получено 25 августа 2008 г. .
- ^ Egan BJ, O'Morain CA (2007). «Историческая перспектива гастродуоденита, вызванного Helicobacter, и его осложнений». Best Practice & Research. Clinical Gastroenterology . 21 (2): 335–46 . doi :10.1016/j.bpg.2006.12.002. PMID 17382281.
- ^ Palmer ED (август 1954). «Исследование спирохет слизистой оболочки желудка человека». Гастроэнтерология . 27 (2): 218– 20. doi :10.1016/S0016-5085(19)36173-6. PMID 13183283.
- ^ Steer HW (август 1975). «Ультраструктура миграции клеток через желудочный эпителий и ее связь с бактериями». Журнал клинической патологии . 28 (8): 639–46 . doi :10.1136/jcp.28.8.639. PMC 475793. PMID 1184762 .
- ^ Маршалл Б. Дж., Уоррен Дж. Р. (июнь 1984 г.). «Неопознанные изогнутые бациллы в желудке пациентов с гастритом и пептической язвой». Lancet . 1 (8390): 1311– 5. doi :10.1016/S0140-6736(84)91816-6. PMID 6145023. S2CID 10066001.
- ^ Atwood KI (2004). "Бактерии, язвы и остракизм? H. pylori и создание мифа". Архивировано из оригинала 5 ноября 2009 года . Получено 2 августа 2008 года .
- ^ Helicobacter pylori при язвенной болезни (отчет). Консенсусное заявление NIH Online. Том 12. 7–9 января 1994 г. стр. 1–23 . Архивировано из оригинала 19 августа 2011 г. Получено 21 декабря 2004 г.
- ^ ab Liddell HG , Scott R (1966). Лексикон: Сокращенный вариант из Греко-английского лексикона Лидделла и Скотта . Оксфорд, Великобритания: Oxford University Press. ISBN 978-0-19-910207-5.
- ^ Маршалл Б.С., Гудвин К.С. (1987). «Пересмотренная номенклатура Campylobacter pyloridis». Международный журнал систематической бактериологии . 37 (1): 68. doi : 10.1099/00207713-37-1-68 .
- ^ Goodwin CS, Armstrong JA, Chilvers T, Peters M, Collins MD, Sly L, et al. (1989). «Передача Campylobacter pylori и Campylobacter mustelae в Helicobacter gen. nov. как Helicobacter pylori comb. nov. и Helicobacter mustelae comb. nov. соответственно». Международный журнал систематической бактериологии . 39 (4): 397– 405. doi : 10.1099/00207713-39-4-397 .
- ^ Бакли М.Дж., О'Морейн, Калифорния (1998). «Биология хеликобактера — открытие». British Medical Bulletin . 54 (1): 7–16 . doi : 10.1093/oxfordjournals.bmb.a011681 . PMID 9604426.
- ^ Mégraud F, et al. (Европейская группа по изучению Helicobacter) (ноябрь 2007 г.). «Эволюция исследований Helicobacter pylori, наблюдаемая на семинарах Европейской группы по изучению Helicobacter». Helicobacter . 12 Suppl 2 (Suppl 2): 1– 5. doi :10.1111/j.1523-5378.2007.00581.x. PMID 17991169. S2CID 45841196.
- ^ "EHMSG". Ehmsg2019 . Архивировано из оригинала 11 января 2024 . Получено 11 января 2024 .
- ^ Malfertheiner P, Megraud F, O'Morain CA, Atherton J, Axon AT, Bazzoli F, et al. (Европейская группа по изучению Helicobacter) (май 2012 г.). «Управление инфекцией Helicobacter pylori — отчет о консенсусе Маастрихт IV/Флоренции». Gut . 61 (5): 646– 64. doi : 10.1136/gutjnl-2012-302084 . hdl : 1765/64813 . PMID 22491499. S2CID 1401974. Архивировано из оригинала 4 июля 2021 г. . Получено 7 декабря 2012 г. .
- ^ Мальфертайнер П., Меград Ф., О'Морейн С., Базцоли Ф., Эль-Омар Э., Грэм Д. и др. (июнь 2007 г.). «Современные концепции лечения инфекции Helicobacter pylori: Маастрихтский консенсусный отчет III». Гут . 56 (6): 772–81 . doi :10.1136/gut.2006.101634. ЧВК 1954853 . ПМИД 17170018.
- ^ Malfertheiner P, Mégraud F, O'Morain C, Hungin AP, Jones R, Axon A и др. (Европейская группа по изучению Helicobacter Pylori (EHPSG)) (февраль 2002 г.). «Современные концепции лечения инфекции Helicobacter pylori — консенсусный отчет Маастрихта 2-2000». Alimentary Pharmacology & Therapeutics . 16 (2): 167– 80. doi :10.1046/j.1365-2036.2002.01169.x. PMID 11860399. S2CID 6166458.
- ^ Malfertheiner P, Mégraud F, O'Morain C, Bell D, Bianchi Porro G, Deltenre M и др. (Европейская группа по изучению Helicobacter Pylori (EHPSG)) (январь 1997 г.). «Современные европейские концепции лечения инфекции Helicobacter pylori — отчет Маастрихтского консенсуса. Европейская группа по изучению Helicobacter Pylori (EHPSG)». Европейский журнал гастроэнтерологии и гепатологии . 9 (1): 1– 2. doi :10.1097/00042737-199701000-00002. PMID 9031888. S2CID 36930542.
- ^ McNicholl AG, Gasbarrini A, Tepes B, et al. (сентябрь 2014 г.). «Общеевропейский реестр по лечению H. pylori (Hp-EuReg): промежуточный анализ 5792 пациентов». Helicobacter . 2014 : 69.
- ^ "Лечение инфекции Helicobacter pylori". Онлайн-курсы. Объединенная европейская гастроэнтерология . Архивировано из оригинала 2 апреля 2015 г.
- ^ "Annual Report 2012". United European Gastroenterology . Архивировано из оригинала 4 июня 2016 года . Получено 25 февраля 2015 года .
- ^ Jung SW, Lee SW (январь 2016 г.). «Антибактериальное действие жирных кислот на инфекцию Helicobacter pylori». Корейский журнал внутренней медицины (обзор). 31 (1): 30– 5. doi :10.3904/kjim.2016.31.1.30. PMC 4712431 . PMID 26767854.
Внешние ссылки
- "Информация о тестах на H. pylori". Национальные институты здравоохранения . Министерство здравоохранения и социальных служб США. 29 августа 2011 г. Архивировано из оригинала 13 июня 2013 г.
- «Европейская группа по изучению хеликобактера (EHSG)».
- «Типовой штамм Helicobacter pylori в BacDive». База метаданных бактериального разнообразия .
- "Helicobacter pylori". Геном . KEGG. Япония. 26695.

