Протеаза

Протеаза (также называемая пептидазой , протеиназой или протеолитическим ферментом ) [1] — это фермент , который катализирует протеолиз , расщепляя белки на более мелкие полипептиды или отдельные аминокислоты и стимулируя образование новых белковых продуктов. [2] Они делают это, расщепляя пептидные связи внутри белков путем гидролиза , реакции, в которой вода разрушает связи . Протеазы участвуют в многочисленных биологических путях, включая переваривание потребляемых белков, катаболизм белков (расщепление старых белков), [3] [4] и передачу сигналов в клетках .
При отсутствии функциональных ускорителей протеолиз был бы очень медленным и занял бы сотни лет . [5] Протеазы можно найти во всех формах жизни и вирусах . Они независимо эволюционировали несколько раз , и разные классы протеаз могут выполнять одну и ту же реакцию с помощью совершенно разных каталитических механизмов .
Классификация
На основе каталитического остатка
Протеазы можно разделить на семь основных групп: [6]
- Сериновые протеазы - с использованием серинового спирта
- Цистеиновые протеазы - с использованием тиола цистеина
- Треониновые протеазы - с использованием вторичного спирта треонина
- Аспарагиновые протеазы - с использованием аспартаткарбоновой кислоты
- Глутаминовые протеазы - с использованием глутаматкарбоновой кислоты
- Металлопротеазы – используют металл , обычно цинк [3] [4]
- Аспарагинпептидлиазы — используют аспарагин для проведения реакции элиминации (не требующей воды)
Протеазы были впервые сгруппированы в 84 семейства в соответствии с их эволюционными отношениями в 1993 году и классифицированы по четырем каталитическим типам: сериновые , цистеиновые , аспарагиновые и металлопротеазы . [7] Треониновые и глутаминовые протеазы не были описаны до 1995 и 2004 годов соответственно. Механизм, используемый для расщепления пептидной связи, включает создание аминокислотного остатка , который имеет цистеин и треонин (протеазы) или молекулу воды (аспарагиновая, глутаминовая и металлопротеазы) нуклеофильными, так что он может атаковать карбонильную группу пептида. Один из способов создания нуклеофила — это каталитическая триада , где остаток гистидина используется для активации серина , цистеина или треонина в качестве нуклеофила. Однако это не эволюционная группировка, поскольку типы нуклеофилов эволюционировали конвергентно в различных суперсемействах , а некоторые суперсемейства демонстрируют дивергентную эволюцию к нескольким различным нуклеофилам. Металлопротеазы, аспарагиновая и глутаминовая протеазы используют остатки своего активного центра для активации молекулы воды, которая затем атакует разрывную связь. [8]
Пептидные лиазы
Седьмой каталитический тип протеолитических ферментов, аспарагиновая пептидная лиаза , был описан в 2011 году. Его протеолитический механизм необычен, поскольку вместо гидролиза он выполняет реакцию элиминации . [9] Во время этой реакции каталитический аспарагин образует циклическую химическую структуру, которая расщепляет себя на остатки аспарагина в белках при правильных условиях. Учитывая его принципиально иной механизм, его включение в качестве пептидазы может быть спорным. [9]
На основе эволюционной филогении
Современная классификация эволюционных суперсемейств протеаз находится в базе данных MEROPS. [10] В этой базе данных протеазы классифицируются в первую очередь по «клану» ( суперсемейству ) на основе структуры, механизма и порядка каталитических остатков (например, клан PA , где P обозначает смесь семейств нуклеофилов). Внутри каждого «клана» протеазы классифицируются по семействам на основе сходства последовательностей (например, семейства S1 и C3 внутри клана PA). Каждое семейство может содержать многие сотни родственных протеаз (например , трипсин , эластаза , тромбин и стрептогризин внутри семейства S1).
В настоящее время известно более 50 кланов, каждый из которых указывает на независимое эволюционное происхождение протеолиза. [10]
На основе оптимального pH
Альтернативно протеазы можно классифицировать по оптимальному значению pH , при котором они активны:
- Кислотные протеазы
- Нейтральные протеазы, участвующие в гиперчувствительности типа 1. Здесь они высвобождаются тучными клетками и вызывают активацию комплемента и кининов . [11] В эту группу входят кальпаины .
- Основные протеазы (или щелочные протеазы )
Ферментативная функция и механизм
Протеазы участвуют в переваривании длинных белковых цепей на более короткие фрагменты путем расщепления пептидных связей , которые соединяют аминокислотные остатки. Некоторые отщепляют концевые аминокислоты от белковой цепи ( экзопептидазы , такие как аминопептидазы , карбоксипептидаза А ); другие атакуют внутренние пептидные связи белка ( эндопептидазы , такие как трипсин , химотрипсин , пепсин , папаин , эластаза ).
Катализ
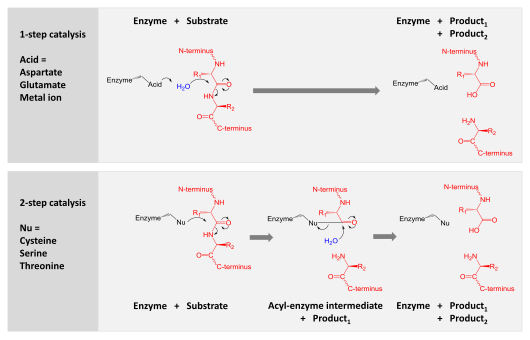
Катализ достигается одним из двух механизмов:
- Аспарагиновая, глутаминовая и металлопротеазы активируют молекулу воды, которая осуществляет нуклеофильную атаку на пептидную связь, гидролизуя ее.
- Сериновые, треониновые и цистеиновые протеазы используют нуклеофильный остаток (обычно в каталитической триаде ). Этот остаток осуществляет нуклеофильную атаку, чтобы ковалентно связать протеазу с субстратным белком, высвобождая первую половину продукта. Этот ковалентный ацил-ферментный промежуточный продукт затем гидролизуется активированной водой для завершения катализа путем высвобождения второй половины продукта и регенерации свободного фермента.
Специфичность
Протеолиз может быть крайне беспорядочным, так что гидролизуется широкий спектр белковых субстратов. Это касается пищеварительных ферментов, таких как трипсин , которые должны быть способны расщеплять массив поглощенных белков на более мелкие пептидные фрагменты. Беспорядочные протеазы обычно связываются с одной аминокислотой на субстрате и поэтому имеют специфичность только для этого остатка. Например, трипсин специфичен для последовательностей ...K\... или ...R\... ('\'=сайт расщепления). [12]
Напротив, некоторые протеазы являются высокоспецифичными и расщепляют только субстраты с определенной последовательностью. Свертывание крови (например, тромбин ) и обработка вирусных полипротеинов (например, протеаза TEV ) требуют этого уровня специфичности для достижения точных событий расщепления. Это достигается за счет того, что протеазы имеют длинную связывающую щель или туннель с несколькими карманами, которые связываются с определенными остатками. Например, протеаза TEV специфична для последовательности ...ENLYFQ\S... ('\'=сайт расщепления). [13]
Деградация и автолиз
Протеазы, сами являясь белками, расщепляются другими молекулами протеаз, иногда того же сорта. Это действует как метод регуляции активности протеаз. Некоторые протеазы менее активны после автолиза (например, протеаза TEV ), в то время как другие более активны (например, трипсиноген ).
Биоразнообразие протеаз
Протеазы встречаются во всех организмах, от прокариот до эукариот и вирусов . Эти ферменты участвуют во множестве физиологических реакций от простого переваривания пищевых белков до высокорегулируемых каскадов (например, каскад свертывания крови , система комплемента , пути апоптоза и каскад активации профенолоксидазы беспозвоночных). Протеазы могут либо разрывать определенные пептидные связи ( ограниченный протеолиз ), в зависимости от аминокислотной последовательности белка, либо полностью расщеплять пептид до аминокислот ( неограниченный протеолиз ). Активность может быть деструктивным изменением (отмена функции белка или переваривание его до основных компонентов), это может быть активация функции или это может быть сигнал в сигнальном пути.
Растения
Геномы растений кодируют сотни протеаз, в основном с неизвестной функцией. Те, у которых известна функция, в основном участвуют в регуляции развития . [14] Растительные протеазы также играют роль в регуляции фотосинтеза . [15]
Животные
Протеазы используются во всем организме для различных метаболических процессов. Кислые протеазы, секретируемые в желудке (например, пепсин ), и сериновые протеазы, присутствующие в двенадцатиперстной кишке ( трипсин и химотрипсин ), обеспечивают переваривание белка в пище. Протеазы, присутствующие в сыворотке крови ( тромбин , плазмин , фактор Хагемана и т. д.), играют важную роль в свертывании крови, а также в лизисе сгустков и правильном действии иммунной системы. Другие протеазы присутствуют в лейкоцитах ( эластаза , катепсин G ) и играют несколько различных ролей в регуляции метаболизма. Некоторые змеиные яды также являются протеазами, например, гемотоксин ямкоголовой змеи , и вмешиваются в каскад свертывания крови жертвы. Протеазы определяют продолжительность жизни других белков, играющих важные физиологические роли, такие как гормоны, антитела или другие ферменты. Это один из самых быстро «включающихся» и «выключающихся» регуляторных механизмов в физиологии организма.
Благодаря сложному кооперативному действию протеазы могут катализировать каскадные реакции, которые приводят к быстрому и эффективному усилению реакции организма на физиологический сигнал.
Бактерии
Бактерии выделяют протеазы для гидролиза пептидных связей в белках и, следовательно, расщепления белков на составляющие их аминокислоты . Бактериальные и грибковые протеазы особенно важны для глобальных циклов углерода и азота в переработке белков, и такая активность, как правило, регулируется пищевыми сигналами в этих организмах. [16] Чистое влияние регуляции питания на активность протеаз среди тысяч видов, присутствующих в почве, можно наблюдать на уровне всего микробного сообщества, поскольку белки расщепляются в ответ на ограничение углерода, азота или серы. [17]
Бактерии содержат протеазы, отвечающие за общий контроль качества белков (например, протеасома ААА+ ) путем деградации несвернутых или неправильно свернутых белков .
Секретируемая бактериальная протеаза может также действовать как экзотоксин и быть примером фактора вирулентности в бактериальном патогенезе (например, эксфолиативный токсин ). Бактериальные экзотоксичные протеазы разрушают внеклеточные структуры.
Вирусы
Геномы некоторых вирусов кодируют один массивный полипротеин , которому нужна протеаза для расщепления его на функциональные единицы (например, вирус гепатита С и пикорнавирусы ). [18] Эти протеазы (например, протеаза TEV ) обладают высокой специфичностью и расщепляют только очень ограниченный набор последовательностей субстрата. Поэтому они являются общей целью для ингибиторов протеазы . [19] [20]
Археи
Археи используют протеазы для регуляции различных клеточных процессов, от клеточной сигнализации , метаболизма , секреции и контроля качества белка. [21] [22] У архей обнаружены только две АТФ-зависимые протеазы: мембранно-ассоциированная протеаза LonB и растворимый комплекс протеосомы 20S . [21]
Использует
Область исследования протеазы огромна. С 2004 года ежегодно публикуется около 8000 статей, относящихся к этой области. [23] Протеазы используются в промышленности, медицине и в качестве основного инструмента биологических исследований. [24] [25]
Пищеварительные протеазы входят в состав многих моющих средств для стирки , а также широко используются в хлебопекарной промышленности в качестве улучшителя хлеба . Различные протеазы используются в медицине как для их собственной функции (например, контроль свертываемости крови), так и для полностью искусственных функций ( например, для целенаправленной деградации патогенных белков). Высокоспецифичные протеазы, такие как протеаза TEV и тромбин, обычно используются для расщепления белков слияния и аффинных меток контролируемым образом. Растительные растворы, содержащие протеазу, называемые вегетарианским сычужным ферментом, уже сотни лет используются в Европе и на Ближнем Востоке для приготовления кошерных и халяльных сыров . Вегетарианский сычужный фермент из Withania coagulans уже тысячи лет используется в качестве аюрведического средства для пищеварения и диабета на индийском субконтиненте. Он также используется для приготовления панира .
Ингибиторы
Активность протеаз подавляется ингибиторами протеаз . [26] Одним из примеров ингибиторов протеаз является суперсемейство серпинов . Оно включает альфа-1-антитрипсин (который защищает организм от чрезмерного воздействия его собственных воспалительных протеаз), альфа-1-антихимотрипсин (который делает то же самое), С1-ингибитор (который защищает организм от чрезмерной активации собственной системы комплемента , вызванной протеазой ), антитромбин (который защищает организм от чрезмерной коагуляции ), ингибитор активатора плазминогена-1 (который защищает организм от недостаточной коагуляции, блокируя фибринолиз , вызванный протеазой ) и нейросерпин . [27]
Естественные ингибиторы протеазы включают семейство белков липокалина , которые играют роль в регуляции и дифференциации клеток. Было обнаружено, что липофильные лиганды, прикрепленные к белкам липокалина, обладают свойствами ингибирования опухолевой протеазы. Естественные ингибиторы протеазы не следует путать с ингибиторами протеазы, используемыми в антиретровирусной терапии. Некоторые вирусы , в том числе ВИЧ/СПИД , зависят от протеаз в своем репродуктивном цикле. Таким образом, ингибиторы протеазы разрабатываются как противовирусные терапевтические средства.
Другие природные ингибиторы протеазы используются в качестве защитных механизмов. Обычными примерами являются ингибиторы трипсина, обнаруженные в семенах некоторых растений, наиболее заметными для людей являются соевые бобы, основная продовольственная культура, где они действуют, отпугивая хищников. Сырые соевые бобы токсичны для многих животных, включая людей, пока содержащиеся в них ингибиторы протеазы не денатурируются.
Смотрите также
- Лигаза
- Протеаза
- клан ПА
- Конвергентная эволюция
- Протеолиз
- Каталитическая триада
- Карта протеолиза
- Протеазы в ангиогенезе
- Внутримембранные протеазы
- Ингибитор протеазы (фармакология)
- Ингибитор протеазы (биология)
- TopFIND - база данных специфичности протеаз, субстратов, продуктов и ингибиторов
- MEROPS - База данных эволюционных групп протеаз
Ссылки
- ^ «Протеолитические ферменты | Описание, типы и функции | Britannica».
- ^ López-Otín C, Bond JS (ноябрь 2008 г.). «Протеазы: многофункциональные ферменты в жизни и болезнях». Журнал биологической химии . 283 (45): 30433– 30437. doi : 10.1074/jbc.R800035200 . PMC 2576539. PMID 18650443 .
- ^ ab King JV, Liang WG, Scherpelz KP, Schilling AB, Meredith SC, Tang WJ (июль 2014 г.). «Молекулярная основа распознавания и деградации субстрата человеческой пресеквенционной протеазой». Структура . 22 (7): 996– 1007. doi :10.1016/j.str.2014.05.003. PMC 4128088. PMID 24931469 .
- ^ ab Shen Y, Joachimiak A, Rosner MR, Tang WJ (октябрь 2006 г.). «Структуры человеческого инсулин-деградирующего фермента раскрывают новый механизм распознавания субстрата». Nature . 443 (7113): 870– 874. Bibcode :2006Natur.443..870S. doi :10.1038/nature05143. PMC 3366509 . PMID 17051221.
- ^ Radzicka A, Wolfenden R (июль 1996 г.). "Скорости некатализируемого гидролиза пептидных связей в нейтральном растворе и сродство протеаз к переходному состоянию". Журнал Американского химического общества . 118 (26): 6105– 6109. doi :10.1021/ja954077c.
Для оценки относительной эффективности ферментов, катализирующих гидролиз внутренних и С-концевых пептидных связей [...]
- ^ Ода К (январь 2012). «Новые семейства карбоксильных пептидаз: серин-карбоксильные пептидазы и глутаминовые пептидазы». Журнал биохимии . 151 (1): 13–25 . doi : 10.1093/jb/mvr129 . PMID 22016395.
- ^ Rawlings ND, Barrett AJ (февраль 1993). «Эволюционные семейства пептидаз». The Biochemical Journal . 290 (Pt 1): 205–218 . doi :10.1042/bj2900205. PMC 1132403. PMID 8439290 .
- ^ Санман, Лора Э. (июнь 2014 г.). «Профилирование протеаз на основе активности». Annual Review of Biochemistry . 83 : 249–273 . doi :10.1146/annurev-biochem-060713-035352. PMID 24905783.
- ^ ab Rawlings ND, Barrett AJ, Bateman A (ноябрь 2011 г.). «Аспарагиновые пептидные лиазы: седьмой каталитический тип протеолитических ферментов». Журнал биологической химии . 286 (44): 38321– 38328. doi : 10.1074/jbc.M111.260026 . PMC 3207474. PMID 21832066 .
- ^ ab Rawlings ND, Barrett AJ, Bateman A (январь 2010 г.). "MEROPS: база данных пептидаз". Nucleic Acids Research . 38 (выпуск базы данных): D227 – D233 . doi : 10.1093/nar/gkp971. PMC 2808883. PMID 19892822.
- ^ Митчелл RS, Кумар V, Аббас AK, Фаусто N (2007). Robbins Basic Pathology (8-е изд.). Филадельфия: Saunders. стр. 122. ISBN 978-1-4160-2973-1.
- ^ Rodriguez J, Gupta N, Smith RD, Pevzner PA (январь 2008 г.). «Трипсин режет раньше пролина?». Journal of Proteome Research . 7 (1): 300–305 . doi :10.1021/pr0705035. PMID 18067249.
- ^ Renicke C, Spadaccini R, Taxis C (2013-06-24). "Протеаза вируса гравировки табака с повышенной толерантностью к субстрату в позиции P1'". PLOS ONE . 8 (6): e67915. Bibcode :2013PLoSO...867915R. doi : 10.1371/journal.pone.0067915 . PMC 3691164 . PMID 23826349.
- ^ van der Hoorn RA (2008). «Растительные протеазы: от фенотипов до молекулярных механизмов». Annual Review of Plant Biology . 59 : 191– 223. doi : 10.1146/annurev.arplant.59.032607.092835. hdl : 11858/00-001M-0000-0012-37C7-9 . PMID 18257708.
- ^ Zelisko A, Jackowski G (октябрь 2004 г.). «Сенесценционно-зависимая деградация Lhcb3 опосредована тилакоидной мембраносвязанной протеазой». Журнал физиологии растений . 161 (10): 1157– 1170. doi :10.1016/j.jplph.2004.01.006. PMID 15535125.
- ^ Sims GK (2006). «Азотное голодание способствует биодеградации N-гетероциклических соединений в почве». Soil Biology & Biochemistry . 38 (8): 2478– 2480. doi :10.1016/j.soilbio.2006.01.006. Архивировано из оригинала 28.04.2021 . Получено 29.12.2018 .
- ^ Sims GK, Wander MM (2002). «Протеолитическая активность при ограничении азота или серы». Appl. Soil Ecol . 568 (3): 1– 5. Bibcode :2002AppSE..19..217S. doi :10.1016/S0929-1393(01)00192-5.
- ^ Tong L (декабрь 2002 г.). «Вирусные протеазы». Chemical Reviews . 102 (12): 4609– 4626. doi :10.1021/cr010184f. PMID 12475203.
- ^ Скореньски М., Сенчик М. (2013). «Вирусные протеазы как цели для разработки лекарств». Current Pharmaceutical Design . 19 (6): 1126– 1153. doi :10.2174/13816128130613. PMID 23016690.
- ^ Курт Йилмаз Н., Свонстром Р., Шиффер КА (июль 2016 г.). «Улучшение ингибиторов вирусной протеазы для борьбы с лекарственной устойчивостью». Тенденции в микробиологии . 24 (7): 547– 557. doi :10.1016/j.tim.2016.03.010. PMC 4912444. PMID 27090931 .
- ^ ab Giménez MI, Cerletti M, De Castro RE (2015). "Архейные мембранно-ассоциированные протеазы: взгляд на Haloferax volcanii и другие галоархеи". Frontiers in Microbiology . 6 : 39. doi : 10.3389/fmicb.2015.00039 . PMC 4343526. PMID 25774151 .
- ^ Maupin-Furlow JA (декабрь 2018 г.). Robinson NP (ред.). «Протеолитические системы архей: нарезка, измельчение и измельчение в экстремальных условиях». Emerging Topics in Life Sciences . 2 (4): 561– 580. doi :10.1042/ETLS20180025. PMC 7497159. PMID 32953999 .
- ^ Barrett AJ, Rawlings ND, Woessnerd JF (2004). Справочник протеолитических ферментов (2-е изд.). Лондон, Великобритания: Elsevier Academic Press. ISBN 978-0-12-079610-6.
- ^ Hooper NM, ред. (2002). Протеазы в биологии и медицине . Лондон: Portland Press. ISBN 978-1-85578-147-4.
- ^ Feijoo-Siota L, Villa TG (28 сентября 2010 г.). «Местные и биотехнологически разработанные растительные протеазы с промышленным применением». Food and Bioprocess Technology . 4 (6): 1066– 1088. doi :10.1007/s11947-010-0431-4. S2CID 84748291.
- ^ Southan C (июль 2001 г.). «Геномная перспектива человеческих протеаз как мишеней для лекарств». Drug Discovery Today . 6 (13): 681– 688. doi :10.1016/s1359-6446(01)01793-7. PMID 11427378.
- ^ Puente XS, López-Otín C (апрель 2004 г.). «Геномный анализ протеаз и ингибиторов протеаз крыс». Genome Research . 14 (4): 609– 622. doi :10.1101/gr.1946304. PMC 383305. PMID 15060002 .
Внешние ссылки
- Международное общество протеолиза
- MEROPS — база данных пептидаз. Архивировано 14 ноября 2006 г. на Wayback Machine.
- Список ингибиторов протеазы
- Предсказатель разрезания протеазы
- Список протеаз и их специфичность (см. также [1] Архивировано 30.04.2011 на Wayback Machine )
- Протеолиз MAP от Центра протеолитических путей
- База данных Proteolysis Cut Site — тщательно отобранные экспертные аннотации от пользователей
- Графический интерфейс сайтов разреза протеазы
- База данных протеаз TopFIND, охватывающая сайты разрезания, субстраты и концы белков
- Протеазы в рубриках медицинских предметов Национальной медицинской библиотеки США (MeSH)


