Протид
В этой статье есть несколько проблем. Помогите улучшить ее или обсудите эти проблемы на странице обсуждения . ( Узнайте, как и когда удалять эти сообщения )
|

Технология ProTide представляет собой подход пролекарств , используемый в молекулярной биологии и разработке лекарств . Она предназначена для доставки аналогов нуклеотидов (в виде монофосфата) в клетку (ProTide: PROdrug + nucleoTIDE). Эта технология была изобретена профессором Крисом Макгиганом из Школы фармацевтики и фармацевтических наук Кардиффского университета в начале 1990-х годов. ProTides являются важной частью противовирусных препаратов, таких как софосбувир , тенофовир алафенамид и ремдесивир . [1]
Разработка

Первая демонстрация подхода ProTide была сделана в 1992 году, когда была отмечена эффективность арилоксифосфатов и фосфорамидатов . [2] В частности, диарилфосфаты были получены из зидовудина (AZT) с использованием простой фосфорохлоридатной химии. Впервые активность этих фосфатных производных AZT против ВИЧ в некоторых случаях превысила активность родительского нуклеозида. Более того, в то время как AZT был почти неактивен ( EC 50 100 мкМ) в клеточной линии JM, замещенный диарилфосфат был в 10 раз активнее (EC 50 10 мкМ). В то время JM считался нечувствительным к AZT из-за слабого фосфорилирования. Позже выяснилось, что источником этой слабой чувствительности к AZT был насос оттока AZT. Однако заключение остается верным, что диарилфосфат был более способен сохранять активность в линии клеток JM, и что это может подразумевать (небольшую) степень внутриклеточной доставки фосфата. Электроноакцепторная способность p-нитрогрупп и предполагаемые улучшения в способности арильных уходящих групп были предложены в качестве основной движущей силы этого SAR.

Впоследствии была получена серия арилоксифосфорамидатов AZT с различными п-арильными заместителями и несколькими аминокислотами . [3] Эти соединения изучались исключительно в AZT-резистентной линии клеток JM для изучения потенциального (подразумеваемого) высвобождения AZT-монофосфата, при этом фосфорамидат аланина оказался исключительно эффективным. Во всех культурах JM, инфицированных ВИЧ-1 , AZT ингибировался при концентрации 100 мкМ, в то время как фосфорамидат фенилметоксиаланинила был активен при 0,8 мкМ. Это было воспринято как первое доказательство успешной доставки нуклеотидов . Также было отмечено, что в других сериях наблюдалось выраженное предпочтение аланина по сравнению с лейцином (в 10 раз) и глицином (>100 раз). Кроме того, хотя электроноакцепторное арильное замещение оказалось высокоэффективным в диариловых системах, в этом контексте оно было пагубным. Пара-фтор-замена имела небольшой побочный эффект, но незначительный, в то время как пара-нитро-замена привела к 100-кратной потере активности. В последующем исследовании диапазон арильных заместителей был расширен, и соединения были протестированы как в TK+ ( компетентных по тимидинкиназе ), так и в TK- (дефицитных по тимидинкиназе) клеточных линиях. Ни один из фосфорамидатов не сохранил высокую (2–4 нМ) активность AZT в TK-компетентных клеточных линиях (CEM и MT-4) против ВИЧ-1 или ВИЧ-2 . [4] Однако, в то время как AZT потерял всю свою активность в TK-дефицитной клеточной линии CEM/TK-, большинство фосфорамидатов сохранили противовирусную активность, таким образом, будучи примерно в 10–35 раз более активными, чем AZT в этом анализе. И снова аланин оказался важным компонентом, а аналог глицина оказался неактивным в инфицированных ВИЧ культурах CEM/TK- all. В этом анализе лейцин и фенилаланин были столь же эффективны, как аланин, хотя и менее эффективны в анализах CEM/TK+. Таким образом, родительский фенилметоксиаланилфосфорамидат оказался важным ведущим соединением.

Ставудин (d4T) был одним из первых применений подхода ProTide. [5] Это был рациональный выбор, основанный на известной кинетике фосфорилирования d4T. Таким образом, в то время как второе фосфорилирование (AZT-монофосфат в AZT-дифосфат), но не первое фосфорилирование (AZT в AZT-монофосфат) считается ограничивающим скорость активации AZT в трифосфат, первый шаг (d4T в d4T монофосфат) в целом считается медленным шагом для d4T. Таким образом, внутриклеточная доставка (моно)нуклеотида должна иметь максимальное воздействие на d4T и подобные нуклеозиды. В первом случае были получены (гало)алкилокси фосфорамидаты d4T, и было обнаружено, что они сохраняют активность в резистентных к d4T клетках JM. Активность зависела от галоалкильной группы; исходная пропильная система была слабоактивной. Последующие исследования в инфицированных ВИЧ культурах клеток CEM/TK- показали, что арилоксифосфорамидаты d4T являются высокоэффективными и, что примечательно, сохраняют свою полную активность в клетках CEM/TK-. В этом исследовании бензиловый эфир оказался немного более мощным, чем исходное метильное соединение, будучи почти в 10 раз более активным, чем d4T в анализах CEM/TK+ и, таким образом, примерно в 300-500 раз более активным, чем d4T, в анализах CEM/TK-.
Текущие приложения
Пролекарства ProTide полезны для доставки фосфонатсодержащих препаратов в типы клеток с высокой экспрессией CTSA и CES1 , такие как иммунные клетки. Тенофовир алафенамид является успешным примером этой итерации. ProTides также полезны для аналогов нуклеозидов, которые не фосфорилируются эффективно эндогенными нуклеозидкиназами. Для нуклеозида GS-334750, родителя софосбувира, фосфорилирование нуклеозидкиназами эффективно прекращается, и единственный способ доставить активный нуклеотид — через ProTide. Основным ограничением ProTides является то, что они требуют экспрессии эстераз, таких как CTSA и CES1, которая очень высока в некоторых типах клеток, таких как гепатоциты, и играет преимущество для лечения гепатита С софосбувиром.
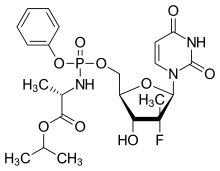
После этого были проведены обширные исследования этих многообещающих производных d4T, и технология ProTide была успешно применена к широкому спектру аналогов нуклеозидов. [6] [7] В частности, подход ProTide использовался для нескольких клинически оцененных аналогов нуклеозидов против вируса гепатита С , включая одобренное FDA в 2013 году соединение софосбувир и одобренное FDA в 2016 году соединение тенофовира алафенамид . Ремдесивир также использует технологию пролекарств ProTide (самосожжение является ключевым принципом нуклеотидных пролекарств ProTide [8] ). Поскольку нуклеозид GS-441524 может быть фосфорилирован и активирован, некоторые исследователи утверждают, что применение Protide является ненужным осложнением в конструкции Ремдесивира и что исходный нуклеозид был бы более дешевым и эффективным препаратом для лечения COVID-19 . [9] [10]
ProTides были протестированы на предмет доставки ключевых фосфорилированных метаболитов при врожденных нарушениях метаболизма, таких как фосфопантотенат при дефиците PANK2 , однако они не дали клинического результата. [11]
Ссылки
- ^ Mehellou Y, Rattan HS, Balzarini J (март 2018 г.). «Технология пролекарств ProTide: от концепции до клиники». Журнал медицинской химии . 61 (6): 2211–2226. doi :10.1021/acs.jmedchem.7b00734. PMC 7075648. PMID 28792763 .
- ^ McGuigan C, Pathirana RN, Mahmood N, Devine KG, Hay AJ (апрель 1992 г.). «Арилфосфатные производные AZT сохраняют активность против ВИЧ1 в клеточных линиях, устойчивых к действию AZT». Antiviral Research . 17 (4): 311–321. doi :10.1016/0166-3542(92)90026-2. PMID 1642482.
- ^ McGuigan C, Pathirana RN, Mahmood N, Hay AJ (июль 1992 г.). «Производные арилфосфата AZT ингибируют репликацию ВИЧ в клетках, где нуклеозид слабо активен». Bioorganic & Medicinal Chemistry Letters . 2 (7): 701–704. doi :10.1016/S0960-894X(00)80395-9.
- ^ McGuigan C, Pathirana RN, Balzarini J, De Clercq E (апрель 1993 г.). «Внутриклеточная доставка биоактивных нуклеотидов AZT с помощью арилфосфатных производных AZT». Журнал медицинской химии . 36 (8): 1048–1052. doi :10.1021/jm00060a013. PMID 8478904.
- ^ McGuigan C, Sheeka HM, Mahmood N, Hay A (июнь 1993 г.). «Фосфатные производные d4T как ингибиторы ВИЧ». Bioorganic & Medicinal Chemistry Letters . 3 (6): 1203–1206. doi :10.1016/S0960-894X(00)80315-7.
- ^ Cahard D, McGuigan C, Balzarini J (май 2004 г.). «Арилоксифосфорамидатные триэфиры как про-тиды». Mini Reviews in Medicinal Chemistry . 4 (4): 371–381. doi :10.2174/1389557043403936. PMID 15134540.
- ^ McGuigan C, Harris SA, Daluge SM, Gudmundsson KS, McLean EW, Burnette TC и др. (май 2005 г.). «Применение технологии фосфорамидатного пронуклеотида к абакавиру приводит к значительному повышению его противовирусной активности». Journal of Medicinal Chemistry . 48 (10): 3504–3515. doi :10.1021/jm0491400. PMID 15887959.
- ^ Прохазкова Е, Шимон П, Страка М, Фило Дж, Маек М, Циган М, Бащиньский О (январь 2021 г.). «Фосфатные линкеры с отслеживаемыми циклическими промежуточными соединениями для обнаружения и мониторинга самосожжения». Химические коммуникации . 57 (2): 211–214. дои : 10.1039/D0CC06928K. PMID 33300900. S2CID 228087795.
- ^ Ян ВК, Мюллер ФЛ (14 мая 2020 г.). «Gilead следует отказаться от ремдесивира и сосредоточиться на его более простом предшественнике». СТАТ .
- ^ Yan VC, Muller FL (июль 2020 г.). «Преимущества родительского нуклеозида GS-441524 по сравнению с ремдесивиром для лечения COVID-19». ACS Medicinal Chemistry Letters . 11 (7): 1361–1366. doi :10.1021/acsmedchemlett.0c00316. PMC 7315846. PMID 32665809 .
- ^ Keown A (22 августа 2019 г.). «Лекарство Retrophin для лечения PKAN на поздней стадии не сравнится с плацебо». BioSpace .



