Фитаноил-КоА-диоксигеназа
| фитаноил-КоА диоксигеназа | |||||||||
|---|---|---|---|---|---|---|---|---|---|
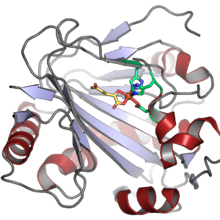 Структура человеческого PAHX ( PDB : 2A1X ). Кофактор Fe(II) показан как оранжевая сфера, координированная двумя остатками гистидина и одним аспартатом (показаны зеленым) и косубстратом 2-оксоглутарата (показаны желтым). [1] | |||||||||
| Идентификаторы | |||||||||
| Номер ЕС | 1.14.11.18 | ||||||||
| Номер CAS | 185402-46-4 | ||||||||
| Базы данных | |||||||||
| ИнтЭнз | IntEnz вид | ||||||||
| БРЕНДА | запись BRENDA | ||||||||
| ExPASy | NiceZyme вид | ||||||||
| КЕГГ | запись KEGG | ||||||||
| МетаЦик | метаболический путь | ||||||||
| ПРИАМ | профиль | ||||||||
| Структуры PDB | RCSB PDB PDBe PDBsum | ||||||||
| Генная онтология | AmiGO / QuickGO | ||||||||
| |||||||||
| фитаноил-КоА 2-гидроксилаза | |||||||
|---|---|---|---|---|---|---|---|
| Идентификаторы | |||||||
| Символ | ФИХ | ||||||
| Альтернативные символы | ПАХХ | ||||||
| ген NCBI | 5264 | ||||||
| HGNC | 8940 | ||||||
| ОМИМ | 602026 | ||||||
| РефСек | NM_001037537 | ||||||
| UniProt | О14832 | ||||||
| Другие данные | |||||||
| Локус | Хр. 10 стр. 15.3-10 стр. 12.2 | ||||||
| |||||||
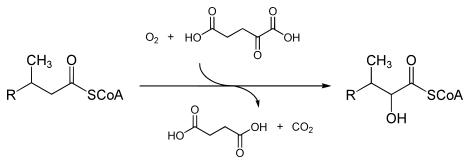
В энзимологии фитаноил -КоА-диоксигеназа ( КФ 1.14.11.18) — это фермент , катализирующий химическую реакцию
- фитаноил-КоА + 2-оксоглутарат + O 2 2-гидроксифитаноил-КоА + сукцинат + CO 2
Тремя субстратами этого фермента являются фитаноил -КоА , 2-оксоглутарат ( 2OG) и O2 , тогда как его тремя продуктами являются 2-гидроксифитаноил-КоА, сукцинат и CO2 .
Этот фермент принадлежит к семейству железо(II)-зависимых оксигеназ , которые обычно включают один атом дикислорода в субстрат и один атом в сукцинаткарбоксилатную группу. Механизм сложный, но считается, что он включает упорядоченное связывание 2-оксоглутарата с ферментом, содержащим железо(II), за которым следует субстрат. Связывание субстрата вызывает смещение молекулы воды из кофактора железа(II), оставляя вакантное положение координации, с которым связывается дикислород. Происходит перегруппировка с образованием высокоэнергетических железо-кислородных видов (которые обычно считаются видами железа(IV)=O), которые выполняют фактическую реакцию окисления. [2] [3]
Номенклатура
Систематическое название этого класса ферментов — фитаноил-КоА, 2-оксоглутарат: кислород оксидоредуктаза (2-гидроксилирование) . Эти ферменты также называются фитаноил-КоА гидроксилазами и фитаноил-КоА альфа-гидроксилазами . [4]
Примеры
У людей фитаноил-КоА-гидроксилаза кодируется геном PHYH ( он же PAHX ) и необходима для альфа-окисления жирных кислот с разветвленной цепью (например, фитановой кислоты ) в пероксисомах . Дефицит PHYH приводит к накоплению больших запасов фитановой кислоты в тканях и является основной причиной болезни Рефсума . [5]
Родственные ферменты
Оксигеназы, зависящие от железа (II) и 2OG, распространены в микроорганизмах , растениях и животных; предполагается, что геном человека содержит около 80 примеров, а модельное растение Arabidopsis thaliana, вероятно, содержит больше. [2] В растениях и микроорганизмах это семейство ферментов связано с большим разнообразием окислительных реакций. [6]
Ссылки
- ^ McDonough MA, Kavanagh KL, Butler D, Searls T, Oppermann U, Schofield CJ (декабрь 2005 г.). «Структура человеческой фитаноил-КоА 2-гидроксилазы определяет молекулярные механизмы болезни Рефсума». Журнал биологической химии . 280 (49): 41101– 10. doi : 10.1074/jbc.M507528200 . PMID 16186124.
- ^ ab Hausinger RP (2015). "ГЛАВА 1. Биохимическое разнообразие 2-оксоглутарат-зависимых оксигеназ". 2-оксоглутарат-зависимые оксигеназы . Металлобиология. стр. 1– 58. doi :10.1039/9781782621959-00001. ISBN 978-1-84973-950-4. S2CID 85596364.
- ^ Мартинес С., Хаузингер Р. П. (август 2015 г.). «Каталитические механизмы оксигеназ, зависимых от Fe(II) и 2-оксоглутарата». Журнал биологической химии . 290 (34): 20702– 11. doi : 10.1074 /jbc.R115.648691 . PMC 4543632. PMID 26152721.
- ^ "PHYH фитаноил-КоА 2-гидроксилаза [ Homo sapiens (человек) ]". Национальный центр биотехнологической информации .
- ^ Михалик С.Дж., Моррелл Дж.К., Ким Д., Сакстедер К.А., Уоткинс П.А., Гулд С.Дж. (октябрь 1997 г.). «Идентификация PAHX, гена болезни Рефсума». Природная генетика . 17 (2): 185–9 . doi : 10.1038/ng1097–185. PMID 9326939. S2CID 39214017.
- ^ McDonough MA, Loenarz C, Chowdhury R, Clifton IJ, Schofield CJ (декабрь 2010 г.). «Структурные исследования оксигеназ, зависимых от 2-оксоглутарата человека». Current Opinion in Structural Biology . 20 (6): 659–72 . doi :10.1016/j.sbi.2010.08.006. PMID 20888218.
Дальнейшее чтение
- Jansen GA, Mihalik SJ, Watkins PA, Jakobs C, Moser HW, Wanders RJ (март 1998 г.). «Характеристика фитаноил-коэнзима А гидроксилазы в печени человека и измерения активности у пациентов с пероксисомальными расстройствами». Clinica Chimica Acta; Международный журнал клинической химии . 271 (2): 203– 11. doi : 10.1016/S0009-8981(97)00259-3 . PMID 9565335.
- Jansen GA, Mihalik SJ, Watkins PA, Moser HW, Jakobs C, Denis S, Wanders RJ (декабрь 1996 г.). «Фитаноил-КоА-гидроксилаза присутствует в печени человека, расположена в пероксисомах и дефицитна при синдроме Цельвегера: прямое, недвусмысленное доказательство нового, пересмотренного пути альфа-окисления фитановой кислоты у людей». Biochemical and Biophysical Research Communications . 229 (1): 205– 10. doi : 10.1006/bbrc.1996.1781 . PMID 8954107.
- Янсен Г.А., Офман Р., Фердинандусс С., Ийлст Л., Мьюйсерс А.О., Скьельдал О.Г., Стокке О., Якобс С., Бесли Г.Т., Рэйт Дж.Э., Вандерс Р.Дж. (октябрь 1997 г.). «Болезнь Рефсума вызвана мутациями в гене фитаноил-КоА-гидроксилазы». Природная генетика . 17 (2): 190–3 . doi : 10.1038/ng1097–190. PMID 9326940. S2CID 5856245.
- Mihalik SJ, Rainville AM, Watkins PA (сентябрь 1995 г.). «Альфа-окисление фитановой кислоты в пероксисомах печени крысы. Производство альфа-гидроксифитаноил-КоА и формиата усиливается кофакторами диоксигеназы». European Journal of Biochemistry . 232 (2): 545–51 . doi : 10.1111/j.1432-1033.1995.545zz.x . PMID 7556205.
Внешние ссылки
- GeneReviews/NCBI/NIH/UW запись о болезни Рефсума