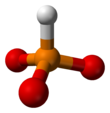
Фосфит-анион
 | |||
| |||
| Имена | |||
|---|---|---|---|
| Название ИЮПАК Фосфонат | |||
| Систематическое название ИЮПАК Фосфит [1] | |||
| Идентификаторы | |||
3D модель ( JSmol ) |
| ||
| ЧЭБИ | |||
| ChemSpider | |||
| 1618 | |||
| МеШ | фосфорит | ||
CID PubChem |
| ||
Панель инструментов CompTox ( EPA ) |
| ||
| |||
| Характеристики | |||
| ХПО2− 3 | |||
| Молярная масса | 79,9810 г моль −1 | ||
| Родственные соединения | |||
Другие анионы | Фосфинит | ||
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |||
Фосфитный анион или фосфит в неорганической химии обычно относится к [HPO 3 ] 2− , но включает [H 2 PO 3 ] − ([HPO 2 (OH)] − ). Эти анионы являются сопряженными основаниями фосфористой кислоты (H 3 PO 3 ). Соответствующие соли, например, фосфит натрия (Na 2 HPO 3 ), имеют восстановительный характер.
Номенклатура
Рекомендованное ИЮПАК название фосфористой кислоты — фосфоновая кислота . Соответственно, рекомендуемое ИЮПАК название для HPO2−
3ion — фосфонат . В США правила наименования ИЮПАК для неорганических соединений преподаются в старших классах школы, но не являются «обязательной» частью учебной программы. [2] Известный учебник университетского уровня следует рекомендациям ИЮПАК. [3] На практике любое упоминание «фосфита» должно быть исследовано, чтобы определить используемое правило наименования.
Соли, содержащие HPO32−, называемые фосфонатами или фосфитами

Структурная формула Na2HPO3 . Анион имеет симметрию C3v .
С коммерческой точки зрения наиболее важной фосфитной солью является основной фосфит свинца . Многие соли , содержащие фосфит-ион , были исследованы структурно, в том числе пентагидрат фосфита натрия ( Na2HPO3 ·5H2O ) . (NH4 ) 2HPO3 · H2O , CuHPO3 · H2O , SnHPO3 и Al2 ( HPO3 ) 3 · 4H2O . [ 4] Структура HPO2−
3приблизительно тетраэдрический. [5] [6]
ХПО2−
3имеет ряд канонических резонансных форм, что делает его изоэлектронным с бисульфит -ионом HSO−
3, который имеет похожую структуру. [7]

Соли, содержащие HP(O)2ОЙ−
Кислотные или водородные фосфиты называются гидрофосфонатами или кислотными фосфитами. ИЮПАК рекомендует название гидрофосфонаты). Они являются анионами HP(O) 2OH− . Типичным производным является соль [NH4 ] [HP(O) 2OH ] . [ 7] [6] Известно много родственных солей, например, RbHPHO3 , CsHPHO3 , TlHPHO3 . Эти соли получают путем обработки фосфористой кислоты карбонатом металла . Эти соединения содержат полимерный анион слоя, состоящий из тетраэдров HPO3, связанных водородными связями. Эти слои перемежаются слоями катионов металлов. [8]
Органические эфиры фосфитов водорода представляют собой анионы с формулой HP(O) 2 OR − (R = органическая группа). Одним из коммерческих примеров является фунгицид фосетил-Al с формулой [C 2 H 5 OP(H)O 2 ] 3 Al. [9]
Соли, содержащие H2П2О52−, называемые дифосфитами или пирофосфитами
Пирофосфиты (дифосфиты) можно получить путем осторожного нагревания кислых фосфитов при пониженном давлении. Они содержат ион H
2П
2О2−
5, который можно сформулировать как [HP(O) 2 O−P(O) 2 H] 2− . [7] [6]
Параллели в химии мышьяка
В отличие от недостатка доказательств в пользу PO3−
3, соответствующий ион мышьяка, ортоарсенит , AsO3−
3известен. Примером может служить Ag 3 AsO 3 , а также полимерный метаарсенит (AsO−
2)
н[7] Изоэлектронный сульфит - ион, SO2−
3известен из его солей. [7]
Использовать в качестве фунгицидов
В этом разделе отсутствует информация о механизме противогрибкового/противопротозойного действия. ( Март 2022 г. ) |
Неорганические фосфиты (содержащие HPO2−
3) применялись к сельскохозяйственным культурам для борьбы с грибкоподобными патогенами порядка оомицетов (водяная плесень). Ситуация запутанная из-за сходства названий фосфита и фосфата (основного питательного вещества для растений и ингредиента удобрений ), и спорная из-за того, что фосфиты иногда рекламировались как удобрения, хотя они слишком медленно превращаются в фосфат, чтобы служить основным источником фосфора для растений. Фактически, фосфиты могут вызывать фитотоксичность, когда растение испытывает нехватку фосфатов. [10] Лемуани [11] и другие описали эту сложную ситуацию и отметили, что называя фосфиты удобрениями, мы избежали нормативных осложнений и негативного общественного восприятия, которые могли возникнуть при регистрации их в качестве фунгицидов. [10]
Основной формой неорганического фосфита, используемого в сельском хозяйстве, является монокалиевый фосфит . Это соединение служит в качестве калийного удобрения.
Смотрите также
- Гипофосфит – Н
2ПО−
2 - Фосфорорганические соединения
- Фосфин – PH 3 и органические фосфины PR 3
- Оксид фосфина – OPR 3
- Фосфинит – P(OR)R 2
- Фосфонит – P(OR) 2 R
- Фосфинат – OP(OR)R 2
- Фосфонат – органические фосфонаты OP(OR) 2 R
- Фосфат – PO3−
4 - Органофосфат – OP(OR) 3
Дальнейшее чтение
- А. Эрншоу; Норман Гринвуд (1997). Химия элементов (2-е изд.). С. 513–514.
Ссылки
- ^ "Phosphorite - PubChem Public Chemical Database". Проект PubChem . США: Национальный центр биотехнологической информации.
- ^ Физическая обстановка/основная учебная программа по химии, Университет штата Нью-Йорк, Департамент образования штата, http://www.p12.nysed.gov/ciai/mst/pub/chemist.pdf Архивировано 29.03.2018 на Wayback Machine
- ^ Эгон Виберг, Арнольд Фредерик Холлеман (2001) Неорганическая химия , Elsevier ISBN 0-12-352651-5
- ^ "Синтез и кристаллические структуры фосфитов алюминия и железа", DM Poojary, Y. Zhang, DE Cox, PR Rudolf, S. Cheng & A. Clearfield, J. Chem. Crystallogr. 24 (1994) 155–163
- ^ LE Gordon, WTA Harrison. "Бис(меламин)гидрофосфит тетрагидрат". Acta Crystallogr. 59 (2): o195–o197. doi :10.1107/S1600536803001247
- ^ abc "Кристаллохимия неорганических фосфитов", J. Loub, Acta Crystallogr. (1991), B47 , 468–473, doi :10.1107/S0108768191002380
- ^ abcde Гринвуд, Норман Н .; Эрншоу, Алан (1997). Химия элементов (2-е изд.). Баттерворт-Хайнеманн . ISBN 978-0-08-037941-8.
- ^ Костерина EV, Троянов SI, Кемниц E, Асланов LA (2001). "Синтез и кристаллическая структура кислых фосфитов RbH 2 PO 3 , CsH 2 PO 3 , и TlH 2 PO 3 ". Журнал координационной химии . 27 (7): 458–462. doi :10.1023/A:1011377229855. S2CID 91297300.
- ^ Франц Мюллер; Петер Акерманн; Пол Марго (2012). "Фунгициды, сельскохозяйственные, 2. Отдельные фунгициды". Энциклопедия промышленной химии Ульмана . Вайнхайм: Wiley-VCH. doi :10.1002/14356007.o12_o06. ISBN 978-3-527-30673-2.
- ^ ab Thao; Yamakawa (2008). «Фосфит (фосфорная кислота): фунгицид, удобрение или биостимулятор?». Почвоведение и питание растений . 55 (2): 228–234. doi : 10.1111/j.1747-0765.2009.00365.x . S2CID 95723306.
- ^ «Фосфиты и фосфаты: когда дистрибьюторы и производители могут запутаться!» Жан-Пьер Леймони. Предоставлено New Ag International, выпуск за сентябрь 2007 г.