Пертузумаб
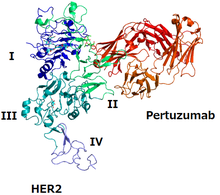 Структура HER2 и пертузумаба | |
| Моноклональное антитело | |
|---|---|
| Тип | Целое антитело |
| Источник | Очеловеченный (от мыши ) |
| Цель | HER2 |
| Клинические данные | |
| Торговые наименования | Перьета |
| Другие имена | 2С4 |
| Данные лицензии |
|
Категория беременности |
|
| Пути введения | Внутривенно |
| код АТС |
|
| Правовой статус | |
| Правовой статус |
|
| Идентификаторы | |
| Номер CAS | |
| DrugBank | |
| ChemSpider |
|
| УНИИ |
|
| КЕГГ | |
| ChEMBL | |
 Н Н И (что это?) (проверить) И (что это?) (проверить) | |
Пертузумаб , продаваемый под торговой маркой Перьета , представляет собой моноклональное антитело, используемое в сочетании с трастузумабом и доцетакселом для лечения метастатического HER2 -положительного рака молочной железы; он также используется в той же комбинации в качестве неоадъювантной терапии при раннем HER2-положительном раке молочной железы. [4]
Побочные эффекты у более чем половины людей, принимающих его, включают диарею, выпадение волос и потерю нейтрофилов ; более 10% испытывают потерю эритроцитов , гиперчувствительность или аллергическую реакцию, инфузионные реакции, снижение аппетита, бессонницу, искажение вкусовых ощущений, воспаление рта или губ, запор, сыпь, заболевание ногтей и мышечные боли. [3] Женщины, которые беременны или планируют забеременеть, не должны принимать его, он не изучался на людях с определенными заболеваниями сердца и должен использоваться с осторожностью у таких людей, и его не следует использовать с антрациклином . [ 3] Неизвестно, взаимодействует ли пертузумаб с доксорубицином . [3]
Это первый в своем классе препарат, называемый « ингибитором димеризации HER » — он ингибирует димеризацию HER2 с другими рецепторами HER, что не позволяет им передавать сигналы способами, способствующими росту и пролиферации клеток. [6]
Он был открыт и разработан компанией Genentech и впервые одобрен в 2012 году. [7] [8]
Медицинское применение
Пертузумаб вводят в виде внутривенной инфузии в сочетании с трастузумабом и доцетакселом в качестве терапии первой линии для HER2-положительного метастатического рака молочной железы. [4] [3] Он также используется в той же комбинации в качестве неоадъювантной терапии (вводится для уменьшения размера опухоли перед хирургическим вмешательством или облучением) для HER2-положительного раннего рака молочной железы; по состоянию на 2016 год не было показано, что такое использование увеличивает выживаемость. [4]
По состоянию на 2016 год [обновлять]пертузумаб не изучался у людей со значением фракции выброса левого желудочка ≤ 50% от нормы, предшествующей историей застойной сердечной недостаточности или состояниями, которые могут нарушить функцию левого желудочка, такими как неконтролируемая гипертония, недавние сердечные приступы или серьезная сердечная аритмия. [3] Следует соблюдать осторожность при сочетании пертузумаба с антрациклином . [ 3] Также отсутствуют данные по безопасности использования пертузумаба в сочетании с доксорубицином . [3]
Женщинам детородного возраста следует использовать контрацепцию во время приема пертузумаба; он может нанести вред плоду у беременных женщин и может секретироваться в грудное молоко. [3]
Побочные эффекты
В клинических испытаниях комбинированной терапии из трех агентов при метастатическом раке молочной железы побочные эффекты, возникавшие у более чем половины людей, принимавших ее, включали диарею, выпадение волос и потерю нейтрофилов ; более 10% людей испытали потерю нейтрофилов с лихорадкой и потерю лейкоцитов . [3] После того, как доцетаксел был отменен у некоторых людей, наиболее распространенными побочными эффектами были диарея (28,1%), инфекция верхних дыхательных путей (18,3%), сыпь (18,3%), головная боль (17,0%), усталость (13,4%), отек носовых ходов и горла (часто из-за простуды) (17,0%), слабость (13,4%), зуд (13,7%), боль в суставах (11,4%), тошнота (12,7%), боль в конечности (13,4%), боль в спине (12,1%) и кашель (12,1%). [3]
В клинических испытаниях неоадъювантного использования комбинации более чем у 50% людей наблюдалась потеря волос и потеря нейтрофилов . [3]
При обоих вариантах применения более 10% людей дополнительно испытывали: потерю эритроцитов , гиперчувствительность или аллергическую реакцию, инфузионные реакции, снижение аппетита, бессонницу, искажение вкусовых ощущений, воспаление полости рта или губ, запор, сыпь, заболевание ногтей и мышечные боли. [3]
Фармакология
Метаболизм пертузумаба не изучался напрямую; в целом антитела выводятся в основном путем катаболизма . Медианный клиренс пертузумаба составил 0,235 л/день, а медианный период полувыведения — 18 дней. [3]
Механизм действия
HER2 — это внеклеточный рецептор — рецептор тирозинкиназы , который при активации запускает сигнальную трансдукцию через несколько путей , которые стимулируют пролиферацию и рост клеток; при чрезмерной экспрессии он может вызвать неконтролируемый рост. HER2-положительный рак груди вызывается амплификацией гена ERBB2, которая приводит к сверхэкспрессии HER2 примерно в 15–30 % опухолей груди. [9]
Как и многие рецепторы, HER2 обычно объединяет другой белок для функционирования (процесс, называемый димеризацией ); он может связываться со вторым рецептором HER2 (действуя как гомодимер ) и может гетеродимеризоваться с другим рецептором семейства HER . Наиболее мощным димером для активации сигнальных путей является HER2/HER3. [6]
Эпитоп для пертузумаба — это домен HER2, где он связывается с HER3, и пертузумаб предотвращает образование димера HER2/HER3, что блокирует передачу сигналов димером. [6] [10] Трастузумаб — это еще одно моноклональное антитело против HER2; его эпитоп — это домен, где HER2 связывается с другим белком HER2. [6] Два моноклональных антитела вместе предотвращают функционирование HER2. [6]
Химия и производство
Пертузумаб представляет собой иммуноглобулин G1 с вариабельной областью против человеческого белка HER2, моноклональной тяжелой цепи 2C4 человека-мыши, связанной дисульфидом с моноклональной κ-цепью 2C4 человека-мыши. [11]
Он производится рекомбинантным методом в клетках CHO . [4]
История
Моноклональное антитело 2C4, по-видимому, впервые было опубликовано в 1990 году учеными из Genentech [12] в том же году, когда F. Hoffmann-La Roche AG приобрела контрольный пакет акций Genentech. [13]
К 2003 году Genentech поняла, что 2C4 предотвращает димеризацию HER2 с другими рецепторами HER, и начала испытания фазы I, нацеленные на широкий спектр видов рака, а не только на те, которые сверхэкспрессируют HER2. Это был первый известный ингибитор димеризации HER. [14]
В 2005 году компания Genentech представила неудовлетворительные результаты испытаний фазы II пертузумаба в качестве монотерапии при раке предстательной железы, молочной железы и яичников и заявила, что намерена продолжить его разработку в сочетании с другими препаратами для лечения рака яичников. [15] [16]
В 2007 году Genentech отказалась от торговой марки Omnitarg. [17] [18]
В марте 2009 года компания Roche приобрела Genentech. [19] [20]
В 2012 году были опубликованы результаты исследования CLEOPATRA, рандомизированного плацебо-контролируемого исследования фазы III пертузумаба в сочетании с трастузумабом и доцетакселом при HER2-положительном метастатическом раке молочной железы. [21] Пертузумаб получил одобрение FDA США для лечения HER2-положительного метастатического рака молочной железы позднее в том же году. [8] Результаты исследования фазы II в неоадъювантной терапии NeoSphere, опубликованные в 2012 году, [22] и результаты исследования сердечной безопасности фазы II в той же популяции Tryphaena, опубликованные в 2013 году. [23] FDA одобрило неоадъювантное показание в 2013 году. [24]
Пертузумаб был одобрен для медицинского применения в Европейском Союзе в 2013 году. [3] [5]
Общество и культура
Экономика
По состоянию на 2016 год [обновлять]в США каждый цикл трехкомпонентной комбинации препаратов, вводимой каждые три недели, обходится примерно в 8500 долларов США , не включая расходы на вспомогательную помощь. [25]
В Великобритании оценка NICE в 2015 году сделала предварительный вывод о том, что комбинация препаратов не была экономически эффективной, и NICE отклонил препарат в неоадъювантном режиме в мае 2016 года, в первую очередь потому, что было неизвестно, обеспечивает ли комбинация препаратов преимущество в плане выживаемости. [26] [27] [28] Это решение было впоследствии отменено шесть месяцев спустя, и пертузумаб стал первым новым препаратом для лечения рака молочной железы, одобренным NICE для планового финансирования NHS почти за десятилетие после того, как Roche пообещала предоставлять препарат NHS с нераскрытой скидкой для пациентов в неоадъювантном режиме и разделить долгосрочные финансовые риски. [29]
Ссылки
- ^ ab "АВСТРАЛИЙСКАЯ ИНФОРМАЦИЯ О ПРОДУКТЕ – Perjeta® (пертузумаб)" . Получено 12 июля 2024 г. .
- ^ «Список всех препаратов с предупреждениями в черном ящике, составленный FDA (используйте ссылки «Загрузить полные результаты» и «Просмотреть запрос»). nctr-crs.fda.gov . FDA . Получено 22 октября 2023 г. .
- ^ abcdefghijklmno "Perjeta 420 мг Концентрат для приготовления раствора для инфузий — Краткое описание характеристик продукта (SmPC)". (emc) . 2 июля 2021 г. Архивировано из оригинала 3 января 2022 г. Получено 3 января 2022 г.
- ^ abcde "Perjeta- pertuzumab injection, solution, concentrate". DailyMed . Архивировано из оригинала 25 марта 2021 г. Получено 3 января 2022 г.
- ^ ab "Perjeta EPAR". Европейское агентство по лекарственным средствам (EMA) . 17 сентября 2018 г. Архивировано из оригинала 16 сентября 2021 г. Получено 3 января 2022 г.
- ^ abcde Harbeck N, Beckmann MW, Rody A, Schneeweiss A, Müller V, Fehm T и др. (март 2013 г.). "Ингибитор димеризации HER2 Пертузумаб — способ действия и клинические данные при раке молочной железы". Breast Care . 8 (1): 49–55. doi :10.1159/000346837. PMC 3971793 . PMID 24715843.
- ^ "Пакет одобрения препарата: инъекция Перьета (пертузумаб) NDA #125409". Управление по контролю за продуктами и лекарствами США (FDA) . 3 августа 2012 г. Архивировано из оригинала 3 января 2022 г. Получено 3 января 2022 г.
- ^ ab "FDA одобряет препарат Перьета для лечения рака молочной железы на поздней стадии". Управление по контролю за продуктами и лекарствами США (FDA) . 8 июня 2012 г. Архивировано из оригинала 1 ноября 2012 г. Получено 3 января 2022 г.
- ^ Митри З., Константин Т., О'Реган Р. (2012). «Рецептор HER2 при раке молочной железы: патофизиология, клиническое использование и новые достижения в терапии». Исследования и практика химиотерапии . 2012 : 743193. doi : 10.1155/2012/743193 . PMC 3539433. PMID 23320171 .
- ^ Badache A, Hynes NE (апрель 2004 г.). «Новое терапевтическое антитело маскирует ErbB2 для своих партнеров». Cancer Cell . 5 (4): 299–301. doi : 10.1016/s1535-6108(04)00088-1 . PMID 15093533.
- ^ "Proposed INN: List 89" (PDF) . WHO Drug Information . 17 (3). 2003. Архивировано (PDF) из оригинала 9 августа 2020 г. . Получено 5 октября 2020 г. .
- ^ Fendly BM, Winget M, Hudziak RM, Lipari MT, Napier MA, Ullrich A (март 1990 г.). «Характеристика мышиных моноклональных антител, реагирующих либо на рецептор человеческого эпидермального фактора роста, либо на продукт гена HER2/neu» (PDF) . Cancer Research . 50 (5): 1550–1558. PMID 1689212. Архивировано (PDF) из оригинала 29 сентября 2019 г. . Получено 2 ноября 2016 г. ., упоминается в Molina MA, Codony-Servat J, Albanell J, Rojo F, Arribas J, Baselga J (июнь 2001 г.). «Трастузумаб (герцептин), гуманизированное моноклональное антитело к рецептору Her2, ингибирует базальное и активированное расщепление эктодомена Her2 в клетках рака груди» (PDF) . Cancer Research . 61 (12): 4744–4749. PMID 11406546. Архивировано (PDF) из оригинала 29 сентября 2019 г. . Получено 2 ноября 2016 г. .
- ↑ Fisher LM (1 октября 2000 г.). «Genentech: Survivor Strutting Its Stuff». The New York Times . Архивировано из оригинала 20 декабря 2016 г. Получено 19 февраля 2017 г.
- ^ Albanell J, Codony J, Rovira A, Mellado B, Gascón P (2003). "Механизм действия моноклональных антител против Her2: научное обновление по трастузумабу и 2c4". Новые тенденции в онкологии в 21 веке . Достижения экспериментальной медицины и биологии. Т. 532. Springer. С. 253–68. doi :10.1007/978-1-4615-0081-0_21. ISBN 978-0-306-47762-1. PMID 12908564.
- ^ "Пресс-релиз: данные клинической программы Omnitarg, представленные на встрече Американского общества клинической онкологии". Genentech. 15 мая 2005 г. Архивировано из оригинала 6 апреля 2017 г. Получено 2 ноября 2016 г.
- ^ "Genentech's Omnitarg терпит неудачу во второй фазе". Pharma Times . 16 мая 2005 г. Архивировано из оригинала 24 февраля 2021 г. Получено 2 ноября 2016 г.
- ^ "Исправление: Письмо от редактора". Cancer Oncology News : 3. Февраль 2012. Архивировано из оригинала 4 ноября 2016. Получено 2 ноября 2016 .
- ^ "Пресс-релиз: Roche в первой половине 2007 года". Roche. 19 июля 2007 года. Архивировано из оригинала 4 ноября 2016 года . Получено 2 ноября 2016 года .
- ^ Morse A (10 мая 2006 г.). «Chugai Shares Post Healthy Gain On Prospects for Cancer Drug». The Wall Street Journal . Архивировано из оригинала 20 октября 2021 г. Получено 26 сентября 2008 г.
- ^ "Roche Makes $43.7B Bid for Genentech". Новости генной инженерии и биотехнологии . 21 июля 2008 г. Архивировано из оригинала 3 февраля 2009 г. Получено 26 сентября 2008 г.
- ^ Baselga J, Cortés J, Kim SB, Im SA, Hegg R, Im YH и др. (январь 2012 г.). «Пертузумаб плюс трастузумаб плюс доцетаксел при метастатическом раке груди». The New England Journal of Medicine . 366 (2): 109–119. doi : 10.1056/nejmoa1113216. PMC 5705202. PMID 22149875.
- ^ Gianni L, Pienkowski T, Im YH, Roman L, Tseng LM, Liu MC и др. (январь 2012 г.). «Эффективность и безопасность неоадъювантной терапии пертузумабом и трастузумабом у женщин с местнораспространенным, воспалительным или ранним HER2-положительным раком груди (NeoSphere): рандомизированное многоцентровое открытое исследование фазы 2». The Lancet. Онкология . 13 (1): 25–32. doi :10.1016/s1470-2045(11)70336-9. PMID 22153890.цитируется в Mates M, Fletcher GG, Freedman OC, Eisen A, Gandhi S, Trudeau ME, Dent SF (март 2015 г.). «Системная целевая терапия раннего женского рака груди с положительным результатом на her2: систематический обзор доказательств для руководства по системной терапии Cancer Care Ontario 2014 г.». Current Oncology . 22 (Suppl 1): S114–S122. doi :10.3747/co.22.2322. PMC 4381787 . PMID 25848335.
- ^ Schneeweiss A, Chia S, Hickish T, Harvey V, Eniu A, Hegg R и др. (сентябрь 2013 г.). «Пертузумаб плюс трастузумаб в сочетании со стандартными неоадъювантными схемами химиотерапии, содержащими антрациклин и не содержащими антрациклин, у пациентов с HER2-положительным ранним раком молочной железы: рандомизированное исследование сердечной безопасности фазы II (TRYPHAENA)». Annals of Oncology . 24 (9): 2278–2284. doi : 10.1093/annonc/mdt182 . PMID 23704196.
- ^ "FDA одобряет препарат Перьета для неоадъювантного лечения рака молочной железы". Управление по контролю за продуктами и лекарствами США (FDA) (пресс-релиз). 30 сентября 2013 г. Архивировано из оригинала 10 октября 2013 г. Получено 3 января 2022 г.
- ^ Durkee BY, Qian Y, Pollom EL, King MT, Dudley SA, Shaffer JL и др. (март 2016 г.). «Экономическая эффективность пертузумаба при метастатическом раке молочной железы с положительным рецептором эпидермального фактора роста 2 человека». Журнал клинической онкологии . 34 (9): 902–909. doi :10.1200/jco.2015.62.9105. PMC 5070553. PMID 26351332 .
- ^ Fleeman N, Bagust A, Beale S, Dwan K, Dickson R, Proudlove C, Dundar Y (январь 2015 г.). «Пертузумаб в сочетании с трастузумабом и доцетакселом для лечения HER2-положительного метастатического или локально рецидивирующего неоперабельного рака молочной железы». PharmacoEconomics . 33 (1): 13–23. doi :10.1007/s40273-014-0206-2. PMID 25138171. S2CID 8470253.
- ^ "Рак молочной железы (HER2-положительный, метастатический) - пертузумаб (с трастузумабом и доцетакселом) [ID523]". NICE. 1 сентября 2016 г. Архивировано из оригинала 4 ноября 2016 г. Получено 2 ноября 2016 г.
- ^ McKee S (20 мая 2016 г.). «NICE отклоняет препарат Roche для лечения рака груди Perjeta». Pharma Times . Архивировано из оригинала 3 марта 2021 г. Получено 2 ноября 2016 г.
- ^ Yip A (22 ноября 2016 г.). "NICE разворачивается и отменяет одобрение препарата Перьета компании Roche для лечения HER2-положительного рака молочной железы". Pharmalive . Архивировано из оригинала 7 апреля 2017 г. . Получено 7 апреля 2017 г. .
Дальнейшее чтение
- Дин Л. (2015). «Терапия пертузумабом и генотип ERBB2 (HER2)». В Pratt VM, McLeod HL, Rubinstein WS и др. (ред.). Medical Genetics Summaries. Национальный центр биотехнологической информации (NCBI). PMID 28520364. Идентификатор книжной полки: NBK315949.
