РОЗОВЫЙ1
| РОЗОВЫЙ1 | |||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Идентификаторы | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Псевдонимы | PINK1 , BRPK, PARK6, предполагаемая киназа 1, индуцированная PTEN, киназа 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Внешние идентификаторы | ОМИМ : 608309; МГИ : 1916193; гомологен : 32672; GeneCards : PINK1; OMA :PINK1 — ортологи | ||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Викиданные | |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
PTEN -индуцированная киназа 1 ( PINK1 ) — это митохондриальная серин/треонин-протеинкиназа, кодируемая геном PINK1 . [5] [6]
Считается, что он защищает клетки от вызванной стрессом митохондриальной дисфункции. Активность PINK1 заставляет белок паркин связываться с деполяризованными митохондриями, чтобы вызвать аутофагию этих митохондрий. [7] [8] PINK1 обрабатывается здоровыми митохондриями и высвобождается, чтобы запустить нейронную дифференциацию. [9] Мутации в этом гене вызывают одну из форм аутосомно-рецессивной болезни Паркинсона с ранним началом . [10]
Структура
PINK1 синтезируется как белок массой 63000 Да , который часто расщепляется PARL между остатками 103-аланина и 104-фенилаланина на фрагмент массой 53000 Да. [11] PINK1 содержит N-концевую последовательность митохондриальной локализации, предполагаемую трансмембранную последовательность, домен киназы Ser/Thr и C-концевую регуляторную последовательность. Было обнаружено, что белок локализуется на внешней мембране митохондрий, но также может быть обнаружен по всему цитозолю. Эксперименты показывают, что домен киназы Ser/Thr обращен наружу к цитозолю, что указывает на возможную точку взаимодействия с паркином. [12]
Структура PINK1 была решена и показывает, как белок связывает и фосфорилирует свой субстрат убиквитин. [13]
Функция
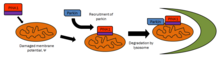
PINK1 тесно связан с контролем качества митохондрий, выявляя поврежденные митохондрии и направляя конкретные митохондрии на деградацию . Здоровые митохондрии поддерживают мембранный потенциал, который может быть использован для импорта PINK1 во внутреннюю мембрану, где он расщепляется PARL и очищается от внешней мембраны. Сильно поврежденные митохондрии не имеют достаточного мембранного потенциала для импорта PINK1, который затем накапливается на внешней мембране. Затем PINK1 привлекает паркин для направления поврежденных митохондрий на деградацию посредством аутофагии . [14] Из-за присутствия PINK1 по всей цитоплазме было высказано предположение, что PINK1 функционирует как «разведчик», чтобы исследовать поврежденные митохондрии. [15]

PINK1 также может контролировать качество митохондрий посредством деления митохондрий . Благодаря делению митохондрий создается ряд дочерних митохондрий, часто с неравномерным распределением мембранного потенциала. Митохондрии с сильным, здоровым мембранным потенциалом с большей вероятностью подвергались слиянию, чем митохондрии с низким мембранным потенциалом. Вмешательство в путь деления митохондрий привело к увеличению окисленных белков и снижению дыхания. [16] Без PINK1 паркин не может эффективно локализоваться в поврежденных митохондриях, в то время как избыточная экспрессия PINK1 заставляет паркин локализоваться даже в здоровых митохондриях. [17] Кроме того, мутации как в Drp1, факторе деления митохондрий, так и в PINK1 были фатальными в моделях Drosophila . Однако повышенная экспрессия Drp1 может спасти людей с дефицитом PINK1 или паркина, что позволяет предположить, что деление митохондрий, инициированное Drp1, воссоздает те же эффекты пути PINK1/паркин. [18]
В дополнение к делению митохондрий, PINK1 участвует в подвижности митохондрий. Накопление PINK1 и привлечение паркина нацеливает митохондрию на деградацию, и PINK1 может служить для повышения скорости деградации путем остановки подвижности митохондрий. Избыточная экспрессия PINK1 производит эффекты, похожие на подавление Miro , белка, тесно связанного с миграцией митохондрий. [19]
Другой механизм контроля качества митохондрий может возникать через везикулы, происходящие из митохондрий. Окислительный стресс в митохондриях может производить потенциально вредные соединения, включая неправильно свернутые белки или активные формы кислорода. Было показано, что PINK1 способствует созданию везикул, происходящих из митохондрий, которые могут разделять активные формы кислорода и переносить их к лизосомам для деградации. [20]
Актуальность заболевания
Болезнь Паркинсона часто характеризуется дегенерацией дофаминергических нейронов и связана с накоплением неправильно сложенных белков и телец Леви . Было показано, что мутации в белке PINK1 приводят к накоплению таких неправильно сложенных белков в митохондриях как клеток мух, так и клеток человека. [21] В частности, мутации в домене серин/треонин киназы были обнаружены у ряда пациентов с болезнью Паркинсона, у которых PINK1 не защищает от вызванной стрессом митохондриальной дисфункции и апоптоза . [22]
Фармакологическая манипуляция
На сегодняшний день было мало сообщений о малых молекулах, которые активируют PINK1, и их перспективах в качестве потенциальных методов лечения болезни Паркинсона. Первый отчет появился в 2013 году, когда Кеван Шокат и его команда из Калифорнийского университета в Сан-Франциско идентифицировали нуклеиновую основу, называемую кинетином, как активатор PINK1. [23] Впоследствии другими было показано, что нуклеозидное производное кинетина, то есть рибозид кинетина, демонстрирует значительную активацию PINK1 в клетках. [24] Кроме того, монофосфатные пролекарства рибозида кинетина, ProTides, также показали активацию PINK1. [25] В декабре 2017 года никлозамид, противогельминтный препарат, был идентифицирован как мощный активатор PINK1 в клетках и нейронах. [26]
Ссылки
- ^ abc GRCh38: Ensembl выпуск 89: ENSG00000158828 – Ensembl , май 2017 г.
- ^ abc GRCm38: Ensembl выпуск 89: ENSMUSG00000028756 – Ensembl , май 2017 г.
- ^ "Human PubMed Reference:". Национальный центр биотехнологической информации, Национальная медицинская библиотека США .
- ^ "Mouse PubMed Reference:". Национальный центр биотехнологической информации, Национальная медицинская библиотека США .
- ^ Unoki M, Nakamura Y (август 2001 г.). «Эффекты подавления роста BPOZ и EGR2, двух генов, участвующих в сигнальном пути PTEN». Oncogene . 20 (33): 4457–65. doi : 10.1038/sj.onc.1204608 . PMID 11494141.
- ^ Валенте Э.М., Сальви С., Ялонго Т., Маронгиу Р., Элиа А.Е., Капуто В., Ромито Л., Альбанезе А., Даллапиккола Б., Бентивольо А.Р. (сентябрь 2004 г.). «Мутации PINK1 связаны со спорадическим паркинсонизмом с ранним началом». Энн Нейрол . 56 (3): 336–41. дои : 10.1002/ana.20256. PMID 15349860. S2CID 11049051.
- ^ Narendra DP, Jin SM, Tanaka A, Suen DF, Gautier CA, Shen J, Cookson MR, Youle RJ (2010). "PINK1 селективно стабилизируется на поврежденных митохондриях для активации Паркина". PLOS Biology . 8 (1): e1000298. doi : 10.1371/journal.pbio.1000298 . PMC 2811155. PMID 20126261 .
- ^ Lazarou M, Narendra DP, Jin SM, Tekle E, Banerjee S, Youle RJ (2013). «PINK1 управляет самоассоциацией Паркина и активностью E3, подобной HECT, выше митохондриального связывания». Journal of Cell Biology . 200 (2): 163–172. doi :10.1083/jcb.201210111. PMC 3549971 . PMID 23319602.
- ^ Dagda RK, Pien I, Wang R, Zhu J, Wang KZ, Callio J, Banerjee TD, Dagda RY, Chu CT (2013). «За пределами митохондрии: цитозольный PINK1 ремоделирует дендриты через протеинкиназу A». J Neurochem . 128 (6): 864–877. doi :10.1111/jnc.12494. PMC 3951661 . PMID 24151868.
- ^ «Ген Энтреза: PINK1 PTEN индуцирует предполагаемую киназу 1».
- ^ Deas E, Plun-Favreau H, Gandhi S, Desmond H, Kjaer S, Loh SH, Renton AE, Harvey RJ, Whitworth AJ, Martins LM, Abramov AY, Wood NW (2011). "Расщепление PINK1 в позиции A103 митохондриальной протеазой PARL". Hum. Mol. Genet . 20 (5): 867–869. doi :10.1093/hmg/ddq526. PMC 3033179. PMID 21138942 .
- ^ Springer W, Kahle PJ (март 2011 г.). «Регулирование PINK1-Parkin-опосредованной митофагии». Аутофагия . 7 (3): 266–78. doi :10.4161/auto.7.3.14348. PMID 21187721. S2CID 31612944.
- ^ Шуберт А.Ф., Гладкова С., Пардон Э., Вагстафф Дж.Л., Фройнд С.М., Стейерт Дж., Маслен С.Л., Командер Д. (30 октября 2017 г.). «Структура PINK1 в комплексе с его субстратом убиквитином». Природа . 552 (7683): 51–56. Бибкод : 2017Natur.552...51S. дои : 10.1038/nature24645. ISSN 1476-4687. ПМК 6020998 . ПМИД 29160309.
- ^ Youle RJ, van der Bliek AM (2012). «Митохондриальное деление, слияние и стресс». Science . 337 (6098): 1062–1065. Bibcode :2012Sci...337.1062Y. doi :10.1126/science.1219855. PMC 4762028 . PMID 22936770.
- ^ Narendra D, Walker JE, Youle R (2012). «Контроль качества митохондрий, опосредованный PINK1 и Parkin: связи с паркинсонизмом». Cold Spring Harbor Perspectives in Biology . 4 (11): a011338. doi :10.1101/cshperspect.a011338. PMC 3536340. PMID 23125018 .
- ^ Twig G, Elorza A, Molina AJ, Mohamed H, Wikstrom JD, Walzer G, Stiles L, Haigh SE, Katz S, Las G, Alroy J, Wu M, Py BF, Yuan J, Deeney JT, Corkey BE, Shirihai OS (2008). «Деление и селективное слияние управляют митохондриальной сегрегацией и элиминацией путем аутофагии». The EMBO Journal . 27 (2): 433–446. doi :10.1038/sj.emboj.7601963. PMC 2234339. PMID 18200046 .
- ^ Vives-Bauza C, Zhou C, Huang Y, Cui M, de Vries RL, Kim J, May J, Tocilescu MA, Liu W, Ko HS, Magrané J, Moore DJ, Dawson VL, Grailhe R, Dawson TM, Li C, Tieu K, Przedborski S (2010). "PINK1-зависимое привлечение паркина в митохондрии при митофагии". Труды Национальной академии наук Соединенных Штатов Америки . 107 (1): 378–83. Bibcode : 2010PNAS..107..378V. doi : 10.1073/pnas.0911187107 . PMC 2806779. PMID 19966284 .
- ^ Poole AC, Thomas RE, Andrews LA, McBride HM, Whitworth AJ, Pallanck LJ (2008). «Путь PINK1/Parkin регулирует митохондриальную митофагию». Труды Национальной академии наук Соединенных Штатов Америки . 105 (5): 1638–43. doi : 10.1073/pnas.0709336105 . PMC 2234197. PMID 18230723 .
- ^ Liu S, Sawada T, Lee S, Yu W, Silverio G, Alapatt P, Millan I, Shen A, Saxton W, Kanao T, Takahashi R, Hattori N, Imai Y, Lu B (2012). "Киназа PINK1, ассоциированная с болезнью Паркинсона, регулирует уровень белка Miro и аксональный транспорт митохондрий". PLOS Genetics . 8 (3): e102537. doi : 10.1371/journal.pgen.1002537 . PMC 3291531 . PMID 22396657.
- ^ McLelland GL, Soubannier V, Chen CX, McBride HM, Fon EA (2014). «Parkin и PINK 1 функционируют в везикулярном пути транспортировки, регулирующем контроль качества митохондрий». The EMBO Journal . 33 (4): 282–295. doi : 10.1002 /embj.201385902. PMC 3989637. PMID 24446486.
- ^ Пимента де Кастро I, Коста AC, Лам Д., Туфи Р., Феделе В., Моисой Н., Динсдейл Д., Деас Э., Лох Ш., Мартинс Л.М. (2012). «Генетический анализ неправильного сворачивания митохондриального белка у Drosophila melanogaster». Смерть клеток и дифференциация . 19 (8): 1308–16. дои : 10.1038/cdd.2012.5. ПМЦ 3392634 . ПМИД 22301916.
- ^ Valente EM, Abou-Sleiman PM, Caputo V, Muqit MM, Harvey K, Gispert S, Ali Z, Del Turco D, Bentivoglio AR, Healy DG, Albanese A, Nussbaum R, González-Maldonado R, Deller T, Salvi S, Cortelli P, Gilks WP, Latchman DS, Harvey RJ, Dallapiccola B, Auburger G, Wood NW (2004). "Наследственная болезнь Паркинсона с ранним началом, вызванная мутациями в PINK1". Science . 304 (5674): 1158–60. Bibcode :2004Sci...304.1158V. doi : 10.1126/science.1096284 . PMID 15087508. S2CID 33630092.
- ^ Hertz NT, Berthet A, Sos ML, Thorn KS, Burlingame AL, Nakamura K, Shokat KM (2013). «Нео-субстрат, который усиливает каталитическую активность киназы PINK1, связанной с болезнью Паркинсона». Cell . 154 (4): 737–47. doi :10.1016/j.cell.2013.07.030. PMC 3950538 . PMID 23953109.
- ^ Osgerby L, Lai YC, Thornton PJ, Amalfitano J, Le Duff CS, Jabeen I, Kadri H, Miccoli A, Tucker JH, Muqit M, Mehellou Y (2017). «Рибозид кинетина и его ProTides активируют ассоциированную с болезнью Паркинсона предполагаемую киназу 1, индуцированную PTEN (PINK1), независимо от деполяризации митохондрий». J. Med. Chem . 60 (8): 3518–24. doi :10.1021/acs.jmedchem.6b01897. PMC 5410652. PMID 28323427 .
- ^ Osgerby L, Lai YC, Thornton PJ, Amalfitano J, Le Duff CS, Jabeen I, Kadri H, Miccoli A, Tucker JH, Muqit M, Mehellou Y (2017). «Рибозид кинетина и его ProTides активируют ассоциированную с болезнью Паркинсона предполагаемую киназу 1, индуцированную PTEN (PINK1), независимо от деполяризации митохондрий». J. Med. Chem . 60 (8): 3518–24. doi :10.1021/acs.jmedchem.6b01897. PMC 5410652. PMID 28323427 .
- ^ Барини Э., Микколи А., Тинарелли Ф., Малхоланд К., Кадри Х., Ханим Ф., Стояновски Л., Рид К.Д., Бернесс К., Блоу Дж.Дж., Мехеллоу Ю., Мукит М. (2017). «Ангельминтный препарат никлозамид и его аналоги активируют протеинкиназу PINK1, связанную с болезнью Паркинсона». ХимБиоХим . 19 (5): 425–429. дои : 10.1002/cbic.201700500. ПМК 5901409 . ПМИД 29226533.
Дальнейшее чтение
- Heutink P (2006). "PINK-1 и DJ-1 — новые гены аутосомно-рецессивной болезни Паркинсона". Болезнь Паркинсона и родственные ей расстройства . Журнал нейронной передачи. Приложение. Том 70. С. 215–9. doi :10.1007/978-3-211-45295-0_33. ISBN 978-3-211-28927-3. PMID 17017532.
{{cite book}}:|journal=проигнорировано ( помощь ) - Valente EM, Bentivoglio AR, Dixon PH, Ferraris A, Ialongo T, Frontali M, Albanese A, Wood NW (2001). «Локализация нового локуса аутосомно-рецессивного раннего паркинсонизма, PARK6, на человеческой хромосоме 1p35-p36». Am. J. Hum. Genet . 68 (4): 895–900. doi :10.1086/319522. PMC 1275643 . PMID 11254447.
- Khan NL, Valente EM, Bentivoglio AR, Wood NW, Albanese A, Brooks DJ, Piccini P (2002). «Клиническая и субклиническая дофаминергическая дисфункция при паркинсонизме, связанном с PARK6: исследование ПЭТ с 18F-допа». Ann. Neurol . 52 (6): 849–53. doi :10.1002/ana.10417. PMID 12447943. S2CID 9275470.
- Бонифати В, Деккер MC, Ванакор Н, Фаббрини Дж, Сквитьери Ф, Маркони Р, Антонини А, Брустенги П, Далла Либера А, Де Мари М, Стокки Ф, Монтанья П, Галлаи В, Риццу П, ван Свитен ХК, Остра Б , ван Дуйн С.М., Меко Г., Хойтинк П. (2003). «Аутосомно-рецессивный паркинсонизм с ранним началом связан с тремя локусами: PARK2, PARK6 и PARK7». Нейрол. Наука . 23 (Приложение 2): S59–60. дои : 10.1007/s100720200069. PMID 12548343. S2CID 13625056.
- Валенте Э.М., Бранкати Ф., Капуто В., Грэм Э.А., Дэвис М.Б., Феррарис А., Бретелер М.М., Гассер Т., Бонифати В., Бентивольо А.Р., Де Микеле Дж., Дюрр А., Кортелли П., Филла А., Меко Г., Остра Б.А., Брайс А, Альбанезе А, Даллапиккола Б, Вуд NW (2003). «PARK6 является частой причиной семейного паркинсонизма». Нейрол. Наука . 23 (Приложение 2): S117–8. дои : 10.1007/s100720200097. PMID 12548371. S2CID 21061495.
- Nakajima A, Kataoka K, Hong M, Sakaguchi M, Huh NH (2004). «BRPK, новая протеинкиназа, демонстрирующая повышенную экспрессию в линиях клеток рака мышей с более высоким метастатическим потенциалом». Cancer Lett . 201 (2): 195–201. doi :10.1016/S0304-3835(03)00443-9. PMID 14607334.
- Valente EM, Abou-Sleiman PM, Caputo V, Muqit MM, Harvey K, Gispert S, Ali Z, Del Turco D, Bentivoglio AR, Healy DG, Albanese A, Nussbaum R, González-Maldonado R, Deller T, Salvi S, Cortelli P, Gilks WP, Latchman DS, Harvey RJ, Dallapiccola B, Auburger G, Wood NW (2004). "Наследственная болезнь Паркинсона с ранним началом, вызванная мутациями в PINK1". Science . 304 (5674): 1158–60. Bibcode :2004Sci...304.1158V. doi : 10.1126/science.1096284 . PMID 15087508. S2CID 33630092.
- Healy DG, Abou-Sleiman PM, Ahmadi KR, Muqit MM, Bhatia KP, Quinn NP, Lees AJ, Latchmann DS, Goldstein DB, Wood NW (2004). «Ген, ответственный за болезнь Паркинсона PARK6, PINK1, не влияет на распространенные формы паркинсонизма». Ann. Neurol . 56 (3): 329–35. doi :10.1002/ana.20206. PMID 15349859. S2CID 1235813.
- Хатано Ю, Ли Ю, Сато К, Асакава С, Ямамура Ю, Томияма Х, Ёсино Х, Асахина М, Кобаяши С, Хассин-Баер С, Лу CS, Нг АР, Росалес РЛ, Симидзу Н, Тода Т, Мизуно Ю, Хаттори Н (2004). «Новые мутации PINK1 при паркинсонизме с ранним началом». Энн. Нейрол . 56 (3): 424–7. дои : 10.1002/ана.20251. PMID 15349870. S2CID 10853835.
- Hatano Y, Sato K, Elibol B, Yoshino H, Yamamura Y, Bonifati V, Shinotoh H, Asahina M, Kobayashi S, Ng AR, Rosales RL, Hassin-Baer S, Shinar Y, Lu CS, Chang HC, Wu-Chou YH, Ataç FB, Kobayashi T, Toda T, Mizuno Y, Hattori N (2004). "PARK6-связанный аутосомно-рецессивный ранний паркинсонизм в азиатских популяциях". Neurology . 63 (8): 1482–5. doi :10.1212/01.wnl.0000142258.29304.fe. PMID 15505170. S2CID 13480500.
- Healy DG, Abou-Sleiman PM, Gibson JM, Ross OA, Jain S, Gandhi S, Gosal D, Muqit MM, Wood NW, Lynch T (2006). "PINK1 (PARK6) ассоциированная болезнь Паркинсона в Ирландии". Neurology . 63 (8): 1486–8. doi :10.1212/01.wnl.0000142089.38301.8e. PMID 15505171. S2CID 24418905.
- Рогаева Э., Джонсон Дж., Ланг А.Е., Гулик С., Гвинн-Харди К., Кавараи Т., Сато С., Морган А., Вернер Дж., Нуссбаум Р., Пети А., Окун М.С., Макинерни А., Мандель Р., Гроен Дж.Л., Фернандес Х.Х., Постума Р., Фут К.Д., Салехи-Рад С., Лян Й., Реймснидер С., Тандон А., Харди Дж., Сент-Джордж-Хислоп П., Синглтон AB (2005). «Анализ гена PINK1 в большой группе случаев болезни Паркинсона». Архив неврологии . 61 (12): 1898–904. doi :10.1001/archneur.61.12.1898. ПМИД 15596610.
- Beilina A, Van Der Brug M, Ahmad R, Kesavapany S, Miller DW, Petsko GA, Cookson MR (2005). «Мутации в предполагаемой киназе 1, индуцированной PTEN, связанной с рецессивным паркинсонизмом, оказывают дифференцированное влияние на стабильность белка». Proc. Natl. Acad. Sci. USA . 102 (16): 5703–8. Bibcode :2005PNAS..102.5703B. doi : 10.1073/pnas.0500617102 . PMC 556294 . PMID 15824318.
- Deng H, Le WD, Zhang X, Pan TH, Jankovic J (2005). "Мутации G309D и W437OPA PINK1 у пациентов с болезнью Паркинсона кавказской национальности". Acta Neurol. Scand . 111 (6): 351–2. doi : 10.1111/j.1600-0404.2005.00383.x . PMID 15876334. S2CID 10669009.
- Li Y, Tomiyama H, Sato K, Hatano Y, Yoshino H, Atsumi M, Kitaguchi M, Sasaki S, Kawaguchi S, Miyajima H, Toda T, Mizuno Y, Hattori N (2005). "Клинико-генетическое исследование мутаций PINK1 при аутосомно-рецессивном раннем паркинсонизме". Neurology . 64 (11): 1955–7. doi :10.1212/01.WNL.0000164009.36740.4E. PMID 15955953. S2CID 46024206.
Внешние ссылки
- Запись GeneReviews/NCBI/NIH/UW о типе PINK1 болезни Паркинсона с ранним началом