Структура и геном ВИЧ
Геном и белки ВИЧ (вирус иммунодефицита человека) были предметом обширных исследований с момента открытия вируса в 1983 году. [ 1] [2] «В поисках возбудителя изначально считалось, что вирус является формой вируса Т-клеточного лейкоза человека (HTLV), который, как было известно в то время, влияет на иммунную систему человека и вызывает определенные лейкемии. Однако исследователи из Института Пастера в Париже выделили ранее неизвестный и генетически отличный ретровирус у пациентов со СПИДом, который позже был назван ВИЧ». [3] Каждый вирион состоит из вирусной оболочки и связанной с ней матрицы, охватывающей капсид , который сам по себе охватывает две копии одноцепочечного генома РНК и несколько ферментов . Открытие самого вируса произошло через два года после сообщения о первых крупных случаях заболеваний, связанных со СПИДом. [4] [5]
Структура
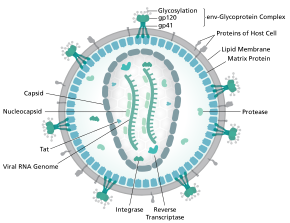
.jpg/440px-Protein_Structure_Diagram_of_Fusion_Peptide_Epitope_on_HIV_Spike_(41863579304).jpg)
Полная последовательность генома ВИЧ-1, извлеченная из инфекционных вирионов, была решена с разрешением в один нуклеотид . [6] Геном ВИЧ кодирует небольшое количество вирусных белков , неизменно устанавливая кооперативные ассоциации между белками ВИЧ и между ВИЧ и белками хозяина, чтобы вторгаться в клетки хозяина и захватывать их внутренние механизмы. [7] ВИЧ отличается по структуре от других ретровирусов . Вирион ВИЧ имеет диаметр ~100 нм. Его самая внутренняя область состоит из конусообразного ядра , которое включает две копии генома одноцепочечной РНК (положительного смысла) , ферменты обратную транскриптазу , интегразу и протеазу , некоторые второстепенные белки и основной белок ядра. [8] Геном вируса иммунодефицита человека (ВИЧ) кодирует 8 вирусных белков, играющих существенные роли в течение жизненного цикла ВИЧ. [7]
ВИЧ-1 состоит из двух копий нековалентно связанной , несплайсированной , положительно-полярной одноцепочечной РНК, заключенной в конический капсид, состоящий из вирусного белка p24 , типичного для лентивирусов . [9] [10] Две РНК часто идентичны, но они не являются независимыми, а образуют компактный димер внутри вириона. [11] Было предложено несколько причин, по которым упакованы две копии РНК, а не одна, включая, вероятно, комбинацию следующих преимуществ: Одно преимущество заключается в том, что две копии цепей РНК жизненно важны для содействия рекомбинации ВИЧ-1, которая происходит во время обратной транскрипции вирусной репликации, тем самым увеличивая генетическое разнообразие. [11] Другое преимущество заключается в том, что наличие двух копий РНК позволит обратной транскриптазе переключать матрицы при обнаружении разрыва в вирусной РНК, тем самым завершая обратную транскрипцию без потери генетической информации. [11] Еще одна причина заключается в том, что димерная природа РНК-генома вируса может играть структурную роль в репликации вируса. [11] Содержание двух копий одноцепочечной РНК внутри вириона, но производство только одного ДНК-провируса называется псевдодиплоидией. [12] Компонент РНК имеет длину 9749 нуклеотидов [13] [14] и несет 5'-кэп (Gppp), 3'- поли(А)-хвост и много открытых рамок считывания (ORF). [15] Вирусные структурные белки кодируются длинными ORF, тогда как меньшие ORF кодируют регуляторы жизненного цикла вируса: присоединение, слияние мембран, репликацию и сборку. [15]
Одноцепочечная РНК прочно связана с белками нуклеокапсида p7 , белком поздней сборки p6 и ферментами, необходимыми для развития вириона, такими как обратная транскриптаза и интеграза . Лизиновая тРНК является праймером магний-зависимой обратной транскриптазы. [9] Нуклеокапсид ассоциируется с геномной РНК (одна молекула на гексамер) и защищает РНК от переваривания нуклеазами . Внутри частицы вириона также заключены Vif , Vpr , Nef и вирусная протеаза . [ необходима цитата ] Оболочка вириона образована плазматической мембраной, происходящей из клетки-хозяина, которая поддерживается матрицей, состоящей из вирусного белка p17, обеспечивающего целостность частицы вириона. На поверхности вириона можно обнаружить ограниченное количество гликопротеина оболочки ( Env ) ВИЧ, тримера, образованного гетеродимерами gp120 и gp41 . Env отвечает за связывание с основным рецептором хозяина, CD4, и его корецептором (в основном CCR5 или CXCR4 ), что приводит к проникновению вируса в клетку-мишень. [16]
Как единственные белки на поверхности вируса, гликопротеины оболочки (gp120 и gp41) являются основными целями для усилий по вакцинации против ВИЧ . [17] Более половины массы тримерного шипа оболочки составляют N-связанные гликаны . Плотность высока, поскольку гликаны защищают лежащий в основе вирусный белок от нейтрализации антителами . Это одна из наиболее плотно гликозилированных известных молекул, и плотность достаточно высока, чтобы предотвратить нормальный процесс созревания гликанов во время биогенеза в эндоплазматическом ретикулуме и аппарате Гольджи . [18] [19] Поэтому большинство гликанов останавливаются как незрелые «высокоманнозные » гликаны, которые обычно не присутствуют на секретируемых или клеточных поверхностных человеческих гликопротеинах. [20] Необычная обработка и высокая плотность означают, что почти все широко нейтрализующие антитела, которые были идентифицированы до сих пор (из подгруппы пациентов, которые были инфицированы в течение многих месяцев или лет), связываются с этими гликанами оболочки или адаптируются, чтобы справляться с ними. [21]
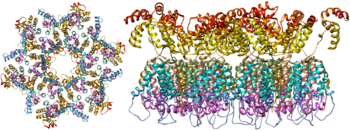
Молекулярная структура вирусного шипа теперь определена с помощью рентгеновской кристаллографии [22] и криоэлектронной микроскопии . [23] Эти достижения в структурной биологии стали возможными благодаря разработке стабильных рекомбинантных форм вирусного шипа путем введения межсубъединичной дисульфидной связи и мутации изолейцина в пролин в gp41. [24] Так называемые тримеры SOSIP не только воспроизводят антигенные свойства нативного вирусного шипа, но и демонстрируют ту же степень незрелых гликанов, что и нативный вирус. [25] Рекомбинантные тримерные вирусные шипы являются многообещающими кандидатами на вакцины, поскольку они демонстрируют меньше ненейтрализующих эпитопов , чем рекомбинантный мономерный gp120, который действует, подавляя иммунный ответ на целевые эпитопы. [26]
Организация генома

ВИЧ имеет несколько основных генов, кодирующих структурные белки, которые встречаются во всех ретровирусах, а также несколько неструктурных («вспомогательных») генов, уникальных для ВИЧ. [27] Геном ВИЧ содержит девять генов, кодирующих пятнадцать вирусных белков. [28] Они синтезируются как полипротеины, которые производят белки для внутренней части вириона, называемые Gag, группоспецифический антиген; вирусные ферменты (Pol, полимераза) или гликопротеины оболочки вириона . [29] В дополнение к ним ВИЧ кодирует белки, которые также имеют определенные регуляторные и вспомогательные функции. [29] ВИЧ-1 имеет два важных регуляторных элемента: Tat и Rev и несколько важных вспомогательных белков, таких как Nef, Vpr, Vif и Vpu, которые не являются необходимыми для репликации в определенных тканях. [29] Ген gag обеспечивает основную физическую инфраструктуру вируса, а pol обеспечивает основной механизм, с помощью которого ретровирусы воспроизводятся, в то время как другие помогают ВИЧ проникать в клетку-хозяина и усиливать ее воспроизводство. Хотя они могут быть изменены мутацией, все эти гены, за исключением tev, существуют во всех известных вариантах ВИЧ; см. Генетическая изменчивость ВИЧ . [ необходима ссылка ]
ВИЧ использует сложную систему дифференциального сплайсинга РНК для получения девяти различных генных продуктов из генома размером менее 10 кб. [30] ВИЧ имеет 9,2 кб несплайсированного геномного транскрипта, который кодирует предшественников gag и pol; одиночно сплайсированный, 4,5 кб кодирующий env, Vif, Vpr и Vpu и многократно сплайсированный, 2 кб мРНК кодирующий Tat, Rev и Nef. [30]
| Сорт | Имя гена | Первичные белковые продукты | Переработанные белковые продукты |
|---|---|---|---|
| Вирусные структурные белки | кляп | Gag полипротеин | Массачусетс, Калифорния, SP1, Северная Каролина, SP2, P6 |
| пол | Полипротеин Pol | ОТ, РНКаза H, ИН, ПР | |
| окружающая среда | гп160 | гп120, гп41 | |
| Основные элементы регулирования | тат | Тат | |
| рев | Преподобный | ||
| Вспомогательные регуляторные белки | неф | Неф | |
| впр | Впр | ||
| виф | Виф | ||
| впу | Впу |
Вирусные структурные белки

- gag (группоспецифический антиген) кодирует предшественник полипротеина gag, который обрабатывается вирусной протеазой во время созревания до MA ( матричного белка , p17); CA (капсидного белка, p24 ); SP1 (спейсерного пептида 1, p2); NC ( нуклеокапсидного белка , p7); SP2 (спейсерного пептида 2, p1) и белка P6. [31]
- pol кодирует вирусные ферменты обратную транскриптазу (RT) и РНКазу H , интегразу (IN) и протеазу ВИЧ (PR). [29] Протеаза ВИЧ необходима для расщепления предшественника полипротеина Gag для получения структурных белков, RT необходима для транскрипции ДНК с шаблона РНК, а IN необходима для интеграции двухцепочечной вирусной ДНК в геном хозяина. [27]
- env (для "оболочки") кодирует gp160 , который расщепляется протеазой хозяина, фурином , в эндоплазматическом ретикулуме клетки-хозяина. Посттрансляционная обработка производит поверхностный гликопротеин, gp120 или SU, который прикрепляется к рецепторам CD4 , присутствующим на лимфоцитах, и gp41 или TM, который встраивается в вирусную оболочку, чтобы позволить вирусу прикрепиться и слиться с клетками-мишенями. [27] [31]
Основные элементы регулирования
- tat (трансактиватор ВИЧ) играет важную роль в регуляции обратной транскрипции вирусной геномной РНК, обеспечивая эффективный синтез вирусных мРНК и регулируя высвобождение вирионов из инфицированных клеток. [29] Tat экспрессируется как 72- аминокислотный одноэкзонный Tat , а также как 86–101-аминокислотный двухэкзонный Tat и играет важную роль на ранних стадиях ВИЧ-инфекции. Tat (14–15 кДа) связывается с выпуклой вторичной структурой стебля-петли геномной РНКвблизи области 5' LTR, образуя элемент ответа на транс-активацию (TAR) . [9] [29]
- rev (регулятор экспрессии белков вириона): белок Rev связывается с вирусным геномом через богатый аргинином РНК-связывающий мотив, который также действует как NLS ( сигналы ядерной локализации ), необходимые для транспортировки Rev в ядро из цитозоля во время репликации вируса. [29] Rev распознает сложную структуру стебля-петли мРНК env , расположенную в интроне, разделяющем кодирующий экзон Tat и Rev, известный как элемент ответа ВИЧ Rev (RRE). [9] [29] Rev важен для синтеза основных вирусных белков и, следовательно, необходим для репликации вируса . [ требуется ссылка ]
Вспомогательные регуляторные белки
- vpr ( лентивирусный белок R): Vpr — это связанный с вирионом, нуклеоцитоплазматический челночный регуляторный белок . [29] Считается, что он играет важную роль в репликации вируса, в частности, в ядерном импорте преинтеграционного комплекса . Vpr также, по-видимому, заставляет клетки-хозяева останавливать свой клеточный цикл в фазе G2 . Эта остановка активирует механизм репарации ДНК хозяина, который может обеспечить интеграцию вирусной ДНК. [9] ВИЧ-2 и SIV кодируют дополнительный связанный с Vpr белок, называемый Vpx, который функционирует совместно с Vpr. [29]
- vif – Vif – это высококонсервативный фосфопротеин 23 кДа,важный для инфекционности вирионов ВИЧ-1 в зависимости от типа клеток. [9] Было обнаружено, что ВИЧ-1 требует Vif для синтеза инфекционных вирусов в лимфоцитах , макрофагах и некоторых линиях клеток человека . Похоже, что Vif не требуется для того же процесса в клетках HeLa или клетках COS , среди прочих. [29]
- nef – Nef, отрицательный фактор, является N-концевым миристоилированным мембранно-ассоциированным фосфопротеином. Он участвует в многочисленных функциях во время цикла репликации вируса. Считается, что он играет важную роль в апоптозе клеток и повышает инфекционность вируса . [29]
- vpu (вирусный белок U) – Vpu специфичен для ВИЧ-1. Это олигомерный интегральный мембранный фосфопротеин класса I с многочисленными биологическими функциями. Vpu участвует вдеградации CD4 , включая путь убиквитин- протеасомы , а также в успешном высвобождении вирионов из инфицированных клеток. [9] [29]
- tev : Этот ген присутствует только в нескольких изолятах ВИЧ-1. Он представляет собой слияние частей генов tat , env и rev и кодирует белок с некоторыми свойствами tat , но с небольшими или нулевыми свойствами rev . [32]
Вторичная структура РНК
| Стволовая петля ВИЧ pol-1 | |
|---|---|
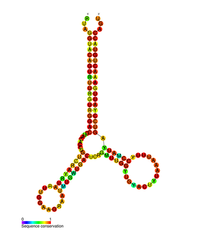 Предсказанная вторичная структура петли pol-1 ВИЧ | |
| Идентификаторы | |
| Символ | пол |
| Рфам | РФ01418 |
| Другие данные | |
| Тип РНК | Цис-рег |
| Структуры PDB | ПДБе |
В геноме РНК ВИЧ было идентифицировано несколько консервативных элементов вторичной структуры . Структуры вирусной РНК ВИЧ регулируют ход обратной транскрипции. [33] Структура 5'UTR состоит из серии структур «стебель-петля», соединенных небольшими линкерами. [10] Эти структуры «стебель-петля» (от 5' до 3') включают элемент области трансактивации (TAR), 5'- сигнал полиаденилирования [поли(А)], PBS, DIS, основной SD и структуру шпильки ψ , расположенную в 5'-конце генома, а также элемент ответа HIV Rev (RRE) в гене env. [10] [34] [35] Другая идентифицированная структура РНК — это gag stem loop 3 (GSL3) , которая, как полагают, участвует в вирусной упаковке. [36] [37] Было высказано предположение, что вторичные структуры РНК влияют на жизненный цикл ВИЧ, изменяя функцию протеазы ВИЧ и обратной транскриптазы , хотя не всем идентифицированным элементам была назначена функция. [ необходима ссылка ]
Вторичная структура РНК, определенная анализом SHAPE , показала, что содержит три петли стебля и расположена между генами протеазы ВИЧ и обратной транскриптазы. Было показано, что эта цис- регуляторная РНК сохраняется во всем семействе ВИЧ и, как полагают, влияет на жизненный цикл вируса. [38]
петля V3
Третья вариабельная петля или петля V3 является частью или областью вируса иммунодефицита человека . Петля V3 гликопротеина оболочки вируса, gp120 , позволяет ему инфицировать иммунные клетки человека, связываясь с рецептором цитокина на целевой иммунной клетке человека, такой как клетка CCR5 или клетка CXCR4 , в зависимости от штамма ВИЧ . [39] Гликопротеин оболочки (Env) gp 120/41 необходим для проникновения ВИЧ-1 в клетки. Env служит молекулярной мишенью лекарства, лечащего людей с инфекцией ВИЧ-1, и источником иммуногена для разработки вакцины против СПИДа. Однако структура функционального тримера Env остается неясной. [40]
Смотрите также
Ссылки
- ^ Barré-Sinoussi F, Chermann JC, Rey F, Nugeyre MT, Chamaret S, Gruest J, Dauguet C, Axler-Blin C, Vézinet-Brun F, Rouzioux C, Rozenbaum W, Montagnier L (май 1983). "Выделение Т-лимфотропного ретровируса у пациента с риском развития синдрома приобретенного иммунодефицита (СПИД)". Science . 220 (4599): 868– 71. Bibcode :1983Sci...220..868B. doi :10.1126/science.6189183. PMID 6189183. S2CID 390173.
- ^ Галло RC, Сарин PS, Гельманн EP, Роберт-Гурофф M, Ричардсон E, Кальянараман VS, Манн D, Сидху GD, Шталь RE, Золла-Пазнер S, Лейбович J, Попович M (май 1983). "Выделение вируса Т-клеточного лейкоза человека при синдроме приобретенного иммунодефицита (СПИД)". Science . 220 (4599): 865– 7. Bibcode :1983Sci...220..865G. doi :10.1126/science.6601823. PMID 6601823.
- ^ Churi C, Ross MW (2015). "ВИЧ/СПИД" . В Whelehan P, Bolin A (ред.). Международная энциклопедия человеческой сексуальности . Wiley. ISBN 9781405190060. OCLC 949701914.
- ^ Центры по контролю и профилактике заболеваний (июнь 1981 г.). "Пневмоцистная пневмония — Лос-Анджелес". MMWR. Еженедельный отчет о заболеваемости и смертности . 30 (21): 250–2 . PMID 6265753.
- ^ Центры по контролю и профилактике заболеваний (CDC) (июль 1981 г.). «Саркома Капоши и пневмоцистная пневмония среди гомосексуальных мужчин – Нью-Йорк и Калифорния» (PDF) . MMWR. Еженедельный отчет о заболеваемости и смертности . 30 (25): 305– 8. PMID 6789108. Архивировано из оригинала 22 октября 2012 г. . Получено 15 сентября 2017 г. .
- ^ Watts JM, Dang KK, Gorelick RJ, Leonard CW, Bess JW, Swanstrom R, Burch CL, Weeks KM (август 2009). «Архитектура и вторичная структура всего генома РНК ВИЧ-1». Nature . 460 (7256): 711– 6. Bibcode :2009Natur.460..711W. doi :10.1038/nature08237. PMC 2724670 . PMID 19661910.
- ^ ab Li G, De Clercq E (сентябрь 2016 г.). "HIV Genome-Wide Protein Associations: a Review of 30 Years of Research". Microbiology and Molecular Biology Reviews . 80 (3): 679– 731. doi :10.1128/MMBR.00065-15. PMC 4981665. PMID 27357278 .
- ^ Синглтон П., Сейнсбери Д., ред. (2006). "ВИЧ" . Словарь микробиологии и молекулярной биологии (3-е изд.). Хобокен, Нью-Джерси: Wiley. ISBN 9780470035450. OCLC 71223221.
- ^ abcdefg Монтанье Л. (1999). «Вирусы иммунодефицита человека (Retroviridae)». Энциклопедия вирусологии (2-е изд.). стр. 763–774 .
- ^ abc Lu K, Heng X, Summers MF (июль 2011 г.). «Структурные детерминанты и механизм упаковки генома ВИЧ-1». Журнал молекулярной биологии . 410 (4): 609–33 . doi :10.1016/j.jmb.2011.04.029. PMC 3139105. PMID 21762803 .
- ^ abcd Мур, Майкл Д.; Ху, Вэй Шау (2009). «Димеризация РНК ВИЧ-1: для танго нужны двое». AIDS Reviews . 11 (2): 91– 102. ISSN 1139-6121. PMC 3056336. PMID 19529749 .
- ^ Hwang CK, Svarovskaia ES, Pathak VK (октябрь 2001 г.). "Динамический выбор копирования: устойчивое состояние между полимеразой вируса лейкемии мышей и полимеразозависимой активностью РНКазы H определяет частоту переключения шаблонов in vivo". Труды Национальной академии наук Соединенных Штатов Америки . 98 (21): 12209– 14. Bibcode : 2001PNAS ...9812209H. doi : 10.1073/pnas.221289898 . PMC 59793. PMID 11593039.
- ^ Wain-Hobson S, Sonigo P, Danos O, Cole S, Alizon M (январь 1985). "Нуклеотидная последовательность вируса СПИДа, LAV". Cell . 40 (1): 9– 17. doi :10.1016/0092-8674(85)90303-4. PMID 2981635. S2CID 33055050.
- ^ Ratner L, Haseltine W, Patarca R, Livak KJ, Starcich B, Josephs SF, Doran ER, Rafalski JA, Whitehorn EA, Baumeister K (1985). "Полная нуклеотидная последовательность вируса СПИДа, HTLV-III". Nature . 313 (6000): 277– 84. Bibcode :1985Natur.313..277R. doi :10.1038/313277a0. PMID 2578615. S2CID 4316242.
- ^ ab Castelli JC, Levy A (2002). "ВИЧ (вирус иммунодефицита человека)". Энциклопедия рака . Т. 2 (2-е изд.). С. 407–415 .
- ^ Checkly MA, Freed EO (22 июля 2011 г.). «Биосинтез, транспортировка и включение гликопротеина оболочки ВИЧ-1». Журнал молекулярной биологии . 410 (4): 582– 608. doi :10.1016/j.jmb.2011.04.042. PMC 3139147. PMID 21762802 .
- ^ Национальный институт здравоохранения (17 июня 1998 г.). "Кристаллическая структура ключевого белка ВИЧ открывает новые цели профилактики и лечения" (пресс-релиз). Архивировано из оригинала 19 февраля 2006 г. Получено 14 сентября 2006 г.
- ^ Behrens AJ, Vasiljevic S, Pritchard LK, Harvey DJ, Andev RS, Krumm SA, Struwe WB, Cupo A, Kumar A, Zitzmann N, Seabright GE, Kramer HB, Spencer DI, Royle L, Lee JH, Klasse PJ, Burton DR, Wilson IA, Ward AB, Sanders RW, Moore JP, Doores KJ, Crispin M (март 2016 г.). «Состав и антигенные эффекты отдельных гликановых участков тримерного гликопротеина оболочки ВИЧ-1». Cell Reports . 14 (11): 2695– 706. doi :10.1016/j.celrep.2016.02.058. PMC 4805854. PMID 26972002 .
- ^ Pritchard LK, Spencer DI, Royle L, Bonomelli C, Seabright GE, Behrens AJ, Kulp DW, Menis S, Krumm SA, Dunlop DC, Crispin DJ, Bowden TA, Scanlan CN, Ward AB, Schief WR, Doores KJ, Crispin M (июнь 2015 г.). "Кластеризация гликанов стабилизирует маннозный участок ВИЧ-1 и сохраняет уязвимость к широко нейтрализующим антителам". Nature Communications . 6 : 7479. Bibcode :2015NatCo...6.7479P. doi :10.1038/ncomms8479. PMC 4500839 . PMID 26105115.
- ^ Pritchard LK, Harvey DJ, Bonomelli C, Crispin M, Doores KJ (сентябрь 2015 г.). «Клеточно- и белково-направленное гликозилирование нативной расщепленной оболочки ВИЧ-1». Журнал вирусологии . 89 (17): 8932– 44. doi : 10.1128 /JVI.01190-15. PMC 4524065. PMID 26085151.
- ^ Криспин М., Доорес К.Дж. (апрель 2015 г.). «Нацеливание полученных от хозяина гликанов на оболочечные вирусы для разработки вакцин на основе антител». Current Opinion in Virology . Viral pathogenesis • Preventive and therapeutic vaccines. 11 : 63– 9. doi :10.1016/j.coviro.2015.02.002. PMC 4827424 . PMID 25747313.
- ^ Julien JP, Cupo A, Sok D, Stanfield RL, Lyumkis D, Deller MC, Klasse PJ, Burton DR, Sanders RW, Moore JP, Ward AB, Wilson IA (декабрь 2013 г.). «Кристаллическая структура растворимого расщепленного тримера оболочки ВИЧ-1». Science . 342 (6165): 1477– 83. Bibcode :2013Sci...342.1477J. doi :10.1126/science.1245625. PMC 3886632 . PMID 24179159.
- ^ Lyumkis D, Julien JP, de Val N, Cupo A, Potter CS, Klasse PJ, Burton DR, Sanders RW, Moore JP, Carragher B, Wilson IA, Ward AB (декабрь 2013 г.). «Крио-ЭМ-структура полностью гликозилированного растворимого расщепленного тримера оболочки ВИЧ-1». Science . 342 (6165): 1484– 90. Bibcode :2013Sci...342.1484L. doi :10.1126/science.1245627. PMC 3954647 . PMID 24179160.
- ^ Sanders RW, Derking R, Cupo A, Julien JP, Yasmeen A, de Val N, Kim HJ, Blattner C, de la Peña AT, Korzun J, Golabek M, de Los Reyes K, Ketas TJ, van Gils MJ, King CR, Wilson IA, Ward AB, Klasse PJ, Moore JP (сентябрь 2013 г.). «Расщепленный растворимый тример оболочки ВИЧ-1 следующего поколения, BG505 SOSIP.664 gp140, экспрессирует множественные эпитопы для широко нейтрализующих, но не ненейтрализующих антител». PLOS Pathogens . 9 (9): e1003618. doi : 10.1371/journal.ppat.1003618 . PMC 3777863 . PMID 24068931.
- ^ Pritchard LK, Vasiljevic S, Ozorowski G, Seabright GE, Cupo A, Ringe R, Kim HJ, Sanders RW, Doores KJ, Burton DR, Wilson IA, Ward AB, Moore JP, Crispin M (июнь 2015 г.). «Структурные ограничения определяют гликозилирование тримеров оболочки ВИЧ-1». Cell Reports . 11 (10): 1604– 13. doi :10.1016/j.celrep.2015.05.017. PMC 4555872. PMID 26051934 .
- ^ де Тей С.В., Озоровский Г., Торрентс де ла Пенья А., Гуттман М., Жюльен Дж.П., ван ден Керкхоф Т.Л., Бургер Дж.А., Притчард Л.К., Пугач П., Ясмин А., Крэмптон Дж., Ху Дж., Бонтьер И., Торрес Дж.Л., Арендт Х., ДеСтефано Дж., Кофф В.К., Шуйтемейкер Х., Эггинк Д., Берхаут Б., Дин Х., ЛаБранш С., Кротти С., Криспин М., Монтефиори Д.С., Класс П.Дж., Ли К.К., Мур Дж.П., Уилсон И.А., Уорд А.Б., Сандерс Р.В. (декабрь 2015 г.). «Иммуногенность стабилизированных тримеров оболочки ВИЧ-1 с уменьшенным воздействием ненейтрализующих эпитопов». Клетка . 163 (7): 1702– 15. doi : 10.1016/j.cell.2015.11.056. PMC 4732737. PMID 26687358 .
- ^ abc Mushahwar IK (2007). "Вирусы иммунодефицита человека: молекулярная вирусология, патогенез, диагностика и лечение". Перспективы медицинской вирусологии . 13 : 75–87 . doi :10.1016/S0168-7069(06)13005-0. ISBN 9780444520739.
- ^ Li G, Piampongsant S, Faria NR, Voet A, Pineda-Peña AC, Khouri R, Lemey P, Vandamme AM, Theys K (февраль 2015 г.). «Интегрированная карта вариаций генома ВИЧ с точки зрения популяции». Retrovirology . 12 (1): 18. doi : 10.1186/s12977-015-0148-6 . PMC 4358901 . PMID 25808207.
- ^ abcdefghijklm Votteler J, Schubert U (2008). «Вирусы иммунодефицита человека: молекулярная биология». Энциклопедия вирусологии (3-е изд.). С. 517–525 .
- ^ ab Feinberg Mark B, Greene Warner C (1992). «Молекулярные исследования патогенеза вируса иммунодефицита человека типа 1». Current Opinion in Immunology . 4 (4): 466– 474. doi :10.1016/s0952-7915(06)80041-5. PMID 1356348.
- ^ ab King Steven R (1994). "ВИЧ: вирусология и механизмы заболевания". Annals of Emergency Medicine . 24 (3): 443– 449. doi :10.1016/s0196-0644(94)70181-4. PMID 7915889.
- ^ Бенко ДМ, Шварц С, Павлакис ГН, Фелбер БК (июнь 1990 г.). «Новый белок вируса иммунодефицита человека типа 1, tev, имеет общие последовательности с белками tat, env и rev». Журнал вирусологии . 64 (6): 2505–18 . doi :10.1128/JVI.64.6.2505-2518.1990. PMC 249426. PMID 2186172 .
- ^ Крупкин М., Джексон Л.Н., Ха Б., Пуглиси ЕВ. (декабрь 2020 г.). «Достижения в понимании инициации обратной транскрипции ВИЧ-1». Curr Opin Struct Biol . 65 : 175– 183. doi : 10.1016/j.sbi.2020.07.005. PMC 9973426. PMID 32916568. S2CID 221636459 .
- ^ Berkhout B (январь 1992). «Структурные особенности TAR РНК вирусов иммунодефицита человека и обезьян: филогенетический анализ». Nucleic Acids Research . 20 (1): 27– 31. doi :10.1093/nar/20.1.27. PMC 310321. PMID 1738599 .
- ^ Paillart JC, Skripkin E, Ehresmann B, Ehresmann C, Marquet R (февраль 2002 г.). «In vitro доказательства наличия псевдоузла большой протяженности в 5'-нетранслируемых и матричных кодирующих областях геномной РНК ВИЧ-1». Журнал биологической химии . 277 (8): 5995– 6004. doi : 10.1074/jbc.M108972200 . PMID 11744696.
- ^ Дамгаард К.К., Андерсен Э.С., Кнудсен Б., Городкин Дж., Кьемс Дж. (февраль 2004 г.). «Взаимодействия РНК в 5'-области генома ВИЧ-1». Журнал молекулярной биологии . 336 (2): 369–79 . doi :10.1016/j.jmb.2003.12.010. ПМИД 14757051.
- ^ Rong L, Russell RS, Hu J, Laughrea M, Wainberg MA, Liang C (сентябрь 2003 г.). «Удаление stem-loop 3 компенсируется мутациями второго сайта в белке Gag вируса иммунодефицита человека типа 1». Вирусология . 314 (1): 221– 8. doi :10.1016/S0042-6822(03)00405-7. PMID 14517075.
- ^ Ван Q, Барр I, Го F, Ли C (декабрь 2008 г.). «Доказательства новой вторичной структуры РНК в кодирующей области гена pol ВИЧ-1». РНК . 14 (12): 2478– 88. doi :10.1261/rna.1252608. PMC 2590956 . PMID 18974280.
- ^ "Взаимодействие петли gp120 V3 различных штаммов ВИЧ-1 с мощным анти-ВИЧ человеческим моноклональным антителом 447-52D". Институт Вейцмана: Отдел структурной биологии . Архивировано из оригинала 2007-07-18 . Получено 2017-04-18 .
- ^ Takeda S, Takizawa M, Miyauchi K, Urano E, Fujino M, Murakami T, Murakami T, Komano J (июнь 2016 г.). «Конформационные свойства третьей вариабельной петли гликопротеина оболочки ВИЧ-1AD8 в лигандных условиях». Biochemical and Biophysical Research Communications . 475 (1): 113– 8. doi :10.1016/j.bbrc.2016.05.051. PMID 27178216.
Внешние ссылки
- Вход Rfam для стволовой петли ВИЧ pol-1
- 3D-модель полного вириона ВИЧ1
- Liu J, Wright ER, Winkler H (2010). "3D-визуализация вирионов ВИЧ с помощью криоэлектронной томографии". Крио-ЭМ, часть C: Анализы, интерпретация и примеры . Методы в энзимологии. Том 483. С. 267– 90. doi :10.1016/S0076-6879(10)83014-9. ISBN 9780123849939. PMC 3056484 . PMID 20888479.
