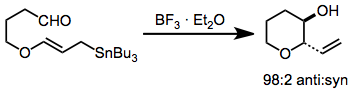Добавление органостаннана
Органостаннановое присоединение представляет собой реакцию, включающую нуклеофильное присоединение аллил- , алленил- или пропаргилстаннана к альдегиду , имину или (в редких случаях) кетону . [1] Эта реакция широко используется для карбонильного аллилирования .
Добавление органостаннана к карбонильной группе является одним из наиболее распространенных и эффективных методов получения смежных, кислородсодержащих стереоцентров в органических молекулах. Поскольку многие встречающиеся в природе полимеры содержат этот стереохимический мотив, например, полипропионат и полиацетат , добавление органостаннана было тщательно изучено химиками, работающими с натуральными продуктами, как синтетически и коммерчески важная реакция. [2] [3]
Органостаннаны — очень стабильные молекулы, пользующиеся спросом из-за простоты обращения и селективной реакционной способности. Известно, что хиральные аллилстаннаны реагируют стереоселективно, давая отдельные диастереомеры . Получение замещенных аллилстаннанов, содержащих один или два новых стереоцентра, может быть достигнуто этим методом с очень высокой степенью стереоконтроля. (ссылка?)
(1)
Однако в ходе этой реакции образуются стехиометрически относительные количества побочных продуктов, содержащих металл, а присоединение к стерически затрудненным пи-связям в кетонах встречается редко. (ссылка?)
Механизм и стереохимия
Преобладающий механизм
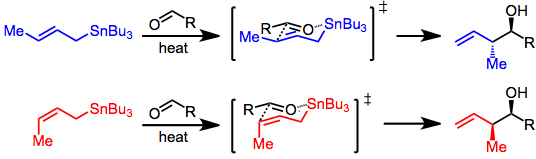
Три режима допускают добавление аллилстаннанов к карбонилам: термическое присоединение, присоединение, стимулируемое кислотой Льюиса, и присоединение с предварительным трансметаллированием. Каждый из этих режимов использует уникальную модель для стереоконтроля, но во всех случаях проводится различие между контролем реагента и субстрата. Присоединения, контролируемые субстратом, обычно включают хиральные альдегиды или имины и используют модель Фелкина-Аня . Когда все реагенты ахиральные, необходимо учитывать только простую диастереоселективность ( син против анти , см. выше). Добавление происходит через механизм S E ', включающий согласованную диссоциацию олова и образование связи CC в положении γ.
С аллилстаннаном и альдегидом в условиях высокой температуры присоединение происходит через шестичленное циклическое переходное состояние, при этом организующим элементом служит центр олова. Конфигурация двойной связи в аллилстаннане контролирует смысл диастереоселективности реакции. [4]
(2)
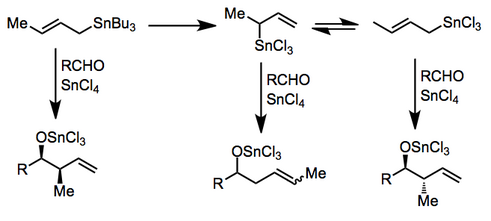
Это не относится к реакциям, промотируемым кислотой Льюиса, в которых либо ( Z )-, либо ( E )-станнан дает преимущественно син- продукт (тип II). Происхождение этой селективности обсуждалось [5] и зависит от относительных энергий ряда ациклических переходных состояний. ( E )-станнаны проявляют более высокую син- селективность, чем соответствующие ( Z )-станнаны. [6]
(3)
В присутствии некоторых кислот Льюиса трансметаллирование может происходить до добавления. Сложные реакционные смеси могут образовываться, если трансметаллирование не завершено или если существует равновесие между аллильными изомерами. Хлорид олова (IV) [7] и хлорид индия (III) [8] использовались для полезных реакций в этом режиме.
(4)
Энантиоселективные варианты
Известно большое разнообразие энантиоселективных присоединений с использованием хиральных нерацемических кислот Льюиса. Хиральный (ацилокси)боран или катализатор "CAB" 1 , система титан - BINOL 2 и система серебро - BINAP 3 обеспечивают продукты присоединения с высоким ee через механизм, стимулируемый кислотой Льюиса, описанный выше.
Область применения и ограничения
Термические присоединения станнанов ограничены (из-за высоких температур и требуемых давлений) только простыми альдегидными субстратами. Реакции, стимулируемые кислотой Льюиса, и реакции трансметаллирования гораздо мягче и достигли синтетической полезности. Внутримолекулярное присоединение дает пяти- или шестичленные кольца в условиях кислоты Льюиса или термических условиях.
(6)
Возможность включения кислородсодержащих заместителей в аллил- и алленилстаннаны существенно расширяет их сферу применения и полезность по сравнению с методами, основанными на более реакционноспособных металлоорганических соединениях. Эти соединения обычно получают путем энантиоселективного восстановления с хиральным восстановителем, таким как BINAL-H. [9] В присутствии кислоты Льюиса происходит изомеризация α-алкоксиаллилстаннанов в соответствующие γ-алкоксиизомеры. [10]
(7)
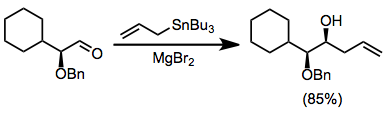
Использование хиральных электрофилов является обычным и может обеспечить «двойную диастереоселективность», если станнан также является хиральным. [11] Контроль хелатирования с использованием кислот Льюиса, таких как бромистый магний, может привести к высокой стереоселективности для реакций α-алкоксиальдегидов. [12]
(8)
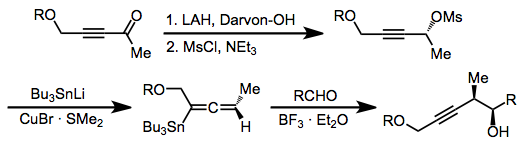
Нуклеофильное присоединение к пропаргилмезилатам или тозилатам используется для образования алленилстаннанов. [13] Эти соединения реагируют аналогично аллилстаннанам, образуя гомопропаргиловые спирты, и любой из трех описанных выше режимов реакции может быть использован с этим классом реагентов.
(9)
Имины менее реакционноспособны, чем соответствующие альдегиды, но палладиевый катализ может быть использован для облегчения присоединения к иминам. [14] Также сообщалось об использовании ионов иминия в качестве электрофилов. [15]
(10)
Синтетические приложения
Хиральный аллильный станнан 1 присоединяется к акролеину, образуя 1,5- син -диастереомер в виде одного стереоизомера. Последующая сигматропная перегруппировка еще больше увеличила расстояние между стереоцентрами. Этот шаг был выполнен на пути к (±)-патулолиду C. [16]
(11)
Повторное использование аллильного станнанового присоединения во внутримолекулярном смысле было использовано в синтезе гемибреветоксина B (один пример показан ниже). Псевдоэкваториальные положения обоих «довесков» в исходном материале приводят к наблюдаемому стереоизомеру. [17]
(12)
Похожие статьи
Ссылки
- ^ Gung, BW Org. React. 2004 , 64 , 1-112. doi :10.1002/0471264180.or064.01
- ^ Дания, ЮВ; Вебер, EJ J. Am. хим. Соц. 1984 , 106 , 7970.
- ^ Кек, GE; Догерти, С.М.; Савин, К.А. Дж. Ам. хим. Соц. 1995 , 117 , 6210.
- ^ Дания, ЮВ; Вебер, Э.Дж. Хелв. Хим. Акта 1983 , 66 , 1655.
- ^ Кек, GE; Савин, К.А.; Крессман, ЭНК; Эбботт, DE J. Org. хим. 1994 , 59 , 7889.
- ^ Кек, GE; Догерти, С.М.; Савин, К.А. Дж. Ам. хим. Соц. 1995 , 117 , 6210.
- ^ Макнил, AH; Томас, EJ Synthesis 1994 , 322.
- ^ Маршалл, Дж.А.; Хинкль, KW J. Org. хим. 1995 , 60 , 1920.
- ^ Маршалл, Дж.А.; Яблоновски, Дж. А.; Цзян, HJ Org. хим. 1999 , 64 , 2152.
- ^ Маршалл, JA; Ганг, WY Tetrahedron Lett. 1989 , 30 , 7349.
- ^ Маршалл, Дж.А.; Яшунский, Д.В. Ж. орг. хим. 1991 , 56 , 5493.
- ^ Хара, О.; Хамада, Й.; Шиоири, Т. Синлетт 1991 , 283.
- ^ Руитенберг, К.; Вермеер, П. Тетраэдр Летт. 1984 , 25 , 3019.
- ^ Накамура, Х.; Ивама, Х.; Ямамото, YJ Am. хим. Соц. 1996 , 118 , 6641.
- ^ Ямамото, Y.; Шмид, M. J. Chem. Soc., Chem. Commun. 1989 , 1310.
- ^ Дорлинг, ЕК; Томас, Э. Дж. Тетраэдр Летт. 1999 , 40 , 471.
- ^ Кадота, И.; Ямамото, YJ Org. хим. 1998 , 63 , 6597.