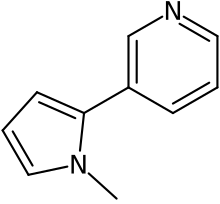
Никотирин
 | |
| Имена | |
|---|---|
| Название ИЮПАК 3-(1-метилпиррол-2-ил)пиридин | |
Другие имена
| |
| Идентификаторы | |
| |
3D модель ( JSmol ) |
|
| ЧЭБИ |
|
| ChEMBL |
|
| ChemSpider |
|
| Информационная карта ECHA | 100.006.956 |
| Номер ЕС |
|
| КЕГГ |
|
CID PubChem |
|
| УНИИ |
|
Панель инструментов CompTox ( EPA ) |
|
| |
| |
| Характеристики | |
| С10Н10Н2 | |
| Молярная масса | 158,204 г·моль −1 |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |
Никотриин — менее известный и второстепенный алкалоид табака . Он подавляет метаболизм никотина [2] [3] посредством ингибирования фермента CYP2A6 (K i = 7,5 ± 2,9). [2] [4] [5] Он также ингибирует CYP2A13 (K i = 5,6 ± 0,86), который может играть роль в метаболизме никотина. [5] [6] Никотирин образуется путем постепенного окисления никотина в электронных жидкостях и вызывает замедленный клиренс никотина и ослабленные симптомы отмены . [6]
Он обладает инсектицидными свойствами, как и никотин, и для этого свойства были синтезированы некоторые производные. [7]
Химия
Альфа-никотирин и бета-никотирин являются позиционными изомерами друг друга.
Синтез
Никотирин можно легко получить из никотина путем каталитической дегидрогенизации [8] и из биомассы табака путем каталитического пиролиза [9] .
Смотрите также
Ссылки
- ^ «Альфа-никотирин - MeSH - NCBI».
- ^ ab Denton TT, Zhang X, Cashman JR (февраль 2004 г.). «Никотин-связанные алкалоиды и метаболиты как ингибиторы человеческого цитохрома P-450 2A6». Биохимическая фармакология . 67 (4): 751– 6. doi :10.1016/j.bcp.2003.10.022. PMID 14757175.
- ^ Stålhandske T, Slanina P (сентябрь 1982 г.). «Никотирин ингибирует метаболизм никотина in vivo, не увеличивая его токсичность». Toxicology and Applied Pharmacology . 65 (3): 366–72 . doi :10.1016/0041-008x(82)90382-9. PMID 7157369.
- ^ Kramlinger VM, von Weymarn LB, Murphy SE (май 2012). «Ингибирование и инактивация цитохрома P450 2A6 и цитохрома P450 2A13 ментофураном, β-никотирином и ментолом». Химико-биологические взаимодействия . 197 ( 2– 3): 87– 92. doi :10.1016/j.cbi.2012.03.009. PMC 3362486. PMID 22486895 .
- ^ ab Stephens ES, Walsh AA, Scott EE (сентябрь 2012 г.). «Оценка селективности ингибирования для ферментов цитохрома P450 2A человека». Drug Metabolism and Disposition . 40 (9): 1797– 802. doi :10.1124/dmd.112.045161. PMC 3422547. PMID 22696418 .
- ^ ab Abramovitz A, McQueen A, Martinez RE, Williams BJ, Sumner W (сентябрь 2015 г.). «Электронные сигареты: гипотеза никотирина». Medical Hypotheses . 85 (3): 305– 10. doi : 10.1016/j.mehy.2015.06.002 . PMID 26100465.
- ^ Фрэнк, Роберт Л.; Холли, Роберт В.; Викхольм, Дональд М. (2002). «3,2'-Никотирин. Инсектицидные свойства некоторых азопроизводных1». Журнал Американского химического общества . 64 (12): 2835–2838 . doi :10.1021/ja01264a033. ISSN 0002-7863.
- ^ SHIBAGAKI, Makoto; TAKAHASHI, Kyoko; KUNO, Hideyuki; MATSUSHITA, Hajime (1988). «Получение никотирина с помощью каталитической дегидрогенизации никотина». Agricultural and Biological Chemistry . 52 (10): 2651– 2652. doi : 10.1271/bbb1961.52.2651 . ISSN 0002-1369.
- ^ Ye, Xiao-ning; Lu, Qiang; Li, Wen-tao; Gao, Pan; Hu, Bin; Zhang, Zhi-bo; Dong, Chang-qing (2016). «Селективное производство никотирина из каталитического быстрого пиролиза биомассы табака с катализатором Pd/C». Журнал аналитического и прикладного пиролиза . 117 : 88–93 . doi :10.1016/j.jaap.2015.12.012. ISSN 0165-2370.