Синапс
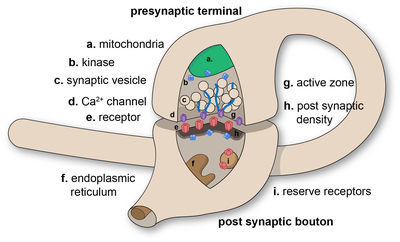
В нервной системе синапс [1] представляет собой структуру, которая позволяет нейрону (или нервной клетке) передавать электрический или химический сигнал другому нейрону или целевой эффекторной клетке. Синапсы можно классифицировать как химические или электрические, в зависимости от механизма передачи сигнала между нейронами. В случае электрических синапсов нейроны двунаправленно связаны друг с другом через щелевые контакты и имеют связанную цитоплазматическую среду. [2] [3] [4] Известно, что эти типы синапсов производят синхронную сетевую активность в мозге, [5] но также могут приводить к сложной, хаотичной динамике сетевого уровня. [6] [7] Следовательно, направленность сигнала не всегда может быть определена через электрические синапсы. [8]
Химические синапсы , с другой стороны, общаются посредством нейротрансмиттеров, высвобождаемых из пресинаптического нейрона в синаптическую щель. После высвобождения эти нейротрансмиттеры связываются со специфическими рецепторами на постсинаптической мембране, вызывая электрическую или химическую реакцию в целевом нейроне. Этот механизм позволяет осуществлять более сложную модуляцию нейронной активности по сравнению с электрическими синапсами, внося значительный вклад в пластичность и адаптивную природу нейронных цепей. [9]
Синапсы необходимы для передачи нейронных импульсов от одного нейрона к другому, [10] играя ключевую роль в обеспечении быстрой и прямой связи путем создания цепей. Кроме того, синапс служит узлом, где происходит как передача, так и обработка информации, что делает его жизненно важным средством связи между нейронами. [11]
В синапсе плазматическая мембрана нейрона, передающего сигнал ( пресинаптический нейрон), входит в тесное соприкосновение с мембраной целевой ( постсинаптической ) клетки. Как пресинаптические, так и постсинаптические участки содержат обширные массивы молекулярных механизмов , которые связывают две мембраны вместе и осуществляют процесс сигнализации. Во многих синапсах пресинаптическая часть расположена на окончаниях аксонов , а постсинаптическая часть расположена на дендрите или соме . Астроциты также обмениваются информацией с синаптическими нейронами, реагируя на синаптическую активность и, в свою очередь, регулируя нейротрансмиссию . [ 10] Синапсы (по крайней мере, химические синапсы) стабилизируются в положении с помощью молекул синаптической адгезии (SAM)[1], выступающих как из пре-, так и из постсинаптического нейрона и склеивающихся там, где они перекрываются; SAM также могут помогать в образовании и функционировании синапсов. [12] Более того, SAM координируют формирование синапсов, при этом различные типы работают вместе, достигая замечательной специфичности синапсов. [11] [13] По сути, SAM функционируют как в возбуждающих , так и в тормозных синапсах , вероятно, выступая в качестве посредника для передачи сигнала. [11]
История
Сантьяго Рамон-и-Кахаль предположил, что нейроны не являются непрерывными по всему телу, но при этом все еще взаимодействуют друг с другом, идея, известная как нейронная доктрина . [14] Слово «синапс» было введено в 1897 году английским нейрофизиологом Чарльзом Шеррингтоном в «Учебнике физиологии» Майкла Фостера . [ 1] Шеррингтон изо всех сил пытался найти хороший термин, который подчеркивал бы связь между двумя отдельными элементами, и фактический термин «синапс» был предложен английским классиком Артуром Вулгаром Верраллом , другом Фостера. [15] [16] Слово произошло от греческого синапсиса ( σύναψις ), что означает «соединение», которое, в свою очередь, происходит от синаптеина ( συνάπτειν ), от син ( σύν ) «вместе» и гаптеина ( ἅπτειν ) «скреплять». [15] [17]
Однако, пока синаптическая щель оставалась теоретической конструкцией и иногда сообщалась как разрыв между смежными аксональными окончаниями и дендритами или клеточными телами, гистологические методы, использующие лучшие световые микроскопы того времени, не могли визуально разрешить их разделение, которое, как теперь известно, составляет около 20 нм. В 1950-х годах потребовался электронный микроскоп, чтобы показать более тонкую структуру синапса с его отдельными, параллельными пре- и постсинаптическими мембранами и процессами, а также щель между ними. [18] [19] [20]
Типы

Химические и электрические синапсы — это два способа синаптической передачи.
- В химическом синапсе электрическая активность в пресинаптическом нейроне преобразуется (через активацию потенциалзависимых кальциевых каналов ) в высвобождение химического вещества, называемого нейротрансмиттером , который связывается с рецепторами, расположенными в плазматической мембране постсинаптической клетки. Нейротрансмиттер может инициировать электрический ответ или вторичный мессенджерный путь, который может либо возбуждать, либо ингибировать постсинаптический нейрон. Химические синапсы можно классифицировать в соответствии с высвобождаемым нейротрансмиттером: глутаматергические (часто возбуждающие), ГАМКергические (часто ингибирующие), холинергические (например, нервно-мышечное соединение позвоночных ) и адренергические (высвобождающие норадреналин ). Из-за сложности передачи сигнала рецептора химические синапсы могут оказывать сложное воздействие на постсинаптическую клетку.
- В электрическом синапсе пресинаптические и постсинаптические клеточные мембраны соединены специальными каналами, называемыми щелевыми контактами , которые способны пропускать электрический ток, вызывая изменения напряжения в пресинаптической клетке, чтобы вызвать изменения напряжения в постсинаптической клетке. [21] [22] Фактически, щелевые контакты облегчают прямой поток электрического тока без необходимости в нейротрансмиттерах, а также небольших молекулах, таких как кальций. [23] Таким образом, главным преимуществом электрического синапса является быстрая передача сигналов от одной клетки к другой. [21]
- Смешанные химико-электрические синапсы — это синаптические участки, которые характеризуются как щелевым соединением, так и высвобождением нейротрансмиттера. [24] [25] Такое сочетание позволяет сигналу иметь как быстрый компонент (электрический), так и медленный компонент (химический).
Формирование нейронных цепей в нервной системе, по-видимому, в значительной степени зависит от решающих взаимодействий между химическими и электрическими синапсами. Таким образом, эти взаимодействия управляют генерацией синаптической передачи. [22] Синаптическая коммуникация отличается от эфаптической связи , при которой связь между нейронами происходит через непрямые электрические поля. Аутапс — это химический или электрический синапс, который образуется, когда аксон одного нейрона синапсирует на дендриты того же нейрона.
Возбуждающие и тормозные
- Возбуждающий синапс: увеличивает вероятность деполяризации в постсинаптических нейронах и возникновения потенциала действия.
- Тормозной синапс: снижает вероятность деполяризации в постсинаптических нейронах и возникновения потенциала действия.
Приток Na+, вызванный возбуждающими нейротрансмиттерами, открывает катионные каналы, деполяризуя постсинаптическую мембрану в направлении порога потенциала действия. Напротив, ингибирующие нейротрансмиттеры вызывают меньшую деполяризацию постсинаптической мембраны, открывая либо каналы Cl-, либо K+, снижая активность. В зависимости от места их высвобождения, рецепторов, с которыми они связываются, и ионных обстоятельств, с которыми они сталкиваются, различные трансмиттеры могут быть либо возбуждающими, либо ингибирующими. Например, ацетилхолин может либо возбуждать, либо ингибировать в зависимости от типа рецепторов, с которыми он связывается. [26] Например, глутамат служит возбуждающим нейротрансмиттером, в отличие от ГАМК, которая действует как ингибирующий нейротрансмиттер. Кроме того, дофамин является нейротрансмиттером, который оказывает двойное действие, проявляя как возбуждающее, так и ингибирующее воздействие посредством связывания с различными рецепторами. [27]
Мембранный потенциал препятствует проникновению Cl- в клетку, даже если его концентрация снаружи намного выше, чем внутри. Обратный потенциал для Cl- во многих нейронах довольно отрицательный, почти равный потенциалу покоя . Открытие каналов Cl- имеет тенденцию буферизировать мембранный потенциал, но этот эффект нейтрализуется, когда мембрана начинает деполяризоваться, позволяя большему количеству отрицательно заряженных ионов Cl- проникать в клетку. Следовательно, становится сложнее деполяризовать мембрану и возбудить клетку, когда каналы Cl- открыты. Аналогичные эффекты возникают при открытии каналов K+. Значимость ингибирующих нейротрансмиттеров очевидна из эффектов токсинов, которые препятствуют их активности. Например, стрихнин связывается с глициновыми рецепторами, блокируя действие глицина и приводя к мышечным спазмам, судорогам и смерти. [26]
Интерфейсы
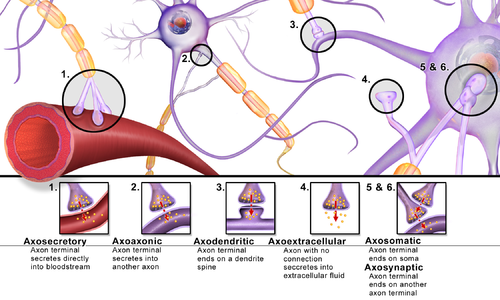
Синапсы можно классифицировать по типу клеточных структур, служащих пре- и постсинаптическими компонентами. Подавляющее большинство синапсов в нервной системе млекопитающих являются классическими аксо-дендритными синапсами (аксон, синапсирующий на дендрите), однако существует множество других расположений. Они включают, но не ограничиваются [ необходимо уточнение ] аксо-аксональными , дендро-дендритными , аксо-секреторными, аксо-цилиарными, [28] сомато-дендритными, дендро-соматическими и сомато-соматические синапсы. [ необходима цитата ]
Фактически, аксон может образовывать синапсы с дендритом, с телом клетки или с другим аксоном или окончанием аксона, а также с кровотоком или диффузно в соседнюю нервную ткань.
Преобразование химических сигналов в электрические
Нейротрансмиттеры — это крошечные сигнальные молекулы, хранящиеся в синаптических пузырьках, заключенных в мембрану, и высвобождаемые посредством экзоцитоза. Действительно, изменение электрического потенциала в пресинаптической клетке запускает высвобождение этих молекул. Присоединяясь к ионным каналам, управляемым трансмиттером, нейротрансмиттер вызывает электрическое изменение в постсинаптической клетке и быстро диффундирует через синаптическую щель. После высвобождения нейротрансмиттер быстро устраняется, либо поглощаясь нервным окончанием, которое его произвело, либо поглощаясь близлежащими глиальными клетками, либо расщепляясь специфическими ферментами в синаптической щели. Многочисленные Na+-зависимые белки-переносчики нейротрансмиттеров перерабатывают нейротрансмиттеры и позволяют клеткам поддерживать высокие скорости высвобождения.
В химических синапсах ионные каналы, управляемые трансмиттером, играют жизненно важную роль в быстром преобразовании внеклеточных химических импульсов в электрические сигналы. Эти каналы расположены в плазматической мембране постсинаптической клетки в области синапса и временно открываются в ответ на связывание молекулы нейротрансмиттера, вызывая кратковременное изменение проницаемости мембраны. Кроме того, каналы, управляемые трансмиттером, сравнительно менее чувствительны к мембранному потенциалу, чем потенциалзависимые каналы, поэтому они не способны генерировать самоусиливающееся возбуждение самостоятельно. Однако они приводят к градуированным изменениям мембранного потенциала из-за локальной проницаемости, на которую влияет количество и продолжительность высвобождения нейротрансмиттера в синапсе. [26]
Недавно было обнаружено, что для активации нейронов гиппокампа необходимо механическое напряжение — явление, которое никогда не считалось связанным с функцией синапса. [29]
Высвобождение нейротрансмиттеров
Нейротрансмиттеры связываются с ионотропными рецепторами на постсинаптических нейронах, вызывая их открытие или закрытие. [27] Изменения в количестве нейротрансмиттеров, высвобождаемых из пресинаптических нейронов, могут играть роль в регуляции эффективности синаптической передачи. Фактически, концентрация цитоплазматического кальция участвует в регуляции высвобождения нейротрансмиттеров из пресинаптических нейронов. [30]
Химическая передача включает несколько последовательных процессов:
- Синтез нейротрансмиттеров в пресинаптическом нейроне.
- Загрузка нейротрансмиттеров в секреторные пузырьки.
- Контроль высвобождения нейротрансмиттеров в синаптическую щель.
- Связывание нейротрансмиттеров с постсинаптическими рецепторами.
- Прекращение активности высвобождаемых нейротрансмиттеров. [31]
Синаптическая поляризация
Функция нейронов зависит от полярности клетки . Отличительная структура нервных клеток позволяет потенциалам действия перемещаться направленно (от дендритов к телу клетки по аксону), а затем эти сигналы принимаются и переносятся постсинаптическими нейронами или принимаются эффекторными клетками. Нервные клетки давно используются в качестве моделей для клеточной поляризации, и особый интерес представляют механизмы, лежащие в основе поляризованной локализации синаптических молекул. Сигнализация PIP2 , регулируемая IMPase, играет неотъемлемую роль в синаптической полярности.
Фосфоинозитиды ( PIP , PIP2 и PIP3 ) — это молекулы, которые, как было показано, влияют на нейронную полярность. [32] Ген ( ttx-7 ) был идентифицирован в Caenorhabditis elegans , который кодирует мио -инозитолмонофосфатазу (ИМФазу), фермент, который производит инозитол путем дефосфорилирования инозитолфосфата . Организмы с мутантными генами ttx-7 демонстрировали поведенческие и локализационные дефекты, которые были устранены экспрессией ИМФазы. Это привело к выводу, что ИМФаза необходима для правильной локализации компонентов синаптического белка. [33] [34] Ген egl-8 кодирует гомолог фосфолипазы C β (PLCβ), фермента, который расщепляет PIP2. Когда мутанты ttx-7 также имели мутантный ген egl-8 , дефекты, вызванные дефектным геном ttx-7, были в значительной степени устранены. Эти результаты предполагают, что сигнализация PIP2 устанавливает поляризованную локализацию синаптических компонентов в живых нейронах. [33]
Пресинаптическая модуляция
Модуляция высвобождения нейротрансмиттера рецепторами, сопряженными с G-белком (GPCR), является важным пресинаптическим механизмом регуляции синаптической передачи . Активация GPCR, расположенных в пресинаптическом окончании, может снизить вероятность высвобождения нейротрансмиттера. Эта пресинаптическая депрессия включает активацию G-белков типа Gi/o , которые опосредуют различные ингибирующие механизмы, включая ингибирование потенциалзависимых кальциевых каналов , активацию калиевых каналов и прямое ингибирование процесса слияния везикул .
Эндоканнабиноиды , синтезируемые и высвобождаемые из постсинаптических нейронных элементов и их родственных рецепторов , включая рецептор CB1 (GPCR) , расположенный в пресинаптическом окончании, участвуют в этой модуляции посредством ретроградного сигнального процесса, в котором эти соединения синтезируются и высвобождаются из постсинаптических нейронных элементов и возвращаются в пресинаптическое окончание, чтобы воздействовать на рецептор CB1 для кратковременной или долгосрочной синаптической депрессии, которая вызывает кратковременное или длительное снижение высвобождения нейротрансмиттера. [35]
Влияние лекарственных препаратов на лиганд-зависимые ионные каналы
Лекарства долгое время считались важнейшими целями для трансмиттер-зависимых ионных каналов. Большинство лекарств, используемых для лечения шизофрении, тревожности, депрессии и бессонницы, работают в химических синапсах, и многие из этих фармацевтических препаратов функционируют, связываясь с трансмиттер-зависимыми каналами. Например, некоторые лекарства, такие как барбитураты и транквилизаторы, связываются с рецепторами ГАМК и усиливают ингибирующий эффект нейротрансмиттера ГАМК. Таким образом, снижение концентрации ГАМК позволяет открывать каналы Cl-.
Кроме того, психоактивные препараты потенциально могут воздействовать на многие другие компоненты синаптической сигнальной системы. Высвобождение нейротрансмиттеров — сложный процесс, включающий различные типы транспортеров и механизмов удаления нейротрансмиттеров из синаптической щели. Хотя Na+-управляемые переносчики играют свою роль, другие механизмы также задействованы в зависимости от конкретной нейротрансмиттерной системы. [36] Ингибирование транспортеров нейротрансмиттеров может изменить синаптическую передачу, но эффект может варьироваться в зависимости от конкретного транспортера, нейротрансмиттера и других факторов. В некоторых случаях ингибирование может усилить передачу, в то время как в других — ослабить или нарушить ее. [37] Например, Прозак — это антидепрессант, который действует, предотвращая всасывание нейротрансмиттера серотонина. Кроме того, другие антидепрессанты действуют, ингибируя реабсорбцию как серотонина, так и норадреналина. [26]
Биогенез
В нервных окончаниях синаптические везикулы быстро производятся, чтобы компенсировать их быстрое истощение во время высвобождения нейротрансмиттера. Их биогенез включает в себя отделение белков мембраны синаптических везикул от других клеточных белков и упаковку этих отдельных белков в везикулы соответствующего размера. Кроме того, это влечет за собой эндоцитоз белков мембраны синаптических везикул от плазматической мембраны. [38]
Синаптобластический и синаптокластический относятся к синапсообразующим и синапсоудаляющим действиям в биохимической сигнальной цепи. Эта терминология связана с протоколом Бредесена для лечения болезни Альцгеймера , который концептуализирует болезнь Альцгеймера как дисбаланс между этими процессами. По состоянию на октябрь 2023 года исследования, касающиеся этого протокола, остаются небольшими, и в рамках стандартизированной структуры контроля получено мало результатов.
Роль в памяти
Потенцирование и депрессия
Широко признано, что синапс играет ключевую роль в формировании памяти . [39] Стабильность долговременной памяти может сохраняться в течение многих лет; тем не менее, синапсы, неврологическая основа памяти, очень динамичны. [40] Формирование синаптических связей в значительной степени зависит от синаптической пластичности, зависящей от активности, наблюдаемой в различных синаптических путях. Действительно, связь между формированием памяти и изменениями в синаптической эффективности позволяет усиливать нейронные взаимодействия между нейронами. Поскольку нейротрансмиттеры активируют рецепторы через синаптическую щель, связь между двумя нейронами усиливается, когда оба нейрона активны одновременно, в результате сигнальных механизмов рецептора. Формирование памяти включает в себя сложные взаимодействия между нейронными путями, включая усиление и ослабление синаптических связей, которые способствуют хранению информации. [41] Этот процесс синаптического усиления известен как долговременная потенциация (LTP) . [39]
Изменяя высвобождение нейротрансмиттеров, можно контролировать пластичность синапсов в пресинаптической клетке. Постсинаптическую клетку можно регулировать, изменяя функцию и количество ее рецепторов. Изменения в постсинаптической сигнализации чаще всего связаны с зависимой от рецептора N-метил-d-аспарагиновой кислоты (NMDAR) LTP и длительной депрессией (LTD) из-за притока кальция в постсинаптическую клетку, которые являются наиболее анализируемыми формами пластичности в возбуждающих синапсах. [42]
Механизм действия протеинкиназы
Более того, Ca2+/кальмодулин (CaM)-зависимая протеинкиназа II (CaMKII) лучше всего известна по ее роли в мозге, особенно в неокортексе и гиппокампе, поскольку она служит вездесущим медиатором клеточных сигналов Ca2+. CaMKII в изобилии присутствует в нервной системе, в основном концентрируясь в синапсах нервных клеток. Действительно, CaMKII был окончательно идентифицирован как ключевой регулятор когнитивных процессов, таких как обучение и нейронная пластичность. Было продемонстрировано первое конкретное экспериментальное доказательство давно предполагаемой функции CaMKII в хранении памяти
В то время как связывание Ca2+/CaM стимулирует активность CaMKII, Ca2+-независимая автономная активность CaMKII может также быть вызвана рядом других процессов. CaMKII становится активным путем аутофосфорилирования себя при связывании Ca2+/кальмодулина. CaMKII все еще активен и фосфорилирует себя даже после расщепления Ca2+; в результате мозг сохраняет долгосрочные воспоминания, используя этот механизм. Тем не менее, когда фермент CaMKII дефосфорилируется ферментом фосфатазой, он становится неактивным, и воспоминания теряются. Следовательно, CaMKII играет жизненно важную роль как в индукции, так и в поддержании LTP. [43]
Экспериментальные модели
По техническим причинам синаптическая структура и функция исторически изучались на необычно больших модельных синапсах, например:
- Гигантский синапс кальмара
- Нервно-мышечное соединение (НМС), холинергический синапс у позвоночных, глутаматергический у насекомых
- Ресничная чашечка в ресничном ганглии цыплят [44]
- Чашечка Хельда в стволе мозга
- Ленточный синапс в сетчатке
- Коллатеральные синапсы Шаффера в гиппокампе . Эти синапсы небольшие, но их пре- и постсинаптические нейроны хорошо разделены (CA3 и CA1 соответственно).
Синапсы и болезни
Синапсы функционируют как ансамбли в определенных мозговых сетях для контроля количества нейронной активности, что необходимо для памяти, обучения и поведения. Синаптические нарушения могут привести к различным негативным эффектам, включая нарушение обучения, памяти и когнитивных функций. [45] Фактически, изменения во внутренних молекулярных системах клеток или модификации экологических биохимических процессов могут привести к синаптической дисфункции. Синапс является основной единицей передачи информации в нервной системе, и правильное создание синаптических контактов во время развития необходимо для нормальной работы мозга. Генетические мутации могут нарушать формирование и функционирование синапсов, способствуя развитию нейродегенеративных и нейроразвивающихся расстройств. [46] Однако точная связь между конкретными мутациями и фенотипами заболеваний сложна и требует дальнейшего изучения.
Синаптические дефекты причинно связаны с ранними неврологическими заболеваниями, включая расстройства аутистического спектра (РАС), шизофрению (ШЦ) и биполярное расстройство (БР). Синаптическая дисфункция, или синаптопатия, часто связана с поздними нейродегенеративными заболеваниями, такими как болезнь Альцгеймера, Паркинсона и Хантингтона, но точные механизмы, способствующие этому явлению, до конца не изучены. [47] Эти заболевания определяются постепенной потерей когнитивных и поведенческих функций и устойчивой потерей мозговой ткани. Более того, эти ухудшения в основном связаны с постепенным накоплением белковых агрегатов в нейронах, состав которых может варьироваться в зависимости от патологии; все они оказывают одинаковое пагубное воздействие на нейронную целостность. Кроме того, большое количество мутаций, связанных со структурой и функцией синапсов, а также изменения дендритных шипиков в посмертной ткани, привело к связи между синаптическими дефектами и нарушениями развития нервной системы, такими как РАС и шизофрения, характеризующимися аномальными поведенческими или когнитивными фенотипами.
Тем не менее, из-за ограниченного доступа к тканям человека на поздних стадиях и отсутствия тщательной оценки основных компонентов заболеваний человека в доступных экспериментальных моделях животных, было трудно полностью понять происхождение и роль синаптической дисфункции в неврологических расстройствах. [48]
Дополнительные изображения
- Схема синапса. Интерактивную версию см. на learnbio.org.
- Типичный синапс центральной нервной системы
- Цикл синапса и синаптических пузырьков
- Основные элементы химической синаптической передачи
Смотрите также
Ссылки
- ^ ab Foster M, Sherrington CS (1897). Учебник физиологии . Т. 3 (7-е изд.). Лондон: Macmillan. стр. 929. ISBN 978-1-4325-1085-5.
- ^ Беннетт М. В. (1966). «ФИЗИОЛОГИЯ ЭЛЕКТРОТОННЫХ СОЕДИНЕНИЙ*». Анналы Нью-Йоркской академии наук . 137 (2): 509– 539. doi :10.1111/j.1749-6632.1966.tb50178.x. ISSN 0077-8923.
- ^ Кандель Э.Р., изд. (2013). Принципы нейронауки (5-е изд.). Нью-Йорк: МакГроу-Хилл. ISBN 978-0-07-139011-8.
- ^ Purves D, Williams SM, ред. (2004). Neuroscience (3-е изд.). Сандерленд, Массачусетс: Sinauer Associates. ISBN 978-0-87893-725-7.
- ^ Беннетт МВ, Зукин Р (2004). «Электрическое сопряжение и нейронная синхронизация в мозге млекопитающих». Neuron . 41 (4): 495– 511. doi :10.1016/s0896-6273(04)00043-1. ISSN 0896-6273.
- ^ Макаренко В., Ллинас Р. (1998-12-22). "Экспериментально определенная хаотическая фазовая синхронизация в нейронной системе". Труды Национальной академии наук . 95 (26): 15747– 15752. doi :10.1073/pnas.95.26.15747. ISSN 0027-8424. PMC 28115. PMID 9861041 .
- ^ Корн Х., Фор П. (2003). «Есть ли хаос в мозге? II. Экспериментальные доказательства и связанные модели». Comptes Rendus. Biologies (на французском). 326 (9): 787– 840. doi :10.1016/j.crvi.2003.09.011. ISSN 1768-3238.
- ^ Connors BW, Long MA (2004-07-21). «ЭЛЕКТРИЧЕСКИЕ СИНАПСЫ В МОЗГЕ МЛЕКОПИТАЮЩИХ». Annual Review of Neuroscience . 27 (1): 393– 418. doi :10.1146/annurev.neuro.26.041002.131128. ISSN 0147-006X.
- ^ Apodaca RL (2006-09-08). "Химические обзоры в Википедии". doi.org . Получено 2025-02-02 .
- ^ ab Perea G, Navarrete M, Araque A (август 2009 г.). «Трехсторонние синапсы: астроциты обрабатывают и контролируют синаптическую информацию». Trends in Neurosciences . 32 (8). Cell Press : 421– 431. doi : 10.1016/j.tins.2009.05.001. PMID 19615761. S2CID 16355401.
- ^ abc Südhof TC (июль 2021 г.). «Клеточная биология формирования синапсов». Журнал клеточной биологии . 220 (7): e202103052. doi :10.1083/jcb.202103052. PMC 8186004. PMID 34086051 .
- ^ Missler M, Südhof TC, Biederer T (апрель 2012 г.). «Синаптическая клеточная адгезия». Cold Spring Harbor Perspectives in Biology . 4 (4): a005694. doi :10.1101/cshperspect.a005694. PMC 3312681. PMID 22278667 .
- ^ Hale WD, Südhof TC, Huganir RL (январь 2023 г.). «Сконструированные молекулы адгезии управляют организацией синапсов». Труды Национальной академии наук Соединенных Штатов Америки . 120 (3): e2215905120. Bibcode : 2023PNAS..12015905H. doi : 10.1073/pnas.2215905120. PMC 9934208. PMID 36638214 .
- ^ Elias LJ, Saucier DM (2006). Нейропсихология: клинические и экспериментальные основы . Бостон: Pearson/Allyn & Bacon . ISBN 978-0-20534361-4. LCCN 2005051341. OCLC 61131869.
- ^ ab Harper D. "синапс". Онлайн-словарь этимологии .
- ^ Tansey EM (1997). «Не совершать варварства: Шеррингтон и синапс, 1897». Brain Research Bulletin . 44 (3). Elsevier : 211– 212. doi :10.1016/S0361-9230(97)00312-2. PMID 9323432. S2CID 40333336.
Слово синапс впервые появилось в 1897 году в седьмом издании «
Учебника физиологии»
Майкла Фостера .
- ^ σύναψις, συνάπτειν, σύν, ἅπτειν. Лидделл, Генри Джордж ; Скотт, Роберт ; Греко-английский лексикон в проекте «Персей» .
- ^ De Robertis ED, Bennett HS (январь 1955). «Некоторые особенности субмикроскопической морфологии синапсов у лягушек и дождевых червей». Журнал биофизической и биохимической цитологии . 1 (1): 47– 58. doi :10.1083/jcb.1.1.47. PMC 2223594. PMID 14381427 .
- ^ Palay SL, Palade GE (январь 1955). «Тонкая структура нейронов». Журнал биофизической и биохимической цитологии . 1 (1): 69– 88. doi :10.1083/jcb.1.1.69. PMC 2223597. PMID 14381429 .
- ^ Palay SL (июль 1956). «Синапсы в центральной нервной системе». Журнал биофизической и биохимической цитологии . 2 (4 Suppl): 193– 202. doi : 10.1083 /jcb.2.4.193. PMC 2229686. PMID 13357542.
- ^ ab Silverthorn DU (2007). Физиология человека: комплексный подход (4-е изд.). Сан-Франциско: Pearson/Benjamin Cummings . стр. 271. ISBN 978-0-8053-6851-2. LCCN 2005056517. OCLC 62742632.
- ^ ab Pereda AE (апрель 2014 г.). «Электрические синапсы и их функциональные взаимодействия с химическими синапсами». Nature Reviews. Neuroscience . 15 (4): 250– 263. doi :10.1038/nrn3708. PMC 4091911 . PMID 24619342.
- ^ Caire MJ, Reddy V, Varacallo M (2023). "Физиология, Синапс". StatPearls . Treasure Island (FL): StatPearls Publishing. PMID 30252303. Получено 01.01.2024 .
- ^ Sotelo C, Palay SL (февраль 1970). «Тонкая структура позднего вестибулярного ядра у крысы. II. Синаптическая организация». Brain Research . 18 (1): 93– 115. doi :10.1016/0006-8993(70)90459-2. PMID 4313893.
- ^ Strausfeld NJ, Bassemir UK (декабрь 1983 г.). «Кобальт-связанные нейроны гигантской системы волокон у двукрылых». Журнал нейроцитологии . 12 (6): 971– 91. doi :10.1007/BF01153345. PMID 6420522. S2CID 19764983.
- ^ abcd Alberts B, Johnson A, Lewis J, Raff M, Roberts K, Walter P (2002). «Ионные каналы и электрические свойства мембран». Молекулярная биология клетки (4-е изд.). Garland Science . Получено 20 января 2024 г.
- ^ ab Lasica A, Brewer C (2023). «Возбуждающая и тормозная синаптическая сигнализация». TeachMePhysiology .
- ^ Sheu SH, Upadhyayula S, Dupuy V, Pang S, Deng F, Wan J, et al. (сентябрь 2022 г.). «Серотонинергический аксон-ресничный синапс управляет ядерной сигнализацией для изменения доступности хроматина». Cell . 185 (18): 3390–3407.e18. doi : 10.1016/j.cell.2022.07.026 . PMC 9789380 . PMID 36055200. S2CID 251958800.
- Пресс-релиз университета: «Ученые обнаружили новый тип синапса в крошечных волосках нейронов». Медицинский институт Говарда Хьюза через phys.org . Получено 19 октября 2022 г.
- ^ Joy MS, Nall DL, Emon B, Lee KY, Barishman A, Ahmed M, Rahman S, Selvin PR, Saif MT (2023-12-26). «Синапсы без напряжения не срабатывают в in vitro сети нейронов гиппокампа». Труды Национальной академии наук . 120 (52): e2311995120. Bibcode : 2023PNAS..12011995J. doi : 10.1073/pnas.2311995120. ISSN 0027-8424. PMC 10756289. PMID 38113266 .
- ^ Pitman RM (сентябрь 1984). «Универсальный синапс». Журнал экспериментальной биологии . 112 (1): 199– 224. doi :10.1242/jeb.112.1.199. PMID 6150966.
- ^ Хольц РВ, Фишер СК (1999). «Синаптическая передача». В Siegel GJ, Agranoff BW, Albers RW, Fisher SK, Uhler MD (ред.). Basic Neurochemistry: Molecular, Cellular and Medical Aspects (6-е изд.). Lippincott-Raven . Получено 04.01.2024 .
- ^ Аримура Н., Кайбучи К. (декабрь 2005 г.). «Ключевые регуляторы нейрональной полярности». Neuron . 48 (6). Cell Press: 881– 884. doi : 10.1016/j.neuron.2005.11.007 . PMID 16364893.
- ^ ab Kimata T, Tanizawa Y, Can Y, Ikeda S, Kuhara A, Mori I (июнь 2012 г.). «Синаптическая полярность зависит от сигнализации фосфатидилинозитола, регулируемой мио-инозитолмонофосфатазой у Caenorhabditis elegans». Генетика . 191 (2). Genetics Society of America : 509–521 . doi :10.1534/genetics.111.137844. PMC 3374314. PMID 22446320 .
- ^ Tanizawa Y, Kuhara A, Inada H, Kodama E, Mizuno T, Mori I (декабрь 2006 г.). «Инозитолмонофосфатаза регулирует локализацию синаптических компонентов и поведение в зрелой нервной системе C. elegans». Genes & Development . 20 (23). Cold Spring Harbor Laboratory Press : 3296– 3310. doi : 10.1101/gad.1497806. PMC 1686606. PMID 17158747.
- ^ Lovinger DM (2008). "Пресинаптическая модуляция эндоканнабиноидами". В Südhof TC, Starke K (ред.). Фармакология высвобождения нейротрансмиттеров . Справочник по экспериментальной фармакологии. Т. 184. Springer Berlin Heidelberg. стр. 435–477 . doi :10.1007/978-3-540-74805-2_14. ISBN 9783540748052. PMID 18064422.
- ^ Lovinger DM (2008), «Пресинаптическая модуляция эндоканнабиноидами», Справочник экспериментальной фармакологии , Берлин, Гейдельберг: Springer Berlin Heidelberg, стр. 435–477 , ISBN 978-3-540-74804-5, получено 2025-02-02
- ^ Langguth B, Sand P, Marek R, Landgrebe M, Frank E, Hajak G, Eichhammer P (август 2009 г.). «ОТМЕНЕНО: Аллельная вариация промотора транспортера серотонина модулирует возбудимость коры». Биологическая психиатрия . 66 (3): 283– 286. doi :10.1016/j.biopsych.2009.02.005.
- ^ Desnos C, Clift-o'Grady L, Kelly RB (1995-09-01). «Биогенез синаптических везикул in vitro». Журнал клеточной биологии . 130 (5): 1041– 1049. doi :10.1083/jcb.130.5.1041. ISSN 0021-9525. PMC 2120557. PMID 7544795 .
- ^ ab Lynch MA (январь 2004). «Долгосрочная потенциация и память». Physiological Reviews . 84 (1): 87– 136. doi :10.1152/physrev.00014.2003. PMID 14715912.
- ^ Yang Y, Lu J, Zuo Y (декабрь 2018 г.). «Изменения синаптических структур, связанные с обучением, памятью и заболеваниями». Brain Science Advances . 4 (2): 99– 117. doi : 10.26599/BSA.2018.2018.9050012 .
- ^ Deason H (1966-08-12). "Научные и технологические приложения: ежегодник McGraw-Hill по науке и технике". Дэвид И. Эггенбергер, отв. ред. McGraw-Hill, Нью-Йорк, 1966. 461 стр. Иллюстрации. $24.; McGraw-Hili Современные люди науки. Джей Э. Грин, отв. ред. McGraw-Hill, Нью-Йорк, 1966. 630 стр. Иллюстрации. $19.50.; McGraw-Hill Основная библиография по науке и технике. Дэвид И. Эггенбергер, отв. ред. McGraw-Hill, Нью-Йорк, 1966. 748 стр. $19.50". Наука . 153 (3737): 731– 731. doi :10.1126/science.153.3737.731. ISSN 0036-8075.
- ^ Krugers HJ, Zhou M, Joëls M, Kindt M (11 октября 2011 г.). «Регуляция возбуждающих синапсов и страшных воспоминаний гормонами стресса». Frontiers in Behavioral Neuroscience . 5. Frontiers Media SA : 62. doi : 10.3389 /fnbeh.2011.00062 . PMC 3190121. PMID 22013419 .
- ^ Bayer KU, Schulman H (август 2019 г.). «CaM Kinase: Still Inspiring at 40». Neuron . 103 (3): 380– 394. doi :10.1016/j.neuron.2019.05.033. PMC 6688632 . PMID 31394063.
- ^ Стэнли ЭФ (1992). «Синапс чашечкового типа цилиарного ганглия цыпленка как модель быстрой холинергической передачи». Канадский журнал физиологии и фармакологии . 70 (Suppl): S73 – S77 . doi :10.1139/y92-246. PMID 1338300.
- ^ Hayes BK, Heit E (август 2004 г.). «Почему обучение и развитие могут привести к ухудшению памяти распознавания». Trends in Cognitive Sciences . 8 (8): 337– 339. doi :10.1016/j.tics.2004.05.001. ISSN 1364-6613.
- ^ Südhof TC (2021-07-05). «Клеточная биология формирования синапсов». Журнал клеточной биологии . 220 (7). doi :10.1083/jcb.202103052. ISSN 0021-9525.
- ^ Missler M, Sudhof TC, Biederer T (2012-04-01). «Синаптическая клеточная адгезия». Cold Spring Harbor Perspectives in Biology . 4 (4): a005694 – a005694 . doi :10.1101/cshperspect.a005694. ISSN 1943-0264.
- ^ Тауфик Э., Курупи Г., Зигоджанни О., Матсас Р. (05.09.2018). «Синаптическая дисфункция при нейродегенеративных и нейроразвивающих заболеваниях: обзор моделей заболеваний, основанных на индуцированных плюрипотентных стволовых клетках». Open Biology . 8 (9): 180138. doi :10.1098/rsob.180138. ISSN 2046-2441. PMC 6170506 . PMID 30185603.



