Глутаматкарбоксипептидаза II
| FOLH1 | |||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Идентификаторы | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Псевдонимы | FOLH1 , FGCP, FOLH, GCP2, GCPII, NAALAD1, NAALAdase, PSM, PSMA, mGCP, фолатгидролаза (простатический специфический мембранный антиген) 1, фолатгидролаза 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Внешние идентификаторы | ОМИМ : 600934; МГИ : 1858193; гомологен : 136782; GeneCards : FOLH1; OMA :FOLH1 – ортологи | ||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Викиданные | |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| молекула ТАГ | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 Схема реакции деградации НААГ под действием ГЦП II: ГЦП II + НААГ → комплекс ГЦП II-НААГ → Глутамат + НАА. | |||||||||
| Идентификаторы | |||||||||
| Номер ЕС | 3.4.17.21 | ||||||||
| Номер CAS | 111070-04-3 | ||||||||
| Базы данных | |||||||||
| ИнтЭнз | IntEnz вид | ||||||||
| БРЕНДА | запись BRENDA | ||||||||
| ExPASy | NiceZyme вид | ||||||||
| КЕГГ | запись KEGG | ||||||||
| МетаЦик | метаболический путь | ||||||||
| ПРИАМ | профиль | ||||||||
| Структуры PDB | RCSB PDB PDBe PDBsum | ||||||||
| Генная онтология | AmiGO / QuickGO | ||||||||
| |||||||||
Молекула TAH , также известная как N -ацетил- L -аспартил- L -глутаматпептидаза I (NAALADase I), пептидаза NAAG или простатоспецифический мембранный антиген ( PSMA ), представляет собой фермент , который у людей кодируется геном FOLH1 ( фолатгидролаза 1 ) . [5] Человеческий GCPII содержит 750 аминокислот и весит приблизительно 84 кДа. [6]
GCPII — это цинковый металлофермент , который находится в мембранах. Большая часть фермента находится во внеклеточном пространстве. GCPII — это мембранный гликопротеин II класса . Он катализирует гидролиз N-ацетиласпартилглутамата (NAAG) до глутамата и N-ацетиласпартата (NAA) в соответствии со схемой реакции справа. [7] [8]
Нейробиологи в своих исследованиях в основном используют термин NAALADase, в то время как те, кто изучает метаболизм фолатов, используют термин фолатгидролаза, а те, кто изучает рак простаты или онкологию, PSMA. Все они относятся к одному и тому же белку глутаматкарбоксипептидазе II.
Открытие
GCPII в основном экспрессируется в четырех тканях организма, включая эпителий предстательной железы, проксимальные канальцы почек, щеточную каемку тонкой кишки и ганглии нервной системы. [6] [9] [10]
Действительно, первоначальное клонирование кДНК, кодирующей ген, экспрессирующий PSMA, было выполнено с помощью РНК из линии клеток опухоли простаты LNCaP. PSMA был впервые обнаружен в линии клеток LNCaP с использованием мышиного моноклонального антитела 7E11-C5.3 (также известного под названием капромаб ), полученного из клеток селезенки мышей, обработанных клеточными мембранами LNCaP. Однако 7E11-C5.3 нацелен исключительно на внутриклеточный эпитоп PSMA, таким образом связываясь только с мертвыми или умирающими клетками. [11] [12] PSMA имеет гомологию с рецептором трансферрина и подвергается эндоцитозу, но лиганд для индукции интернализации не был идентифицирован. [13] Было обнаружено, что PSMA был тем же самым мембранным белком в тонком кишечнике, который отвечает за удаление гамма-связанных глутаматов из полигаммаглутамат фолата. Это позволяет высвобождать фолиевую кислоту, которая затем может транспортироваться в организм для использования в качестве витамина. Это привело к клонированному геномному обозначению PSMA как FOLH1 для фолатгидролазы. [14]
- PSMA(FOLH1) + фолат полигаммаглутамат(n 1-7) → PSMA (FOLH1) + фолат(поли)гаммаглутамат(n-1) + глутамат, продолжая до высвобождения фолата.
Структура
Три домена внеклеточной части GCPII — протеазный, апикальный и C-концевой домены — сотрудничают в распознавании субстрата. [8] Протеазный домен представляет собой центральный семицепочечный смешанный β-слой. β-слой фланкирован 10 α-спиралями. Апикальный домен расположен между первой и второй цепями центрального β-слоя протеазного домена. C-концевой домен представляет собой пучок из четырех спиралей вверх-вниз-вверх-вниз. [8] Апикальный, протеазный и C-концевой домены создают карман, который облегчает связывание субстрата. [15] : 14
Центральный карман имеет глубину приблизительно 2 нанометра и открывается из внеклеточного пространства в активный центр. [8] Этот активный центр содержит два иона цинка. Во время ингибирования каждый действует как лиганд для кислорода в 2-PMPA или фосфате. Также имеется один ион кальция, координированный в GCPII, далеко от активного центра. Было высказано предположение, что кальций удерживает вместе протеазный и апикальный домены. [8] Кроме того, человеческий GCPII имеет десять участков потенциального гликозилирования , и многие из этих участков (включая некоторые, далекие от каталитического домена) влияют на способность GCPII гидролизовать NAAG. [6]
Ген FOLH1 человека расположен в локусе 11p11.12 хромосомы 11. Длина гена составляет 4110 пар оснований, и он состоит из 22 экзонов. Кодируемый белок является членом семейства пептидаз M28. Ортологи гена FOLH1 человека также были идентифицированы у других млекопитающих, включая локус 7 D3; 7 48,51 cM у мышей. [16] Ген FOLH1 имеет несколько потенциальных стартовых участков и форм сплайсинга, что приводит к различиям в структуре мембранного белка, локализации и активности карбоксипептидазы в зависимости от родительской ткани. [6] [17]
Кинетика ферментов
Гидролиз NAAG с помощью GCPII подчиняется кинетике Михаэлиса-Ментен . [15] Хлоучкова и др. (2007) определили константу Михаэлиса ( K m ) для NAAG как 1,2*10 −6 ± 0,5*10 −6 M, а число оборотов ( k cat ) как 1,1 ± 0,2 с −1 . [18]
Роль в раке
Человеческий PSMA высоко экспрессируется в простате, примерно в сто раз больше, чем в большинстве других тканей. В некоторых видах рака простаты PSMA является вторым по степени активации генным продуктом, с 8-12-кратным увеличением по сравнению с уровнями в нераковых клетках простаты. [19] Из-за этой высокой экспрессии PSMA разрабатывается как потенциальный биомаркер для терапии и визуализации некоторых видов рака. [20] При раке простаты человека опухоли с более высокой экспрессией связаны с более быстрым временем прогрессирования и большим процентом пациентов, страдающих рецидивом. [21] [22] Исследования in vitro с использованием линий клеток рака простаты и молочной железы с пониженными уровнями PSMA показали значительное снижение пролиферации, миграции, инвазии, адгезии и выживания клеток. [23]
Визуализация
PSMA является целью нескольких агентов визуализации ядерной медицины при раке простаты. Экспрессия PSMA может быть визуализирована с помощью галлий-68 PSMA или фтор-18 PSMA для позитронно-эмиссионной томографии . [24] [25] [26] [27] При этом используется радиоактивно меченая малая молекула, которая связывается с высоким сродством с внеклеточным доменом рецептора PSMA. Ранее использовалось антитело, нацеленное на внутриклеточный домен ( капромабпентид индия-111 , продаваемый как Prostascint), [28] хотя уровень обнаружения был низким.
В 2020 году были опубликованы результаты рандомизированного исследования фазы 3 («исследование ProPSMA») [29] , сравнивающего ПЭТ/КТ ПСМА с галлием-68 и стандартной визуализацией (КТ и сканирование костей). Это исследование с участием 300 пациентов, проведенное в 10 исследовательских центрах, продемонстрировало превосходную точность ПЭТ/КТ ПСМА (92% против 65%), более значительные изменения в лечении (28% против 15%), менее неоднозначные/неопределенные результаты визуализации (7% против 23%) и более низкую дозу облучения (10 мЗв против 19 мЗв). Исследование пришло к выводу, что ПЭТ/КТ ПСМА является подходящей заменой традиционной визуализации, обеспечивая превосходную точность по сравнению с комбинированными результатами КТ и сканирования костей. Эта новая технология была одобрена FDA 1 декабря 2020 года. [30] Двухмодальная малая молекула, которая является позитронно-излучающей ( 18 F) и флуоресцентной, воздействует на ПСМА и была испытана на людях. Молекула обнаружила местоположение первичного и метастатического рака простаты с помощью ПЭТ , удаления рака под контролем флуоресценции, а также обнаружила отдельные раковые клетки в краях тканей. [31]
Генетическая репортерная система человеческого происхождения, излучающая позитроны и флуоресцентная (HD-GPF), использует человеческий белок PSMA, неиммуногенный, и небольшую молекулу, излучающую позитроны ( 18 F) и флуоресцентную, для двухмодальной ПЭТ и флуоресцентной визуализации геномно-модифицированных клеток, например, раковых , CRISPR/Cas9 или CAR T -клеток, у всей мыши. [32]
Терапия
PSMA также может использоваться в качестве мишени для лечения в радиотерапии с открытым источником . Лютеций-177 является бета-излучателем , который можно комбинировать с молекулами, нацеленными на PSMA, для доставки лечения к опухолям простаты. [33] Проспективное исследование фазы II продемонстрировало ответ (определяемый как снижение ПСА на 50% или более) у 64% мужчин. [34] Распространенные побочные эффекты включают сухость во рту, сухую усталость, тошноту, сухость глаз и тромбоцитопению (снижение тромбоцитов). Последующее рандомизированное исследование фазы II, исследование ANZUP TheraP, сравнило радионуклидную терапию Lu-177 PSMA-617 с химиотерапией кабазитакселом, продемонстрировав превосходные показатели ответа, более низкую токсичность и лучшие результаты, сообщаемые пациентами, с Lu-177 PSMA ( PMID 33581798). Результаты рандомизированного исследования VISION были положительными с 40% снижением смертности и 5-месячным увеличением выживаемости. III фаза исследования VISION. [35] [36]
Деградация нейротрансмиттеров
Для тех, кто изучает неврологические заболевания, NAAG является одним из трех наиболее распространенных нейротрансмиттеров, обнаруженных в центральной нервной системе [37], и когда он катализирует реакцию для производства глутамата, он также производит другой нейротрансмиттер. [8] Глутамат является распространенным и распространенным возбуждающим нейротрансмиттером в центральной нервной системе; однако, если передачи глутамата слишком много, это может убить или, по крайней мере, повредить нейроны и было связано со многими неврологическими заболеваниями и расстройствами [37], поэтому баланс, которому способствует пептидаза NAAG, весьма важен.
Потенциальные терапевтические применения
Функция мозга
Было показано, что GCPII как косвенно, так и напрямую увеличивает концентрацию глутамата во внеклеточном пространстве. [37] GCPII напрямую расщепляет NAAG на NAA и глутамат. [7] [8] Было показано, что NAAG в высокой концентрации косвенно ингибирует высвобождение нейротрансмиттеров, таких как GABA и глутамат. Он делает это посредством взаимодействия с пресинаптическими mGluR группы II и их активации. [37] Таким образом, в присутствии пептидазы NAAG концентрация NAAG контролируется, а глутамат и GABA, среди других нейротрансмиттеров, не ингибируются.
Исследователи смогли показать, что эффективные и селективные ингибиторы GCPII способны снижать уровень глутамата в мозге и даже обеспечивать защиту от апоптоза или деградации нейронов мозга во многих животных моделях инсульта, бокового амиотрофического склероза и невропатической боли. [8] Считается, что это ингибирование этих пептидаз NAAG, иногда называемых NP, обеспечивает эту защиту от апоптоза или деградации нейронов мозга за счет повышения концентрации NAAG в синапсах нейронов. [37] Затем NAAG снижает высвобождение глутамата, одновременно стимулируя высвобождение некоторых трофических факторов из глиальных клеток в центральной нервной системе, что приводит к защите от апоптоза или деградации нейронов мозга. [37] Однако важно отметить, что эти ингибиторы NP, по-видимому, не оказывают никакого влияния на нормальную функцию глутамата. [37] Ингибирование NP способно улучшить естественную регуляцию вместо активации или ингибирования рецепторов, которые могли бы нарушить этот процесс. [37] Исследования также показали, что ингибиторы NP на основе малых молекул полезны в животных моделях, которые имеют отношение к нейродегенеративным заболеваниям. [37] Некоторые конкретные приложения этого исследования включают невропатическую и воспалительную боль, травматическое повреждение мозга, ишемический инсульт, шизофрению, диабетическую невропатию, боковой амиотрофический склероз, а также наркотическую зависимость. [37] Предыдущие исследования показали, что препараты, способные снижать передачу глутамата, могут облегчить невропатическую боль, хотя возникающие в результате побочные эффекты во многом ограничили их клиническое применение. [38] Таким образом, представляется, что, поскольку GCPII привлекается исключительно с целью обеспечения источника глутамата при гиперглутаматергических и эксайтотоксических состояниях, это может быть альтернативой для предотвращения этих побочных эффектов. [38] Результаты дополнительных исследований показали, что гидролиз NAAG нарушается при шизофрении, и они показали, что определенные анатомические области мозга могут даже показывать дискретные аномалии в синтезе GCP II, поэтому NP также могут быть терапевтическими для пациентов, страдающих шизофренией. [39] Одним из основных препятствий при использовании многих мощных ингибиторов GCPII, которые были получены на сегодняшний день, как правило, являются высокополярные соединения, что вызывает проблемы, поскольку они затем не могут легко проникать через гематоэнцефалический барьер. [40]
Потенциальное использование ингибиторов пептидазы NAAG
Глутамат является «основным возбуждающим нейротрансмиттером в нервной системе человека» [37] , участвующим во множестве функций мозга. Чрезмерная стимуляция и активация рецепторов глутамата, а также «нарушения клеточных механизмов, которые защищают от неблагоприятных последствий физиологической активации рецепторов глутамата» [40], как известно, вызывают повреждение и смерть нейронов, что связано с многочисленными неврологическими заболеваниями. [37]
Из-за диапазона функций и присутствия глутамата было сложно создать глутаматергические препараты, которые не оказывали бы отрицательного влияния на другие необходимые функции и не вызывали нежелательных побочных эффектов. [41] Ингибирование пептидазы NAAG открыло возможность для специфического воздействия на лекарственные средства.
Специфические ингибиторы
С момента своего обещания возможной терапии неврологических заболеваний и целенаправленного воздействия на лекарственные препараты, ингибиторы пептидазы NAAG широко создавались и изучались. Вот несколько примеров малых молекул: [37]
- 2-ПМПА и аналоги
- Производные тиола и индолтиола
- Производные гидроксамата
- Конформационно суженные дипептидные миметики
- Ингибиторы на основе ПБДА и мочевины.
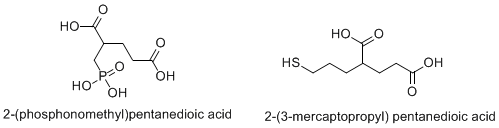
Другие потенциальные терапевтические применения
Нейропатическая и воспалительная боль
Боль, вызванная повреждением ЦНС или ПНС, была связана с увеличением концентрации глутамата. Ингибирование NAAG снижало наличие глутамата и могло, таким образом, уменьшить боль. [37] (Neale JH et al., 2005). Nagel et al. [41] использовали ингибитор 2-PMPA, чтобы показать анальгетический эффект ингибирования пептидазы NAAG. Это исследование последовало за исследованием Chen et al., [42], которое показало схожие результаты. [41]
Травма головы
Тяжелая черепно-мозговая травма (ТЧМТ) и черепно-мозговая травма (ЧМТ) широко распространены и оказывают огромное влияние. «Они являются основной причиной смерти детей и молодых людей (<25 лет) и составляют четверть всех смертей в возрастной группе от пяти до 15 лет». [43] После первоначального воздействия уровень глутамата повышается и вызывает эксайтотоксическое повреждение в процессе, который был хорошо описан. [37] Благодаря своей способности снижать уровень глутамата, ингибирование NAAG показало себя многообещающим в предотвращении неврологических повреждений, связанных с ТЧМТ и ЧМТ.
Гладить
По данным Национальной ассоциации по борьбе с инсультом [44] , инсульт является третьей по значимости причиной смерти и основной причиной инвалидности взрослых. Считается, что уровень глутамата вызывает ишемическое повреждение во время инсульта, и, таким образом, ингибирование NAAG может уменьшить это повреждение. [37]
Шизофрения
Шизофрения — это психическое расстройство, которым страдает 1% людей во всем мире. [45] Его можно смоделировать с помощью PCP на лабораторных животных, и было показано, что агонисты mGluR снижают действие препарата. NAAG является таким агонистом mGluR. Таким образом, ингибирование фермента, который снижает концентрацию NAAG, пептидазы NAAG, может обеспечить практическое лечение для снижения симптомов шизофрении. [37]
Диабетическая нейропатия
Диабет может привести к повреждению нервов, вызывая потерю чувствительности, боль или, если вегетативные нервы связаны, повреждение кровеносной, репродуктивной или пищеварительной систем, среди прочего. Говорят, что более 60% пациентов с диабетом имеют ту или иную форму невропатии, [37] однако, тяжесть заболевания значительно варьируется. Невропатия не только напрямую наносит вред и ущерб, но и может косвенно приводить к таким проблемам, как диабетические язвы, которые, в свою очередь, могут привести к ампутациям. Фактически, более половины всех ампутаций нижних конечностей в Соединенных Штатах приходится на пациентов с диабетом. [46]
Благодаря использованию ингибитора пептидазы NAAG 2-PMPA, расщепление NAAG было ингибировано и, вместе с этим, запрограммировано на гибель нейрональных клеток DRG в присутствии высоких уровней глюкозы. [47] Исследователи предположили, что причиной этого является агонистическая активность NAAG в mGluR3. Кроме того, NAAG также «предотвращал индуцированное глюкозой ингибирование роста нейритов» (Berent-Spillson, et al. 2004). В целом, это делает ингибирование GCPIII четкой модельной целью для борьбы с диабетической невропатией.
Наркомания
Шизофрения, как было описано ранее, обычно моделируется в лабораторных условиях с помощью модели животного PCP. Поскольку было показано, что ингибирование GCPIII, возможно, ограничивает шизофреническое поведение в этой модели, [37] это говорит о том, что ингибирование GCPIII, таким образом, снижает эффект PCP. Кроме того, было показано, что поощрительное действие многих наркотиков (кокаин, PCP, алкоголь, никотин и т. д.) связано с уровнями глутамата, на которые NAAG и GCPIII могут оказывать некоторое регуляторное воздействие. [37]
Подводя итог, можно сказать, что результаты многочисленных исследований лекарственных препаратов позволяют сделать следующий вывод: [37]
- Система NAAG/NP может быть вовлечена в нейронные механизмы, регулирующие вызванную сигналом тягу к кокаину, развитие кокаинового киндлинга и управление опиоидной зависимостью и поведением, связанным с потреблением алкоголя. Таким образом, ингибиторы NP могут обеспечить новую терапию для таких состояний.
Другие заболевания и расстройства
Ингибирование NAAG также изучалось в качестве метода лечения рака предстательной железы, БАС и других нейродегенеративных заболеваний, таких как болезнь Паркинсона и болезнь Хантингтона. [37]
Ссылки
- ^ abc GRCh38: Ensembl выпуск 89: ENSG00000086205 – Ensembl , май 2017 г.
- ^ abc GRCm38: Ensembl выпуск 89: ENSMUSG00000001773 – Ensembl , май 2017 г.
- ^ "Human PubMed Reference:". Национальный центр биотехнологической информации, Национальная медицинская библиотека США .
- ^ "Mouse PubMed Reference:". Национальный центр биотехнологической информации, Национальная медицинская библиотека США .
- ^ O'Keefe DS, Su SL, Bacich DJ, Horiguchi Y, Luo Y, Powell CT и др. (ноябрь 1998 г.). «Картирование, геномная организация и анализ промотора гена мембранного антигена простаты человека». Biochimica et Biophysica Acta (BBA) - Структура и экспрессия генов . 1443 ( 1–2 ): 113–127 . doi :10.1016/s0167-4781(98)00200-0. PMID 9838072.
- ^ abcd Barinka C, Sácha P, Sklenár J, Man P, Bezouska K, Slusher BS, Konvalinka J (июнь 2004 г.). «Идентификация участков N-гликозилирования на глутаматкарбоксипептидазе II, необходимых для протеолитической активности». Protein Science . 13 (6): 1627– 1635. doi :10.1110/ps.04622104. PMC 2279971 . PMID 15152093.
- ^ ab Rojas C, Frazier ST, Flanary J, Slusher BS (ноябрь 2002 г.). «Кинетика и ингибирование глутаматкарбоксипептидазы II с использованием микропланшетного анализа». Аналитическая биохимия . 310 (1): 50– 54. doi :10.1016/S0003-2697(02)00286-5. PMID 12413472.
- ^ abcdefgh Местерс Дж.Р., Баринка С., Ли В., Цукамото Т., Майер П., Слашер Б.С. и др. (март 2006 г.). «Структура глутаматкарбоксипептидазы II, мишени препарата при повреждении нейронов и раке простаты». Журнал ЭМБО . 25 (6): 1375–1384 . doi :10.1038/sj.emboj.7600969. ПМЦ 1422165 . ПМИД 16467855.
- ^ Саша П., Замечник Дж., Баринка С., Глоушова К., Вича А., Млкохова П. и др. (февраль 2007 г.). «Экспрессия глутаматкарбоксипептидазы II в мозге человека». Нейронаука . 144 (4): 1361–1372 . doi :10.1016/j.neuroscience.2006.10.022. PMID 17150306. S2CID 45351503.
- ^ Mhawech-Fauceglia P, Zhang S, Terracciano L, Sauter G, Chadhuri A, Herrmann FR, Penetrante R (март 2007 г.). «Экспрессия белка простатического специфического мембранного антигена (PSMA) в нормальных и неопластических тканях и его чувствительность и специфичность при аденокарциноме простаты: иммуногистохимическое исследование с использованием метода микрочипов множественных опухолевых тканей». Histopathology . 50 (4): 472– 483. doi :10.1111/j.1365-2559.2007.02635.x. PMID 17448023. S2CID 23454712.
- ^ Тройер, Джон К.; Фэн, Ци; Беккет, Мэри Лу; Райт, Джордж Л. (январь 1995 г.). «Биохимическая характеристика и картирование эпитопа 7E11-C5.3 простат-специфического мембранного антигена». Урологическая онкология: семинары и оригинальные исследования . 1 (1): 29– 37. doi :10.1016/1078-1439(95)00004-2. PMID 21224087.
- ^ Israeli RS, Powell CT, Fair WR, Heston WD (январь 1993 г.). «Молекулярное клонирование комплементарной ДНК, кодирующей специфический мембранный антиген простаты». Cancer Research . 53 (2): 227–230 . PMID 8417812.
- ^ Goodman OB, Barwe SP, Ritter B, McPherson PS, Vasko AJ, Keen JH и др. (Ноябрь 2007 г.). «Взаимодействие мембранного антигена простаты с клатрином и комплексом адаптерного белка-2». International Journal of Oncology . 31 (5): 1199– 1203. doi : 10.3892/ijo.31.5.1199 . PMID 17912448.
- ^ Pinto JT, Suffoletto BP, Berzin TM, Qiao CH, Lin S, Tong WP и др. (сентябрь 1996 г.). «Простат-специфический мембранный антиген: новая фолат-гидролаза в клетках карциномы простаты человека». Clinical Cancer Research . 2 (9): 1445–1451 . PMID 9816319.
- ^ ab Рахимбекова А (2021). Structure-assisted development of a continuous carboxypeptidase assay (PDF) (Дипломная работа). Прага: Карлов университет . Получено 11 ноября 2022 г.
- ^ "Folh1 фолатгидролаза 1 [Mus musculus (домовая мышь)] - Ген - NCBI". www.ncbi.nlm.nih.gov . Получено 2024-05-06 .
- ^ O'Keefe DS, Bacich DJ, Heston WD (2001). "Простатический специфический мембранный антиген". В Simons JW, Chung LW, Isaacs WB (ред.). Рак простаты: биология, генетика и новые терапевтические средства . Totowa, NJ: Humana Press. стр. 307–326 . ISBN 978-0-89603-868-4.
- ^ Глоушова К., Баринка С., Клусак В., Саша П., Млкохова П., Майер П. и др. (май 2007 г.). «Биохимическая характеристика глутаматкарбоксипептидазы III человека». Журнал нейрохимии . 101 (3): 682–696 . doi : 10.1111/j.1471-4159.2006.04341.x . ПМИД 17241121.
- ^ O'Keefe DS, Bacich DJ, Heston WD (февраль 2004 г.). «Сравнительный анализ простатического специфического мембранного антигена (PSMA) по сравнению с геном, подобным простатическому мембранному антигену». The Prostate . 58 (2): 200–210 . doi :10.1002/pros.10319. PMID 14716746. S2CID 25780520.
- ^ Wang X, Yin L, Rao P, Stein R, Harsch KM, Lee Z, Heston WD (октябрь 2007 г.). «Целевое лечение рака простаты». Журнал клеточной биохимии . 102 (3): 571– 579. doi :10.1002/jcb.21491. PMID 17685433. S2CID 46594564.
- ^ Perner S, Hofer MD, Kim R, Shah RB, Li H, Möller P, et al. (Май 2007). «Экспрессия простатспецифического мембранного антигена как предиктор прогрессирования рака простаты». Human Pathology . 38 (5): 696–701 . doi :10.1016/j.humpath.2006.11.012. PMID 17320151.
- ^ Росс Дж. С., Шихан CE, Фишер HA, Кауфман RP, Каур П., Грей К. и др. (декабрь 2003 г.). «Корреляция экспрессии мембранного антигена, специфичного для первичной опухоли простаты, с рецидивом заболевания при раке простаты». Клинические исследования рака . 9 (17): 6357– 6362. PMID 14695135.
- ^ Zhang Y, Guo Z, Du T, Chen J, Wang W, Xu K и др. (июнь 2013 г.). «Простатический специфический мембранный антиген (PSMA): новый модулятор p38 для пролиферации, миграции и выживания в клетках рака простаты». The Prostate . 73 (8): 835– 841. doi :10.1002/pros.22627. PMID 23255296. S2CID 35257177.
- ^ Maurer T, Eiber M, Schwaiger M, Gschwend JE (апрель 2016 г.). «Современное использование ПСМА-ПЭТ при лечении рака простаты». Nature Reviews. Урология . 13 (4): 226– 235. doi :10.1038/nrurol.2016.26. PMID 26902337. S2CID 2448922.
- ^ Фендлер В.П., Эйбер М., Бехешти М., Боманджи Дж., Сеси Ф., Чо С. и др. (июнь 2017 г.). « 68 Ga-PSMA ПЭТ/КТ: Совместное руководство EANM и SNMMI по визуализации рака простаты: версия 1.0». Европейский журнал ядерной медицины и молекулярной визуализации . 44 (6): 1014–1024 . doi :10.1007/s00259-017-3670-z. PMID 28283702. S2CID 5882407.
- ^ Ekmekcioglu Ö, Busstra M, Klass ND, Verzijlbergen F (октябрь 2019 г.). «Преодоление разрыва в визуализации: ПЭТ/КТ ПСМА оказывает большое влияние на планирование лечения пациентов с раком предстательной железы с биохимическим рецидивом — обзор литературы». Журнал ядерной медицины . 60 (10): 1394– 1398. doi : 10.2967/jnumed.118.222885 . PMID 30850500.
- ^ Zippel C, Ronski SC, Bohnet-Joschko S, Giesel FL, Kopka K (январь 2020 г.). «Текущий статус ПСМА-радиотрейсеров для лечения рака простаты: анализ данных перспективных испытаний, перечисленных на ClinicalTrials.gov». Pharmaceuticals . 13 (1): E12. doi : 10.3390/ph13010012 . PMC 7168903 . PMID 31940969.
- ^ Virgolini I, Decristoforo C, Haug A, Fanti S, Uprimny C (март 2018 г.). «Текущий статус тераностики при раке простаты». European Journal of Nuclear Medicine and Molecular Imaging . 45 (3): 471– 495. doi :10.1007/s00259-017-3882-2. PMC 5787224. PMID 29282518 .
- ^ Хофман М.С., Лоуренчук Н., Фрэнсис Р.Дж., Танг С., Вела И., Томас П. и др. (апрель 2020 г.). «ПЭТ-КТ простатоспецифического мембранного антигена у пациентов с раком простаты высокого риска перед лечебной операцией или радиотерапией (проПСМА): проспективное, рандомизированное, многоцентровое исследование». Lancet . 395 (10231): 1208– 1216. doi :10.1016/S0140-6736(20)30314-7. PMID 32209449. S2CID 214609500.
- ^ «FDA одобряет первый препарат для ПЭТ-визуализации, таргетированный на ПСМА, для мужчин с раком простаты». fda.gov . 1 декабря 2020 г.
- ^ Арас О, Демирдаг С, Коммиди Х, Го Х, Павлова И, Айгун А и др. (Октябрь 2021 г.). «Малая молекула, мультимодальный, [18F]-ПЭТ и флуоресцентный визуализирующий агент, нацеленный на простатический специфический мембранный антиген: первое исследование на людях». Клинический генитальный рак . 19 (5): 405–416 . doi : 10.1016/j.clgc.2021.03.011 . PMC 8449790. PMID 33879400 .
- ^ Guo H, Kommidi H, Vedvyas Y, McCloskey JE, Zhang W, Chen N и др. (Июль 2019 г.). «Флуоресцентный, [18F]-позитронно-излучающий агент для визуализации антигена мембраны простаты позволяет осуществлять генетическую отчетность в адаптированно переданных, генетически модифицированных клетках». ACS Chemical Biology . 14 (7): 1449– 1459. doi :10.1021/acschembio.9b00160. PMC 6775626 . PMID 31120734.
- ^ Эмметт Л., Уиллоусон К., Вайолет Дж., Шин Дж., Бланксби А., Ли Дж. (март 2017 г.). «Радионуклидная терапия лютецием 177 ПСМА для мужчин с раком простаты: обзор современной литературы и обсуждение практических аспектов терапии». Журнал медицинских радиационных наук . 64 (1): 52– 60. doi :10.1002/jmrs.227. PMC 5355374. PMID 28303694 .
- ^ Violet J, Sandhu S, Iravani A, Ferdinandus J, Thang SP, Kong G и др. (июнь 2020 г.). «Долгосрочное наблюдение и результаты повторного лечения в расширенном одноцентровом проспективном исследовании II фазы с участием 50 пациентов с применением тераностики 177Lu-PSMA-617 при метастатическом кастрационно-резистентном раке простаты». Журнал ядерной медицины . 61 (6): 857– 865. doi : 10.2967/jnumed.119.236414. PMC 7262220. PMID 31732676 .
- ^ Номер клинического исследования NCT03511664 для "VISION: международное, проспективное, открытое, многоцентровое, рандомизированное исследование фазы 3 177Lu-PSMA-617 в лечении пациентов с прогрессирующим PSMA-положительным метастатическим кастрационно-резистентным раком предстательной железы (мКРРПЖ)" на ClinicalTrials.gov
- ^ Wester HJ, Schottelius M (июль 2019 г.). «Радиофармацевтические препараты, нацеленные на ПСМА, для визуализации и терапии». Семинары по ядерной медицине . 49 (4): 302– 312. doi :10.1053/j.semnuclmed.2019.02.008. PMID 31227053. S2CID 155790848.
- ^ abcdefghijklmnopqrstu v Zhou J, Neale JH, Pomper MG, Kozikowski AP (декабрь 2005 г.). «Ингибиторы пептидазы NAAG и их потенциал для диагностики и терапии». Nature Reviews. Drug Discovery . 4 (12): 1015– 1026. doi :10.1038/nrd1903. PMID 16341066. S2CID 21807952.
- ^ аб Чжан В., Муракава Ю., Возняк К.М., Слашер Б., Сима А.А. (сентябрь 2006 г.). «Профилактическое и терапевтическое воздействие ингибирования GCPII (NAALADase) на болезненную и сенсорную диабетическую невропатию». Журнал неврологических наук . 247 (2): 217–223 . doi :10.1016/j.jns.2006.05.052. PMID 16780883. S2CID 11547550.
- ^ Ghose S, Weickert CS, Colvin SM, Coyle JT, Herman MM, Hyde TM, Kleinman JE (январь 2004 г.). «Экспрессия гена глутаматкарбоксипептидазы II в лобной и височной доле человека при шизофрении». Neuropsychopharmacology . 29 (1): 117– 125. doi : 10.1038/sj.npp.1300304 . PMID 14560319.
- ^ Аб Козиковски А.П., Нан Ф., Конти П., Чжан Дж., Рамадан Э., Бздега Т. и др. (февраль 2001 г.). «Разработка удивительно простых, но мощных ингибиторов глутаматкарбоксипептидазы II (NAALADase) на основе мочевины». Журнал медицинской химии . 44 (3): 298–301 . doi :10.1021/jm000406m. ПМИД 11462970.
- ^ abc Nagel J, Belozertseva I, Greco S, Kashkin V, Malyshkin A, Jirgensons A, et al. (декабрь 2006 г.). "Эффекты ингибитора пептидазы NAAG 2-PMPA в модели хронической боли - связь с концентрацией мозга". Neuropharmacology . 51 ( 7– 8): 1163– 1171. doi :10.1016/j.neuropharm.2006.07.018. PMID 16926034. S2CID 21499770.
- ^ Chen SR, Wozniak KM, Slusher BS, Pan HL (февраль 2002 г.). «Влияние 2-(фосфонометил)-пентандиовой кислоты на аллодинию и афферентные эктопические разряды в модели нейропатической боли у крыс». Журнал фармакологии и экспериментальной терапии . 300 (2): 662– 667. doi :10.1124/jpet.300.2.662. PMID 11805230. S2CID 8121145.
- ^ Tolias C, Wasserberg J (2002). «Принятие критических решений при лечении тяжелой черепно-мозговой травмы». Trauma . 4 (4): 211– 221. doi :10.1191/1460408602ta246oa. S2CID 72178402.
- ^ "Что такое инсульт". Национальная ассоциация по инсульту. Архивировано из оригинала 2006-05-16 . Получено 2009-01-15 .
- ^ "Шизофрения". Национальный центр информации о психическом здоровье. Архивировано из оригинала 2009-03-20 . Получено 15-01-2009 .
- ^ "Диабетические невропатии: повреждение нервов при диабете". Национальный институт диабета, болезней органов пищеварения и почек, Национальные институты здравоохранения. 2009. Архивировано из оригинала 2005-01-13 . Получено 2009-01-15 .
- ^ Berent-Spillson A, Robinson AM, Golovoy D, Slusher B, Rojas C, Russell JW (апрель 2004 г.). «Защита от вызванной глюкозой гибели нейронов путем ингибирования NAAG и GCP II регулируется mGluR3». Journal of Neurochemistry . 89 (1): 90–99 . doi : 10.1111/j.1471-4159.2003.02321.x . hdl : 2027.42/65724 . PMID 15030392. S2CID 7892733.
Внешние ссылки
- Онлайн -база данных MEROPS для пептидаз и их ингибиторов: M20.001
- Банк данных по белкам: Банк данных по белкам
- Глутамат+карбоксипептидаза+II в рубриках медицинских предметов Национальной медицинской библиотеки США (MeSH)
- Обзор всей структурной информации, доступной в PDB для UniProt : Q04609 (глутаматкарбоксипептидаза 2) на сайте PDBe-KB .