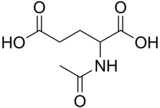
N-ацетилглутаминовая кислота
 | |
| Имена | |
|---|---|
| Название ИЮПАК 2-ацетамидопентандиовая кислота [1] | |
| Другие имена Ацетилглутаминовая кислота [ требуется ссылка ] | |
| Идентификаторы | |
3D модель ( JSmol ) |
|
| Сокращения |
|
| 1727473 Ю | |
| ЧЭБИ | |
| ChemSpider | |
| DrugBank | |
| Информационная карта ECHA | 100.024.899 |
| Номер ЕС |
|
| КЕГГ | |
| МеШ | N-ацетилглутамат |
CID PubChem |
|
| Номер RTECS |
|
| УНИИ | |
Панель инструментов CompTox ( EPA ) |
|
| |
| |
| Характеристики | |
| С7Н11Н5 | |
| Молярная масса | 189,167 г·моль −1 |
| Появление | Белые кристаллы |
| Плотность | 1 г мл −1 |
| Температура плавления | 191–194 °C (376–381 °F; 464–467 K) |
| 36 г л −1 | |
| Опасности | |
| Смертельная доза или концентрация (ЛД, ЛК): | |
LD 50 ( средняя доза ) | >7 г кг −1 (перорально, крыса) |
| Родственные соединения | |
Родственные алкановые кислоты | |
Родственные соединения | |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |
N -ацетилглутаминовая кислота (также называемая N -ацетилглутамат , сокращенно NAG , химическая формула C7H11NO5 ) [2] биосинтезируется из глутамата и ацетилорнитина орнитинацетилтрансферазой, а из глутаминовой кислоты и ацетил-КоА ферментом N -ацетилглутаматсинтазой . Обратная реакция , гидролиз ацетильнойгруппы, катализируется специфической гидролазой . Это первый промежуточный продукт, участвующий в биосинтезе аргинина у прокариот и простых эукариот, и регулятор в процессе, известном как цикл мочевины , который преобразует токсичный аммиак в мочевину для выведения из организма у позвоночных.
Открытие
N -ацетилглутаминовая кислота — это внеклеточный метаболит , выделенный из прокариота Rhizobium trifolii, который был охарактеризован с использованием многих методов определения структуры, таких как спектроскопия протонного ядерного магнитного резонанса ( 1H ЯМР), инфракрасная спектроскопия с преобразованием Фурье и газовая хроматография-масс-спектрометрия .
В Rhizobium внеклеточное накопление N -ацетилглутаминовой кислоты происходит из-за метаболизма, включающего гены nod-фактора на симбиотической плазмиде . Когда nod-факторы мутируют, вырабатывается меньше N -ацетилглутаминовой кислоты. [3]
Биосинтез
Прокариоты и простые эукариоты
У прокариот и простых эукариот N -ацетилглутаминовая кислота может вырабатываться N -ацетилглутаматсинтазой (NAGS) или орнитинацетилтрансферазой (OAT).
Синтез орнитинацетилтрансферазы (ОАТ)
ОАТ синтезирует N -ацетилглутаминовую кислоту из глутамата и ацетилорнитина и является методом выбора для производства в прокариотах, которые способны синтезировать соединение орнитин . [4]
Н-Синтез ацетилглутаматсинтазы (NAGS)
N -ацетилглутаматсинтаза — это фермент, который служит в качестве восполнителя N -ацетилглутаминовой кислоты для восполнения любой N -ацетилглутаминовой кислоты, потерянной клеткой в результате митоза или деградации. NAGS синтезирует N -ацетилглутаминовую кислоту, катализируя добавление ацетильной группы от ацетил-кофермента А к глутамату . У прокариот с нециклическим производством орнитина NAGS является единственным методом синтеза N -ацетилглутаминовой кислоты и ингибируется аргинином. [4] Считается, что ацетилирование глутамата предотвращает использование глутамата в биосинтезе пролина . [5]
Позвоночные
В отличие от прокариот, NAGS у млекопитающих усиливается аргинином, а также протаминами . Он ингибируется N -ацетилглутаминовой кислотой и ее аналогами (другими N -ацетилированными соединениями). [4]
Мозг также содержит N -ацетилглутаминовую кислоту в следовых количествах, однако экспрессия NAGS не обнаружена. Это говорит о том, что N -ацетилглутаминовая кислота вырабатывается другим ферментом в мозге, который еще предстоит определить. [4]
Биологические роли
Позвоночные и млекопитающие
У позвоночных и млекопитающих N -ацетилглутаминовая кислота является аллостерической молекулой-активатором митохондриальной карбамилфосфатсинтетазы I (CPSI), которая является первым ферментом в цикле мочевины. [6] Она запускает выработку первого промежуточного продукта цикла мочевины, карбамилфосфата . CPSI неактивна, когда N -ацетилглутаминовой кислоты нет. В печени и тонком кишечнике зависимая от N -ацетилглутаминовой кислоты CPSI производит цитруллин , второй промежуточный продукт в цикле мочевины. Распределение N -ацетилглутаминовой кислоты в клетках печени наиболее высоко в митохондриях — 56% от общей доступности N -ацетилглутаминовой кислоты, 24% в ядре и оставшиеся 20% в цитозоле. Аминоацилаза I в клетках печени и почек расщепляет N -ацетилглутаминовую кислоту до глутамата и ацетата. [7] Напротив, N -ацетилглутаминовая кислота не является аллостерическим кофактором карбамилфосфатсинтетазы, обнаруженной в цитоплазме, которая участвует в синтезе пиримидинов . [8]
Концентрация N -ацетилглутаминовой кислоты увеличивается, когда потребление белка увеличивается из-за накопления аммиака, который должен секретироваться через цикл мочевины, что подтверждает роль N -ацетилглутаминовой кислоты как кофактора для CPSI. Кроме того, N -ацетилглутаминовую кислоту можно найти во многих часто потребляемых продуктах, таких как соя, кукуруза и кофе, причем какао-порошок содержит особенно высокую концентрацию. [9]
Дефицит N -ацетилглутаминовой кислоты у людей является аутосомно-рецессивным заболеванием, которое приводит к блокировке продукции мочевины, что в конечном итоге увеличивает концентрацию аммиака в крови ( гипераммониемия ). Дефицит может быть вызван дефектами в гене, кодирующем NAGS, или дефицитом предшественников, необходимых для синтеза. [4]
Бактерии
N -ацетилглутаминовая кислота является вторым промежуточным продуктом в пути производства аргинина в Escherichia coli и производится через NAGS. [5] В этом пути киназа N -ацетилглутаминовой кислоты (NAGK) катализирует фосфорилирование гамма (третьей) карбоксильной группы N -ацетилглутаминовой кислоты с использованием фосфата, полученного при гидролизе аденозинтрифосфата ( АТФ ). [10]
Корни рассады белого клевера
Rhizobium может образовывать симбиотические отношения с корнями проростков белого клевера и образовывать колонии. Внеклеточная N -ацетилглутаминовая кислота, вырабатываемая этими бактериями, оказывает три морфологических эффекта на корни проростков белого клевера: ветвление корневых волосков, набухание кончиков корней и увеличение числа клеточных делений в недифференцированных клетках, обнаруженных на самом внешнем клеточном слое корня. Это говорит о том, что N -ацетилглутаминовая кислота участвует в стимуляции митоза. Те же эффекты наблюдались на земляничном клевере , но не на бобовых . Эффекты N -ацетилглутаминовой кислоты на виды клевера были более сильными, чем эффекты от глутамина , глутамата, аргинина или аммиака . [4]
Структура

N -ацетилглутаминовая кислота состоит из двух карбоксильных групп и амидной группы, выступающей из второго углерода. Структура N -ацетилглутаминовой кислоты при физиологическом pH (7,4) имеет все карбоксильные группы депротонированными .
Протонная ЯМР-спектроскопия
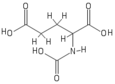

Молекулярная структура N -ацетилглутаминовой кислоты была определена с помощью протонной ЯМР-спектроскопии . [3] Протонный ЯМР выявляет наличие и расположение функциональных групп протонов на основе химических сдвигов, зарегистрированных в спектре. [11]
13Спектроскопия ЯМР 13С
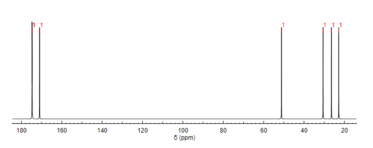
Подобно протонному ЯМР, спектроскопия ЯМР углерода-13 ( 13 C) является методом, используемым для определения молекулярной структуры. ЯМР 13 C выявляет типы углерода, присутствующего в молекуле, на основе химических сдвигов, которые соответствуют определенным функциональным группам. N -ацетилглутаминовая кислота наиболее отчетливо проявляет карбонильные атомы углерода из-за трех карбонилсодержащих заместителей. [12]
Смотрите также
Ссылки
- ^ "N-ацетил-DL-глутаминовая кислота - Сводка соединений". PubChem Compound . США: Национальный центр биотехнологической информации. 25 марта 2005 г. Идентификация . Получено 25 июня 2012 г.
- ^ Pubchem. "N-ацетил L-глутаминовая кислота". pubchem.ncbi.nlm.nih.gov . Получено 2018-06-03 .
- ^ ab Philip-Hollingsworth S, Hollingsworth RI, Dazzo FB (сентябрь 1991 г.). "N-ацетилглутаминовая кислота: внеклеточный сигнал nod Rhizobium trifolii ANU843, который индуцирует ветвление корневых волосков и образование клубеньковых примордиев в корнях белого клевера". Журнал биологической химии . 266 (25): 16854– 8. doi : 10.1016/S0021-9258(18)55380-1 . PMID 1885611.
- ^ abcdef Caldovic L, Tuchman M (июнь 2003 г.). "N-ацетилглутамат и его меняющаяся роль в ходе эволюции". The Biochemical Journal . 372 (Pt 2): 279– 90. doi :10.1042/BJ20030002. PMC 1223426. PMID 12633501 .
- ^ ab Caldara M, Dupont G, Leroy F, Goldbeter A, De Vuyst L, Cunin R (март 2008 г.). «Биосинтез аргинина в Escherichia coli: экспериментальное возмущение и математическое моделирование». Журнал биологической химии . 283 (10): 6347–58 . doi : 10.1074/jbc.M705884200 . PMID 18165237.
- ^ Auditore, Joseph V.; Wade, Littleton; Olson, Erik J. (ноябрь 1966 г.). «Встреча N -ацетил- L -глутаминовой кислоты в человеческом мозге». Journal of Neurochemistry . 13 (11): 1149– 1155. doi :10.1111/j.1471-4159.1966.tb04272.x. ISSN 0022-3042. PMID 5924663. S2CID 43263361.
- ^ Harper MS, Amanda Shen Z, Barnett JF, Krsmanovic L, Myhre A, Delaney B (ноябрь 2009 г.). " N -ацетил-глутаминовая кислота: оценка острой и 28-дневной повторной пероральной токсичности и генотоксичности". Пищевая и химическая токсикология . 47 (11): 2723– 9. doi :10.1016/j.fct.2009.07.036. PMID 19654033.
- ^ Pelley JW (2007). "Глава 14: Пурин, пиримидин и одноуглеродный метаболизм". Интегрированная биохимия Elsevier . Elsevier. стр. 117– 122. doi :10.1016/b978-0-323-03410-4.50020-1. ISBN 978-0-323-03410-4.
- ^ Hession AO, Esrey EG, Croes RA, Maxwell CA (октябрь 2008 г.). " N -ацетилглутамат и N -ацетиласпартат в соевых бобах ( Glycine max L.), кукурузе ( Zea mays L.), [исправлено] и других пищевых продуктах". Журнал сельскохозяйственной и пищевой химии . 56 (19): 9121– 6. doi :10.1021/jf801523c. PMID 18781757.
- ^ Gil Ortiz F, Ramón Maiques S, Fita I, Rubio V (август 2003 г.). «Ход фосфора в реакции N -ацетил- L -глутаматкиназы, определенный по структурам кристаллических комплексов, включая комплекс с AlF−
4переходное состояние имитация". Журнал молекулярной биологии . 331 (1): 231– 44. doi :10.1016/S0022-2836(03)00716-2. PMID 12875848. - ^ "Предсказать спектры ЯМР протона 1H". www.nmrdb.org . Получено 2018-06-03 .
- ^ "Предсказать спектры ЯМР углерода 13C". www.nmrdb.org . Получено 2018-06-03 .
Внешние ссылки
- Диаграмма на biochemj.org


