Болезнь мышц, глаз и мозга
| Болезнь мышц, глаз и мозга | |
|---|---|
| Другие имена | Мышечная дистрофия-дистрогликанопатия врожденная с аномалиями мозга и глаз A3 [1] |
 | |
| Заболевание мышц, глаз и мозга имеет аутосомно-рецессивный тип наследования . | |
| Специальность | Неврология |
| Обычное начало | Рождение или младенчество |
Заболевание мышц-глаз-мозга ( MEB ) , также известное как врожденная мышечная дистрофия-дистрогликанопатия с аномалиями мозга и глаз A3 ( MDDGA3 ), [2] является разновидностью редкой врожденной мышечной дистрофии (CMD), в основном характеризующейся гипотонией при рождении. У пациентов наблюдается мышечная дистрофия, аномалии центральной нервной системы и глазные аномалии. Состояние является дегенеративным.
MEB вызывается мутациями в гене POMGnT1, это врожденное и наследуемое как аутосомно-рецессивное заболевание . Лечения от MEB не существует. Поддерживающая терапия в основном направлена на облегчение симптомов, которые различаются в разных клинических ситуациях. Симптоматическое лечение может включать физиологическую терапию, трудотерапию, медикаментозное лечение и хирургические вмешательства. Ожидаемая продолжительность жизни пациентов с MEB составляет 10–30 лет, хотя были случаи и с более длительной продолжительностью жизни.
Признаки и симптомы
Основные признаки и симптомы МЭБ включают в себя: [3]
- Мышечные дистрофии: мышечная слабость, гипотония, атрофия мышц
- Глазные аномалии: отсутствие зрительной реакции, сильная близорукость, глаукома
- Аномалии центральной нервной системы: умственная отсталость, кортикальные пороки развития
Мышечные дистрофии
Наиболее распространенным признаком МЭБ является рождение вялых младенцев. [4] Это относится к состоянию гипотонии . Типы гипотонии, обнаруженные у пациентов, включают генерализованную гипотонию, диффузную гипотонию, врожденную гипотонию и другие подтипы. [5] Его причиной в основном является тяжелая мышечная дистрофия и частично аномалии головного мозга. [6]
У 80% - 99% людей наблюдаются различные миопатии . [2] В целом, у них проявляется сильная мышечная слабость и задержка моторного развития. Таким образом, нарушение походки (ненормальная ходьба) обнаруживается у 80% - 99% больных людей. [2] Значительная часть из них имеет ограниченную подвижность, которая не может ходить или даже вращать головой. [4] Мышечная слабость затрагивает мышцы лица, помимо скелетных мышц. В большинстве случаев она приводит к нарушению речи. [ требуется ссылка ]
Другие признаки включают ригидность суставов и/или позвоночника, снижение мышечной массы, гипорефлексию , мышечную контрактуру , спастичность , атрофию мышц и деформации позвоночника. [4]
Глазные аномалии
У людей с МЭБ часто встречаются проблемы со зрением. У пациентов низкая острота зрения, и они не могут фиксироваться на визуальных стимулах. В зависимости от тяжести, некоторые не демонстрируют никакой зрительной реакции, некоторые могут реагировать на свет, а некоторые — на объект. [7]
Более 80% пациентов сообщили о нарушении зрения. [2] Распространенные проблемы включают глаукому , миопию , страбизм («косоглазие») и атрофию зрительного нерва, которые встречаются у 80–99%. [2] Атрофия зрительного нерва включает плохую пигментацию глазного дна , тонкие кровеносные сосуды сетчатки, небольшие диски зрительного нерва и склеральную границу, а также колобому зрительного нерва (дегенерацию нижнего зрительного нерва). [3] [8] Катаракта поражает 30–79% людей. [2] Буфтальм (увеличение глазного яблока), мегалокорнеа (увеличение роговицы) и нистагм (неконтролируемое движение глазного яблока) присутствуют в некоторых редких случаях. [2] [8]
Хотя глазные аномалии в значительной степени объясняют плохое зрение, некоторые проблемы со зрением связаны с аномалиями мозга. [7]
Нарушения центральной нервной системы
МЭБ серьезно ухудшает когнитивные способности. Это отражается в аномальных показателях ЭЭГ и ЭМГ у 80% - 99% людей. [2] С той же частотой во многих случаях присутствует гидроцефалия . [2] Тяжелая форма связана со сдавлением других нервов и приводит к большему количеству осложнений. [9]
Клинические признаки включают тяжелую умственную отсталость во всех аспектах. Большинство людей имеют интеллектуальные нарушения различной степени тяжести. [2] [10] Было зафиксировано прогрессирующее ухудшение поведенческого развития. [8] Эпилепсия и припадки наблюдаются у 30% - 79% пострадавших людей. [2]
Проявления структурных пороков развития также распространены. Гипоплазия среднего мозга , моста , мозжечка и продолговатого мозга встречается часто. [11] [12] Аплазия может возникать поверх гипоплазии . Сообщалось о уплощении ствола мозга, вентрикуломегалии , пахигирии , лиссэнцефалии II типа . [10] [12] В частоте от 5% до 29% у пациентов также встречаются голопрозэнцефалия и менингоцеле . [2]
Физическая внешность
Отличительными чертами лица при МЭБ являются высокий выступающий лоб, выпуклые глаза и узкие височные области. [13]
Причины

MEB вызывается мутациями гена O-связанной маннозы β1,2-N-ацетилглюкозаминилтрансферазы 1 (POMGnT1). Патогенные варианты мутируют ген и приводят к дисфункции фермента POMGnT1. В настоящее время существует 14 клинически идентифицированных мутаций, местоположения разбросаны и рассеяны по всему гену POMGnT1. [10] [6] Различные мутации наблюдались у пациентов с MEB из разных стран, а именно: Финляндии, Швеции, Норвегии, Эстонии, США, Израиля, Испании и Италии. [6] У 14 пациентов не финского происхождения было идентифицировано 9 различных типов мутаций. [6]
Расположение мутации немного коррелирует с тяжестью симптомов с точки зрения структурных аномалий мозга. [10] Мутации, близкие к 5′ концу кодирующей области POMGnT1, приводят к относительно более тяжелому фенотипу, такому как гидроцефалия. Мутации, которые произошли близко к 3′ концу, показывают более слабые симптомы. [10]
MEB — это аутосомно-рецессивное заболевание, наследуемое от родителей. Пациенты с MEB имеют две копии патогенного варианта в своем гене. Будет риск рождения ребенка с MEB, учитывая, что оба родителя являются носителями патогенного варианта в своем гене. Больной ребенок наследует мутировавшую копию гена от каждого родителя-носителя. Вероятность наследования составляет 1 из 4, когда оба родителя являются носителями патогенного варианта. [15]
Патофизиология
Патогенез МЭБ связан с аномальным уровнем гликозилирования α-дистрогликана. Генетические мутации гена POMGnT1 снизили гликозилирование O-маннозила α-дистрогликана. Ген POMGnT1 кодирует фермент POMGnT1, трансмембранный белок II типа, находящийся в аппарате Гольджи. [14] Роль фермента POMGnT1 заключается в катализе гликозилирования, специфичного для альфа-связанной терминальной маннозы, процесса, при котором N -ацетилглюкозамин добавляется к O-связанной маннозе α-дистрогликана. [14] У людей O-маннозилирование является редким типом гликозилирования, встречающимся в скелетных мышцах, мозге и нервных гликопротеинах. [10] O-маннозилирование используется для повышения стабильности взаимодействия между внеклеточной базальной мембраной и α-дистрогликаном. Без стабилизации гликопротеин не может закрепиться в клетке, что приводит к врожденной мышечной дистрофии (ВМД), характеризующейся тяжелыми пороками развития мозга. [16]
Диагноз
Медицинская диагностика МЭБ обычно включает изучение семейного анамнеза, измерение уровня сывороточной КФК, молекулярное тестирование, биопсию мышц и визуализационное исследование. [17]
Физическое обследование
У людей с МЭБ наблюдаются характерные лицевые дисморфизмы. [18] Округлый лоб, тонкая и опущенная губа, микрогнатия, ретрузия средней части лица, короткая переносица являются возможными показательными признаками для диагностики. [2] [18] Оценка двигательного и умственного развития, зрительных способностей также дает подсказки. [ необходима ссылка ]
Генетический тест
Генетический тест может анализировать геном младенцев для подтверждения конкретной генетической мутации. Мутация в POMGNT1 является определяющим фактором в диагностике MEB. [19] Несколько мутаций, таких как [c.1539+1G→A], [c.879+5G→T], являются распространенными нуклеотидными изменениями, обнаруженными у затронутых людей. [18] [19] Обычно используемые методы собирают фетальную ДНК путем хронического отбора проб ворсин с последующим анализом сцепления и прямым секвенированием для заключения о последовательности гена POMGNT1. [20]
Определение генома помогает различать другие врожденные мышечные дистрофии до и после рождения. Однако только некоторые лаборатории предоставляют пренатальный генетический тест для скрининга MEB. [2]
Медицинская визуализация
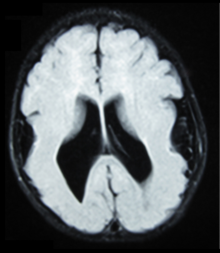
MEB можно диагностировать с помощью медицинской визуализации по общим моделям структурных аномалий мозга. Распространенная практика включает магнитно-резонансную томографию (МРТ) и компьютерную томографию (КТ). Они могут показать увеличение желудочка, отсутствие или дегенерацию прозрачной перегородки, симптомы пахигирии, аномалии мозолистого тела, лиссэнцефалию. [21] МРТ плода и УЗИ используются в качестве пренатального диагностического инструмента, если необходимо скрининг заболевания. Наблюдение, такое как общий структурный порок развития в третьем триместре, предполагает врожденную мышечную дистрофию. [22] Для подтверждения требуется дополнительный диагностический тест. [ необходима цитата ]
С клинической точки зрения МРТ предпочтительнее КТ, поскольку она позволяет точнее определить миграцию нейронов. [21] Результат, полученный при КТ, ограничен размером желудочков и расположением белого вещества, тогда как только МРТ может предоставить информацию о проблемах в коре головного мозга.
Биопсия мышц
Биопсия мышц — это способ исследования мышечной ткани. Морфология мышечных клеток и другие химические параметры могут быть использованы для диагностики заболевания мышца–глаз–мозг. [ необходима цитата ]
Гистологический анализ
Прямое исследование мышечной ткани может подтвердить мышечную дистрофию, что может подтвердить потенциальный диагноз МЭБ. У пациентов обнаруживаются миофибриллы округлой формы и значительно различающиеся по диаметру, более поздние ядра, регенерирующие волокна и угловатые волокна в результате атрофии. [17] [23]
Ферментативный анализ
Мутация MEB включает в себя нарушение функции O -маннозил ß-1,2- N -ацетилглюкозаминилтрансферазы 1. Измеряя ферментативную активность этого белка, можно подтвердить наличие MEB. [17] Фибробласты и лимфобласты выбираются в качестве участников исследования. [24]
Иммунохимия
Вестерн-блот (иммуноблот) можно использовать для обнаружения O -маннозил ß-1,2- N -ацетилглюкозаминилтрансферазы 1 в целях диагностики. [23] [25] Он помогает оценить состояние гликозилирования белка, которое он должен выполнять. [ необходима цитата ]
Трудности
Как подтип мышечной дистрофии-дистрогликанопатии, MEB часто путают с другими подтипами, включая синдром Уокера-Варбурга и врожденную мышечную дистрофию Фукуямы . [17] [26] Все эти 3 заболевания имеют схожую клиническую картину и классифицируются как Тип А (тяжелый). [26] Совпадающие результаты содержат клиническую картину и результат иммунохимии. [27] При диагностике необходимо различать их. Решающими доказательствами MEB являются:
| МЭБ | ОСВ | FCMD | |
| Эпидемиология [17] | Финляндия | Во всем мире | Япония |
| Характерный результат физического обследования | |||
| Глазные аномалии [28] | Прогрессирующая миопия с дегенерацией сетчатки | Тяжелые пороки развития | Простая миопия и катаракта без структурных изменений |
| Распространенное расположение контрактур [17] | Локоть и колено | Локоть | Локоть, колено, лодыжка и бедро |
| Характерный результат генетического теста | |||
| Основной источник дефектного гена [17] | ПОМГНТ1 | ПОМТ1, ПОМТ2 | ФКТН |
| Незначительный дефектный генный вкладчик [29] [30] [31] | ФКРП, ФКТН | FKRP, FCMD, БОЛЬШОЙ, ISPD | -- |
| Характерный результат МРТ | |||
| Кора головного мозга [32] | Диффузная дисплазия | Диффузная булыжная лиссэнцефалия | Фронтальная полимикрогирия |
| Белое вещество [32] | Неравномерное удлинение T1 и T2 | Нет миелина в головном мозге или мозжечке | Задержка церебральной миелинизации |
| Другие | |||
| Уровень сывороточной креатинкиназы [8] [33] [34] | Нормальный или повышенный | Поднят на высокий уровень | Повышенный |
МЭБ: заболевание мышц, глаз и мозга
WWS: синдром Уокера-Варбурга
FCMD: врожденная мышечная дистрофия Фукуямы
Управление
В настоящее время не существует радикального лечения какой-либо формы мышечной дистрофии, и пациентам доступна только симптоматическая помощь. [17]
Соответствующая симптоматическому лечению поддерживающая терапия: [33] [34]
| Симптом | Соответствующее поддерживающее лечение |
|---|---|
| Контрактуры | Физиотерапия и операция по освобождению сухожилий при необходимости |
| Сколиоз | Корсетирование, шинирование и корректирующие операции, такие как фиксация позвоночника |
| Мышечная слабость | Ножные ортезы, инвалидная коляска, трудотерапия |
| Респираторные проблемы | Регулярный мониторинг с помощью спирометрии, неинвазивной ночной вентиляции легких, трахеостомии, методов вспомогательного откашливания |
| Нарушения обучаемости | Специализированные образовательные программы |
| Приступы | Противосудорожные препараты [35] [ нужен лучший источник ] |
| Проблемы со зрением | Носите специальные очки [7] [35] |
| Пищевая забота | Назогастральные зонды для краткосрочного использования, гастростома при хронической необходимости |
Прогноз
MEB имеет широкий диапазон тяжести. У большинства детей с MEB ожидаемая продолжительность жизни составляет 10-30 лет. Но у некоторых пациентов с более легким типом врожденных мышечных дистрофий возможна выживаемость до более чем 70 лет. [34] Тяжесть MEB определяет его прогноз. Хотя прогноз связан с прогрессированием симптомов, поддерживающая терапия улучшает качество жизни, а также ожидаемую продолжительность жизни. [29]
Эпидемиология
Большинство случаев MEB регистрируется среди финской популяции. По оценкам, в Финляндии он поражает 1 из 50 000 новорожденных. [15] MEB также выявляется за пределами Финляндии, были случаи подозрения на MEB в Японии и Корее. [10] Однако его мировое распространение неясно. [10] По данным Европейского союза, предполагаемая распространенность MEB в Европе составляет 0,12 на 100 000. [41]
| Этническая принадлежность | Скорость обнаружения | Несущая частота |
|---|---|---|
| финский | >99% | 1 из 50 |
| Общая численность населения | 88% | 1 из 500 |
Частота носительства MEB составляет 1 из 50 в Финляндии, носители MEB обычно не проявляют никаких признаков или симптомов. Однако их потомство будет иметь более высокий риск быть пораженным MEB. [15]
История
MEB был впервые обнаружен в Финляндии. В 1978 году у пациента из Финляндии проявились такие симптомы, как врожденная мышечная слабость, сильная миопия, глаукома, оптическая деформация, умственная отсталость, гипоплазия сетчатки и т. д. [36] В 1980 году в Финляндии было выявлено еще 14 человек с похожими симптомами. [37] Похожие случаи были также опубликованы в 1989 году . [38] Заболевание было обнаружено в Голландии в 1992 году, им заболели 6 человек из 4 семей. [39] После этого было зарегистрировано больше случаев за пределами финской популяции. [ необходима цитата ]
MEB фенотипически похож на синдром Уокера-Варбурга (WWS), оба расстройства являются врожденной мышечной дистрофией. В 1990 году Сантавуори утверждал, что MEB следует отличать от WWS, поскольку MEB конкретно связан с мышечной слабостью, и для пациентов с MEB характерна относительно высокая выживаемость. [40] В том же году Добинс дополнительно изучил связь WWS и MEB. [41]
В 2001 году впервые была выявлена причина МЭБ: мутации в гене POMGNT1, приводящие к потере его функции. [42]
Ссылки
- ^ "Мышечно-глазно-мозговое заболевание | Центр информации о генетических и редких заболеваниях (GARD) – программа NCATS". rarediseases.info.nih.gov . Архивировано из оригинала 27 октября 2019 г. . Получено 27 октября 2019 г. .
- ^ abcdefghijklmn "Заболевание глаз и мышц мозга | Информационный центр по генетическим и редким заболеваниям (GARD) – программа NCATS". rarediseases.info.nih.gov . Архивировано из оригинала 2021-05-15 . Получено 2019-03-27 .
- ^ аб Фанехельм, Кристина Теар; Игге, Ян; Энгман, Мона-Лиза; Мосскин, Микаэль; Сантавуори, Пиркко; Мальм, Гунилла (2001). «Ребенок с болезнью мышц-глаз-мозга». Acta Ophthalmologica Scandinavica . 79 (1): 72–75 . doi :10.1034/j.1600-0420.2001.079001072.x. ISSN 1600-0420. ПМИД 11167293.
- ^ abc Халтия, М.; Лейво, И.; Сомер, Х.; Пихко, Х.; Паэтау, А.; Кивеля, Т.; Таркканен, А.; Томе, Ф.; Энгвалл, Э. (1997). «Заболевания мышц, глаз и головного мозга: невропатологическое исследование». Анналы неврологии . 41 (2): 173–180 . doi :10.1002/ana.410410208. ISSN 1531-8249. PMID 9029066. S2CID 32029963.
- ^ Шеной, Анант М.; Марковиц, Дженнифер А.; Боннеманн, Карстен Г.; Кришнамурти, Калпати; Босслер, Аарон Д.; Ценг, Брайан С. (март 2010 г.). «Болезнь мышц–глаз–мозга». Журнал клинических нервно-мышечных заболеваний . 11 (3): 124– 126. doi :10.1097/CND.0b013e3181c5054d. ISSN 1522-0443. PMC 2925645. PMID 20215985 .
- ^ abcd Diesen, C (2004-10-01). "Мутация POMGnT1 и фенотипический спектр при мышечно-глазно-мозговых заболеваниях". Журнал медицинской генетики . 41 (10): e115. doi :10.1136/jmg.2004.020701. ISSN 1468-6244. PMC 1735594. PMID 15466003 .
- ^ abc Пихко, Елена; Лаппи, Марьятта; Раитта, Кристина; Сайнио, Киммо; Валанн, Лина; Сомер, Ханну; Сантавуори, Пиркко (январь 1995 г.). «Глазные данные при заболевании мышц-глаз-мозга (MEB): последующее исследование». Мозг и развитие . 17 (1): 57–61 . doi :10.1016/0387-7604(94)00101-3. ISSN 0387-7604. PMID 7762765. S2CID 33926340.
- ^ abcd Фальсаперла, Рафаэле; Пратико, Андреа Д.; Руджери, Мартино; Парано, Энрико; Риццо, Рената; Корселло, Джованни; Виталити, Джованна; Павоне, Пьеро (31 августа 2016 г.). «Врожденная мышечная дистрофия: от мышц к мозгу». Итальянский журнал педиатрии . 42 (1): 78. дои : 10.1186/s13052-016-0289-9 . ISSN 1824-7288. ПМК 5006267 . ПМИД 27576556.
- ^ "O52 Зрительные вызванные потенциалы и электроретинография у пациентов со смертью мозга". Neurophysiologie Clinique/Clinical Neurophysiology . 20 : 18s. Август 1990. doi :10.1016/s0987-7053(05)80490-3. ISSN 0987-7053. S2CID 53160311.
- ^ abcdefgh Танигучи, К. (2003-03-01). «Всемирное распространение и более широкий клинический спектр заболеваний мышц, глаз и мозга». Молекулярная генетика человека . 12 (5): 527– 534. doi : 10.1093/hmg/ddg043 . ISSN 1460-2083. PMID 12588800.
- ^ Шеной, Анант М.; Марковиц, Дженнифер А.; Боннеманн, Карстен Г.; Кришнамурти, Калпати; Босслер, Аарон Д.; Ценг, Брайан С. (март 2010 г.). «Болезнь мышц–глаз–мозга». Журнал клинических нервно-мышечных заболеваний . 11 (3): 124– 126. doi :10.1097/CND.0b013e3181c5054d. ISSN 1522-0443. PMC 2925645. PMID 20215985 .
- ^ аб Радуку, Мадалина; Котарело, Росио П.; Симон, Рохелио; Камачо, Ана; Рубио-Фернандес, Маркос; Эрнандес-Лайн, Аурелио; Крусес, Хесус (февраль 2014 г.). «Клинические особенности и молекулярная характеристика пациента с заболеванием мышц, глаз и мозга: новая мутация в гене POMGNT1». Журнал детской неврологии . 29 (2): 289–294 . doi : 10.1177/0883073813509119. hdl : 10261/124385 . ISSN 0883-0738. PMID 24282183. S2CID 9209393.
- ^ Сантавуори, П.; Лейсти, Дж.; Круус, С. (1977). «Болезни мышц, глаз и мозга: новый синдром». Нейропедиатрия . 8 (S 01): 553. doi :10.1055/s-0028-1091594. ISSN 0174-304X. S2CID 57767681.
- ^ Ссылка abc , Genetics Home. "Ген POMGNT1". Genetics Home Reference . Архивировано из оригинала 2019-03-27 . Получено 2019-03-27 .
- ^ abcd "Muscle-eye brain disease - Gene : POMGNT1". GeneAware . Архивировано из оригинала 30 марта 2022 г. Получено 30 апреля 2020 г.
- ^ Strahl, Sabine; Lommel, Mark (2009-08-01). "O-маннозилирование белка: сохраняется от бактерий к человеку". Glycobiology . 19 (8): 816– 828. doi :10.1093/glycob/cwp066. ISSN 0959-6658. PMID 19429925.
- ^ abcdefgh S, Gosal Gurinder; H, Shah Hitesh (март 2011 г.). «Болезнь мышц–глаз–мозга; редкая форма синдромной врожденной мышечной дистрофии». Malaysian Orthopaedic Journal . 5 (1): 67– 70. doi : 10.5704/moj.1103.016 . ISSN 1985-2533.
- ^ abc A, Дизен, К. Сааринен, А. Пихко, Х. Розенлев, К. Корманд, Б. Добинс, В. Диегес, Дж. Валанн, Л. Йоэнсуу, Т. Лехесйоки (октябрь 2004 г.). «Мутация POMGnT1 и фенотипический спектр при заболеваниях мышц, глаз и мозга». Журнал медицинской генетики . 41 (10). Группа БМЖ: e115. дои : 10.1136/jmg.2004.020701. OCLC 679802406. PMC 1735594 . ПМИД 15466003.
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ ab Saredi, S.; Ardissone, A.; Ruggieri, A.; Mottarelli, E.; Farina, L.; Rinaldi, R.; Silvestri, E.; Gandioli, C.; D'Arrigo, S. (июль 2012 г.). "Новые точечные мутации POMGNT1 и внутригенные перестройки, связанные с заболеванием мышц–глаз–мозга". Journal of the Neurological Sciences . 318 ( 1– 2): 45– 50. doi :10.1016/j.jns.2012.04.008. ISSN 0022-510X. PMC 3405532 . PMID 22554691.
- ^ Балчи, Бурку; Моррис-Розендаль, Дебора Дж.; Челеби, Асли; Талим, Берил; Топалолу, Халук; Динсер, Первин (2006). «Пренатальная диагностика заболеваний мышц, глаз и мозга». Пренатальная диагностика . 27 (1): 51–54 . doi :10.1002/pd.1622. ISSN 0197-3851. PMID 17154333. S2CID 44662331.
- ^ ab Valanne, L.; Pihko, H.; Katevuo, K.; Karttunen, P.; Somer, H.; Santavuori, P. (август 1994 г.). "МРТ мозга при заболевании мышца–глаз–мозг (MEB)". Neuroradiology . 36 (6): 473– 476. doi :10.1007/BF00593687. ISSN 0028-3940. PMID 7991095. S2CID 19829870.
- ^ Millichap, JJ; Nguyen, T.; Ryan, ME (2010-05-31). "Обучение NeuroImages: пренатальная МРТ заболеваний мышц, глаз и мозга". Neurology . 74 (22): e101. doi : 10.1212/wnl.0b013e3181e0f84b . ISSN 0028-3878. PMID 20513809.
- ^ аб Радуку, Мадалина; Котарело, Росио П.; Симон, Рохелио; Камачо, Ана; Рубио-Фернандес, Маркос; Эрнандес-Лайн, Аурелио; Крусес, Хесус (25 ноября 2013 г.). «Клинические особенности и молекулярная характеристика пациента с заболеванием мышц, глаз и мозга» (PDF) . Журнал детской неврологии . 29 (2): 289–294 . doi : 10.1177/0883073813509119. hdl : 10261/124385 . ISSN 0883-0738. PMID 24282183. S2CID 9209393. Архивировано (PDF) из оригинала 2018-10-30 . Получено 2019-09-30 .
- ^ Vajsar, Jiri; Zhang, Wenli; Dobyns, William B.; Biggar, Doug; Holden, Kenton R.; Hawkins, Cynthia; Ray, Peter; Olney, Ann H.; Burson, Catherine M. (февраль 2006 г.). «Носители и пациенты с заболеванием мышц–глаз–мозга могут быть быстро диагностированы с помощью ферментативного анализа фибробластов и лимфобластов». Neuromuscular Disorders . 16 (2): 132– 136. doi :10.1016/j.nmd.2005.11.012. ISSN 0960-8966. PMID 16427280. S2CID 21928381.
- ^ Гейс, Тобиас; Марквард, Клаус; Рёдль, Таня; Райле, Кристоф; Ширмер, Софи; фон Калле, Текла; Борнеманн, Антье; Хер, Юте; Бланкенбург, Маркус (20 сентября 2013 г.). «Гомозиготная мутация дистрогликана, связанная с новым фенотипом, подобным заболеванию мышц, глаз и мозга, с мультикистозной лейкодистрофией». Нейрогенетика . 14 ( 3–4 ): 205–213 . doi : 10.1007/s10048-013-0374-9. ISSN 1364-6745. PMID 24052401. S2CID 15027740.
- ^ ab Амбергер, Джоанна; Боккини, Кэрол; Хамош, Ада (2011-04-05). «Новое лицо и новые проблемы для онлайн-менделевского наследования у человека (OMIM®)». Human Mutation . 32 (5): 564– 567. doi :10.1002/humu.21466. ISSN 1059-7794. PMID 21472891. S2CID 39087815.
- ^ Бертини, Энрико; Д'Амико, Адель; Гуаланди, Франческа; Петрини, Стефания (декабрь 2011 г.). «Врожденные мышечные дистрофии: краткий обзор». Семинары по детской неврологии . 18 (4): 277–288 . doi :10.1016/j.spen.2011.10.010. ПМЦ 3332154 . ПМИД 22172424.
- ^ Корманд, Бру; Авела, Кристина; Пихко, Хелена; Сантавуори, Пиркко; Талим, Берил; Топалоглу, Халук; де ла Шапель, Альберт; Лехесйоки, Анна-Элина (январь 1999 г.). «Присвоение гена заболевания мышц, глаз и мозга участку 1p32-p34 с помощью анализа сцепления и картирования гомозиготности». Американский журнал генетики человека . 64 (1): 126– 135. doi :10.1086/302206. ISSN 0002-9297. PMC 1377710. PMID 9915951 .
- ^ ab Wang, Ching H.; Bonnemann, Carsten G.; Rutkowski, Anne; Sejersen, Thomas; Bellini, Jonathan; Battista, Vanessa; Florence, Julaine M.; Schara, Ulrike; Schuler, Pamela M. (декабрь 2010 г.). «Заявление о консенсусе по стандарту лечения врожденных мышечных дистрофий». Журнал детской неврологии . 25 (12): 1559– 1581. doi : 10.1177/0883073810381924. ISSN 0883-0738. PMC 5207780. PMID 21078917 .
- ^ Kang, PB; Morrison, L.; Iannaccone, ST; Graham, RJ; Bonnemann, CG; Rutkowski, A.; Hornyak, J.; Wang, CH; North, K. (31.03.2015). «Краткое изложение рекомендаций на основе фактических данных: оценка, диагностика и лечение врожденной мышечной дистрофии: отчет подкомитета по разработке рекомендаций Американской академии неврологии и группы по рассмотрению практических вопросов Американской ассоциации нейромышечной и электродиагностической медицины». Neurology . 84 (13): 1369– 1378. doi :10.1212/WNL.00000000000001416. ISSN 0028-3878. PMC 4388744 . PMID 25825463.
- ^ Sparks, Susan E.; Quijano-Roy, Susana; Harper, Amy; Rutkowski, Anne; Gordon, Erynn; Hoffman, Eric P.; Pegoraro, Elena (1993). "Congenital Muscular Dystrophy Overview – ARCHIVED CHAPTER, FOR HISTORICAL REFERENCE ONLY". В Adam, Margaret P.; Ardinger, Holly H.; Pagon, Roberta A.; Wallace, Stephanie E. (eds.). Congenital Muscular Dystrophy Overview. University of Washington, Seattle. PMID 20301468. Архивировано из оригинала 2020-08-04 . Получено 2019-03-27 .
- ^ ab Barkovich, AJ (сентябрь 1998 г.). "Нейровизуализационные проявления и классификация врожденных мышечных дистрофий". AJNR. Американский журнал нейрорадиологии . 19 (8): 1389– 1396. ISSN 0195-6108. PMC 8338698. PMID 9763366 .
- ^ ab Kirschner, Janbernd (2013), «Врожденные мышечные дистрофии», Детская неврология, часть III , Справочник по клинической неврологии, т. 113, Elsevier, стр. 1377–1385 , doi :10.1016/b978-0-444-59565-2.00008-3, ISBN 9780444595652, PMID 23622361, заархивировано из оригинала 2019-03-27 , извлечено 2019-03-27
- ^ abc Хоррокс, И.; Мунтони, Ф.; Лонгман, К.; Джозеф, С. (2014-10-01). "GP315: Случаи нормальной или слегка повышенной креатинкиназы у пациентов с мышечно-глазно-мозговыми заболеваниями и задержка в диагностике". Нейромышечные расстройства . 24 (9): 916. doi :10.1016/j.nmd.2014.06.405. ISSN 0960-8966. S2CID 53300651.
- ^ ab Myriad Women's Health https://myriadwomenshealth.com/2014/05/hello-world/ . Получено 27.03.2019 .
{{cite web}}: Отсутствует или пусто|title=( помощь ) [ постоянная мертвая ссылка ] - ^ РАЙТТА, КРИСТИНА; ЛАММИНЕН, МАЙЯ; САНТАВУОРИ, ПИРККО; ЛЕИСТИ, ЯАККО (27 мая 2009 г.). «Офтальмологические данные о новом синдроме с поражением мышц, глаз и мозга». Акта офтальмологическая . 56 (3): 465–472 . doi :10.1111/j.1755-3768.1978.tb05700.x. ISSN 1755-375Х. PMID 581135. S2CID 28078013.
- ^ W., Eriksson, Aldur (1980). Структура населения и генетические нарушения: Мариехамм, Аландские острова, Финляндия, август 1978 г. Академический профессор ISBN 0122414500. OCLC 313921203.
{{cite book}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Сантавуори, П.; Сомер, Х.; Сайнио, К.; Рапола, Дж.; Круус, С.; Никитин Т.; Кетонен, Л.; Лейсти, Дж. (1989). «Заболевание мышц, глаз и мозга (MEB)». Мозг и развитие . 11 (3): 147–153 . doi :10.1016/S0387-7604(89)80088-9. ISSN 0387-7604. PMID 2751061. S2CID 4702708.
- ^ Leyten, QH; Gabreëls, FJ; Renier, WO; Renkawek, K.; ter Laak, HJ; Mullaart, RA (декабрь 1992 г.). «Врожденная мышечная дистрофия с пороками развития глаз и мозга у шести голландских пациентов». Neuropediatrics . 23 (6): 316– 320. doi :10.1055/s-2008-1071365. ISSN 0174-304X. PMID 1491751. S2CID 260240329.
- ^ Сантавуори, П.; Пихко, Х.; Сайнио, К.; Лаппи, М.; Сомер, Х.; Халтиа, М.; Раитта, К.; Кетонен, Л.; Лейсти, Дж. (июль 1990 г.). «Заболевание мышц-глаз-мозга и синдром Уокера-Варбурга». Американский журнал медицинской генетики . 36 (3): 371–374 . doi :10.1002/ajmg.1320360334. ISSN 0148-7299. ПМИД 2363444.
- ^ Добинс, Уильям Б.; Пагон, Роберта А.; Карри, Синтия Дж. Р .; Гринберг, Фрэнк (июль 1990 г.). «Ответ Сантавуори и др. относительно синдрома Уокера–Варбурга и заболевания мышц–глаз–мозга». Американский журнал медицинской генетики . 36 (3): 373– 374. doi :10.1002/ajmg.1320360335. ISSN 0148-7299.
- ^ Yoshida, A.; Kobayashi, K.; Manya, H.; Taniguchi, K.; Kano, H.; Mizuno, M.; Inazu, T.; Mitsuhashi, H.; Takahashi, S. (ноябрь 2001 г.). «Мышечная дистрофия и нарушение миграции нейронов, вызванные мутациями в гликозилтрансферазе, POMGnT1». Developmental Cell . 1 (5): 717– 724. doi : 10.1016/S1534-5807(01)00070-3 . ISSN 1534-5807. PMID 11709191.