Митомицины

Митомицины — это семейство натуральных продуктов , содержащих азиридин , выделенных из Streptomyces caespitosus или Streptomyces lavendulae . [1] [2] Они включают митомицин A, митомицин B и митомицин C. Когда название митомицин встречается отдельно, оно обычно относится к митомицину C, его международному непатентованному названию . Митомицин C используется в качестве лекарства для лечения различных расстройств, связанных с ростом и распространением клеток.
Биосинтез
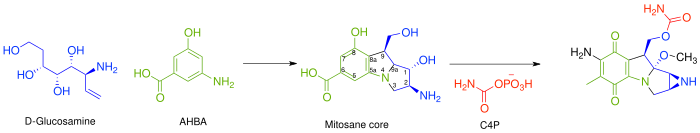
В целом, биосинтез всех митомицинов происходит посредством комбинации 3-амино-5-гидроксибензойной кислоты (AHBA), D -глюкозамина и карбамоилфосфата для формирования ядра митозана, за которым следуют определенные этапы адаптации. [3] Ключевой промежуточный продукт, AHBA, является общим предшественником других противораковых препаратов, таких как рифамицин и ансамицин.
В частности, биосинтез начинается с добавления фосфоенолпирувата (PEP) к эритрозо-4-фосфату (E4P) с еще не открытым ферментом, который затем аммиачится с образованием 4-амино-3-дезокси- D -арабиногептулозоновой кислоты-7-фосфата (aminoDHAP). Затем DHQ-синтаза катализирует замыкание кольца с образованием 4-амино-3-дегидрохината (aminoDHQ), который затем подвергается двойному окислению через аминоDHQ-дегидратазу с образованием 4-аминодегидрошикимата (aminoDHS). Ключевой промежуточный продукт, 3-амино-5-гидроксибензойная кислота (AHBA), производится путем ароматизации AHBA-синтазой.
Синтез ключевого промежуточного продукта — 3-амино-5-гидроксибензойной кислоты.
Ядро митозана синтезируется, как показано ниже, посредством конденсации AHBA и D -глюкозамина , хотя не было охарактеризовано ни одного конкретного фермента, который опосредует эту трансформацию. После того, как эта конденсация произошла, ядро митозана подгоняется различными ферментами. И последовательность, и идентичность этих шагов еще предстоит определить.
- Полное восстановление C-6 – вероятно, через F420-зависимую тетрагидрометаноптерин (H4MPT) редуктазу и H4MPT:CoM метилтрансферазу
- Гидроксилирование C-5, C-7 (с последующим трансаминированием) и C-9a. – Вероятно, через цитохром P450 монооксигеназу или бензоатгидроксилазу
- O-метилирование в C-9a – вероятно, через SAM-зависимую метилтрансферазу
- Окисление при С-5 и С8 – неизвестно
- Внутримолекулярное аминирование с образованием азиридина – Неизвестно
- Карбамоилирование по C-10 – карбамоилтрансфераза, при этом карбамоилфосфат (C4P) образуется из L-цитруллина или L-аргинина
Биологические эффекты
У бактерии Legionella pneumophila митомицин C индуцирует способность к трансформации . [4] Естественная трансформация — это процесс переноса ДНК между клетками, который рассматривается как форма бактериального полового взаимодействия. У плодовой мушки Drosophila melanogaster воздействие митомицина C увеличивает рекомбинацию во время мейоза, ключевой стадии полового цикла. [5] У растения Arabidopsis thaliana мутантные штаммы, дефектные в генах, необходимых для рекомбинации во время мейоза и митоза, гиперчувствительны к уничтожению митомицином C. [6]
Медицинское применение и исследования
Было показано, что митомицин С обладает активностью против персистентов стационарной фазы , вызванных Borrelia burgdorferi , фактором болезни Лайма . [7] [8] Митомицин С используется для лечения рака поджелудочной железы и желудка , [9] и находится на стадии клинических исследований на предмет его потенциала для лечения желудочно-кишечных стриктур , [10] заживления ран после хирургии глаукомы , [11] хирургии роговицы эксимерным лазером [12] и эндоскопической дакриоцисториностомии . [13]
Ссылки
- ^ Clokie MR , Kropinski AM (2009). Бактериофаги: методы и протоколы . Humana Press. ISBN 9781603271646. OCLC 297169927.
- ^ Danshiitsoodol N, de Pinho CA, Matoba Y, Kumagai T, Sugiyama M (июль 2006 г.). «Связывающий белок митомицина C (MMC) из микроорганизмов, продуцирующих MMC, защищает от летального эффекта блеомицина: кристаллографический анализ для выяснения способа связывания антибиотика с белком». Журнал молекулярной биологии . 360 (2): 398– 408. doi :10.1016/j.jmb.2006.05.017. PMID 16756991.
- ^ Mao Y, Varoglu M, Sherman DH (апрель 1999 г.). «Молекулярная характеристика и анализ кластера генов биосинтеза для противоопухолевого антибиотика митомицина C из Streptomyces lavendulae NRRL 2564». Химия и биология . 6 (4): 251– 263. doi : 10.1016/S1074-5521(99)80040-4 . PMID 10099135.
- ^ Charpentier X, Kay E, Schneider D, Shuman HA (март 2011 г.). «Антибиотики и УФ-излучение вызывают способность к естественной трансформации у Legionella pneumophila». Журнал бактериологии . 193 (5): 1114– 1121. doi :10.1128/JB.01146-10. PMC 3067580. PMID 21169481 .
- ^ Schewe MJ, Suzuki DT, Erasmus U (июль 1971 г.). «Генетические эффекты митомицина C у Drosophila melanogaster. II. Индуцированная мейотическая рекомбинация». Mutation Research . 12 (3): 269– 279. doi :10.1016/0027-5107(71)90015-7. PMID 5563942.
- ^ Bleuyard JY, Gallego ME, Savigny F, White CI (февраль 2005 г.). «Различные требования к паралогам Arabidopsis Rad51 в мейозе и репарации ДНК». The Plant Journal . 41 (4): 533– 545. doi :10.1111/j.1365-313X.2004.02318.x. PMID 15686518.
- ^ Feng J, Shi W, Zhang S, Zhang Y (июнь 2015 г.). «Идентификация новых соединений с высокой активностью против стационарной фазы Borrelia burgdorferi из коллекции соединений NCI». Emerging Microbes & Infections . 4 (6): e31. doi :10.1038/emi.2015.31. PMC 5176177 . PMID 26954881.
- ^ Sharma B, Brown AV, Matluck NE, Hu LT, Lewis K (август 2015 г.). «Borrelia burgdorferi, возбудитель болезни Лайма, формирует устойчивые к лекарствам персистирующие клетки». Antimicrobial Agents and Chemotherapy . 59 (8): 4616– 4624. doi :10.1128/AAC.00864-15. PMC 4505243 . PMID 26014929.
- ^ "Митомицин". Drugs.com. 2017. Получено 11 ноября 2017 .
- ^ Rustagi T, Aslanian HR, Laine L (2015). «Лечение рефрактерных желудочно-кишечных стриктур с помощью митомицина C: систематический обзор». Журнал клинической гастроэнтерологии . 49 (10): 837– 847. doi :10.1097/MCG.00000000000000295. PMID 25626632. S2CID 5867992.
- ^ Cabourne E, Clarke JC, Schlottmann PG, Evans JR (ноябрь 2015 г.). «Митомицин C против 5-фторурацила для заживления ран при хирургии глаукомы». База данных систематических обзоров Cochrane . 2015 (11): CD006259. doi :10.1002/14651858.CD006259.pub2. PMC 8763343. PMID 26545176 .
- ^ Majmudar PA, Forstot SL, Dennis RF, Nirankari VS, Damiano RE, Brenart R, Epstein RJ (январь 2000 г.). «Местное применение митомицина-C при субэпителиальном фиброзе после рефракционной хирургии роговицы». Офтальмология . 107 (1): 89– 94. doi :10.1016/s0161-6420(99)00019-6. PMID 10647725.
- ^ Cheng SM, Feng YF, Xu L, Li Y, Huang JH (2013). «Эффективность митомицина C при эндоскопической дакриоцисториностомии: систематический обзор и метаанализ». PLOS ONE . 8 (5): e62737. Bibcode :2013PLoSO...862737C. doi : 10.1371/journal.pone.0062737 . PMC 3652813 . PMID 23675423.