сульфид ртути
_sulfide.jpg/440px-Mercury(II)_sulfide.jpg) | |
| Имена | |
|---|---|
| Название ИЮПАК сульфид ртути | |
| Другие имена | |
| Идентификаторы | |
3D модель ( JSmol ) |
|
| Информационная карта ECHA | 100.014.270 |
| Номер ЕС |
|
CID PubChem |
|
| УНИИ | |
| Номер ООН | 2025 |
Панель инструментов CompTox ( EPA ) |
|
| |
| |
| Характеристики | |
| HgS | |
| Молярная масса | 232,66 г/моль |
| Плотность | 8,10 г/см 3 |
| Температура плавления | 580 °C (1076 °F; 853 K) разлагается |
| нерастворимый | |
| Ширина запрещенной зоны | 2,1 эВ (прямой, α-HgS) [1] |
| −55,4·10 −6 см 3 /моль | |
Показатель преломления ( nD ) | w=2,905, e=3,256, bire=0,3510 (α-HgS) [2] |
| Термохимия | |
Стандартная молярная энтропия ( S ⦵ 298 ) | 78 Дж·моль −1 ·К −1 [3] |
Стандартная энтальпия образования (Δ f H ⦵ 298 ) | −58 кДж·моль −1 [3] |
| Опасности | |
| Маркировка СГС : | |
    | |
| Опасность | |
| Н300 , Н310 , Н317 , Н330 , Н373 , Н410 | |
| P261 , P272 , P280 , P302+P352 , P321 , P333+P313 , P363 , P501 | |
| NFPA 704 (огненный алмаз) | |
| точка возгорания | Негорючий |
| Паспорт безопасности (SDS) | Фишер Сайентифик |
| Родственные соединения | |
Другие анионы | оксид ртути селенид ртути теллурид ртути |
Другие катионы | Сульфид цинка, сульфид кадмия |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |
Сульфид ртути , или сульфид ртути(II) — это химическое соединение, состоящее из химических элементов ртути и серы . Он представлен химической формулой HgS. Он практически нерастворим в воде. [4]
Кристаллическая структура
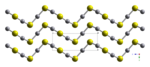

HgS диморфен и имеет две кристаллические формы:
- красная киноварь (α-HgS, тригональная , hP6, P3221) — это форма, в которой ртуть чаще всего встречается в природе. Киноварь имеет ромбоэдрическую кристаллическую систему. Кристаллы красного цвета оптически активны . Это обусловлено спиралями Hg-S в структуре. [5]
- Черная метациннабарит (β-HgS) встречается в природе реже и имеет кристаллическую структуру цинковой обманки ( T 2 d - F 4 3m ).
Подготовка и химия
β-HgS выпадает в осадок в виде черного твердого вещества при обработке солей Hg(II) сероводородом . Реакцию удобно проводить с раствором ацетата ртути(II) в уксусной кислоте . При осторожном нагревании суспензии черный полиморф преобразуется в красную форму. [6] β -HgS не реагирует ни с какими кислотами, кроме концентрированных. [4]
Ртуть получают из киноварной руды путем обжига на воздухе и конденсации паров. [4]
- HgS → Hg + S
Использует

Когда α-HgS используется в качестве красного пигмента, он известен как киноварь . Тенденция киновари к потемнению была приписана преобразованию из красного α-HgS в черный β-HgS. Однако β-HgS не был обнаружен при раскопках в Помпеях, где изначально красные стены потемнели, и был приписан образованию соединений Hg-Cl (например, кордероита , каломели и терлингуаита ) и сульфата кальция , гипса. [7]
Поскольку ртутные элементы, используемые в хлорщелочной промышленности ( процесс Кастнера-Кельнера ), постепенно выводятся из эксплуатации из-за опасений по поводу выбросов ртути, металлическая ртуть из этих установок преобразуется в сульфид ртути для подземного хранения.
При ширине запрещенной зоны 2,1 эВ и ее стабильности возможно использование в качестве фотоэлектрохимической ячейки . [8]
Для очистки разливов ртути предлагалось использовать нейтрализацию серой, однако реакция протекает недостаточно быстро и полно для чрезвычайных ситуаций. [9]
Смотрите также
- отравление ртутью
- Сульфид ртути(I) (сульфид ртути, Hg
2S ), гипотетический
Ссылки
- ^ LI Berger, Полупроводниковые материалы (1997) CRC Press ISBN 0-8493-8912-7
- ^ Веб-минералы
- ^ ab Zumdahl, Steven S. (2009). Химические принципы 6-е изд . Houghton Mifflin Company. стр. A22. ISBN 978-0-618-94690-7.
- ^ abc Гринвуд, Норман Н .; Эрншоу, Алан (1984). Химия элементов. Оксфорд: Pergamon Press . стр. 1406. ISBN 978-0-08-022057-4.
- ^ AM Glazer, K. Stadnicka (1986). «О происхождении оптической активности в кристаллических структурах». J. Appl. Crystallogr . 19 (2): 108– 122. doi :10.1107/S0021889886089823. S2CID 96545158.
- ^ Newell, Lyman C.; Maxson, RN; Filson, MH (1939). "Red Mercuric Sulfide". Неорганические синтезы . Т. 1. С. 19–20 . doi :10.1002/9780470132326.ch7. ISBN 9780470132326.
- ^ Котте, М.; Сузини Дж.; Метрих Н.; Москато А.; Грациу С.; Бертаньини А.; Пагано М. (2006). «Почернение картин на киновари в Помпеях: анализ с помощью рентгеновской микроспектроскопии». Anal. Chem . 78 (21): 7484– 7492. doi :10.1021/ac0612224. PMID 17073416.
- ^ Дэвидсон, RS; Вилшер, CJ (март 1979). «Сульфид ртути(II): фотостабильный полупроводник». Nature . 278 (5701): 238– 239. doi :10.1038/278238a0. ISSN 1476-4687. S2CID 4363745.
- ^ Хегедюс, Кристоф (20 декабря 2014 г.). «Как НЕ следует убирать ртуть...» Фотографии из лаборатории органической химии . Tumblr . Архивировано из оригинала 11 ноября 2020 г. Получено 4 января 2025 г.
{{cite web}}: CS1 maint: несколько имен: список авторов ( ссылка )



