Купферовская клетка
| Купферовская клетка | |
|---|---|
 Конфокальная микроскопия, показывающая устойчивое расположение и взаимодействие между клетками Купфера (красные), звездчатыми клетками печени (зеленые) и синусоидальными эндотелиальными клетками печени (синие). Ядра клеток показаны серым цветом. [1] | |
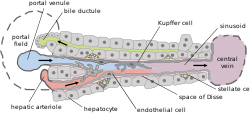 Основная структура печени | |
| Подробности | |
| Расположение | Печень |
| Функция | Макрофаг |
| Идентификаторы | |
| латинский | макрофагоцит звёздчатый |
| МеШ | Д007728 |
| ТН | H3.04.05.0.00016 |
| ФМА | 14656 |
| Анатомические термины микроанатомии [править на Wikidata] | |
Клетки Купфера , также известные как звездчатые макрофаги и клетки Купфера–Бровица , представляют собой специализированные клетки, локализованные в печени в просвете печеночных синусоидов и адгезивные к их эндотелиальным клеткам, которые составляют стенки кровеносных сосудов. Клетки Купфера составляют самую большую популяцию макрофагов , находящихся в тканях организма. Кишечные бактерии, бактериальные эндотоксины и микробный дебрис, транспортируемые в печень из желудочно-кишечного тракта через воротную вену , сначала вступают в контакт с клетками Купфера, первыми иммунными клетками в печени. Именно из-за этого любое изменение функций клеток Купфера может быть связано с различными заболеваниями печени, такими как алкогольная болезнь печени, вирусный гепатит, внутрипеченочный холестаз, стеатогепатит, активация или отторжение печени во время трансплантации печени и фиброз печени. [2] [3] Они являются частью системы мононуклеарных фагоцитов .
Расположение и структура
Клетки Купфера можно обнаружить прикрепленными к синусоидальным эндотелиальным клеткам как в центрилобулярных, так и в перипортальных областях печеночных долек . Функция и структура клеток Купфера специализированы в зависимости от их расположения. Перипортальные клетки Купфера, как правило, крупнее и обладают большей лизосомальной ферментативной и фагоцитарной активностью, тогда как центрилобулярные клетки Купфера создают больше супероксидного радикала.
Клетки Купфера имеют амебоидную природу, с поверхностными особенностями, включая микроворсинки , псевдоподии и ламеллиподии , которые выступают во всех направлениях. Микроворсинки и псевдоподии играют роль в эндоцитозе частиц.
Ядро имеет выемчатую, яйцевидную форму и может быть дольчатым.
Известные цитоплазматические элементы включают рибосомы , комплексы Гольджи , центриоли , микротрубочки и микрофиламенты . Клетки Купфера также содержат шероховатый эндоплазматический ретикулум , ядерную оболочку и кольцевые пластинки , все из которых демонстрируют активность пероксидазы .
Важно отметить, что клетки Купфера экспрессируют рецептор-поглотитель SR-AI/II . Этот рецептор участвует в распознавании и связывании липидного домена А липополисахарида (ЛПС) и липотейхоевой кислоты . (Липополисахарид (ЛПС) — это бактериальный эндотоксин, который обнаруживается в клеточной стенке грамотрицательных бактерий , тогда как липотейхоевая кислота присутствует в грамположительных бактериях .) Благодаря этой системе обнаружения клетки Купфера играют важную роль в инициировании и опосредовании иммунных реакций на бактериальную инфекцию печени. [4]
Разработка
Развитие начальной популяции клеток Купфера начинается в желточном мешке эмбриона , где клетки-предшественники дифференцируются в фетальные макрофаги . Попав в кровоток, они мигрируют в печень плода , где и остаются. Там они завершают свою дифференциацию в клетки Купфера. В нормальных условиях эти популяции клеток Купфера являются долгоживущими и самообновляющимися. [5]
Однако, если популяции резидентных клеток Купфера истощены, моноциты, полученные из гемопоэтических стволовых клеток в костном мозге и транспортируемые через кровообращение в печень, также могут полностью дифференцироваться в истинные клетки Купфера. В отличие от других тканевых макрофагов, которые должны постоянно обновляться циркулирующими моноцитами, эти клетки Купфера, полученные из моноцитов, способны к самообновлению после того, как популяция установлена. [6]
Развитие зрелых клеток Купфера регулируется многочисленными факторами роста, при этом ключевую роль играет макрофагальный колониестимулирующий фактор ( CSF1 ). Цитокины, участвующие в воспалении 2 типа , такие как IL-4 , также могут стимулировать пролиферацию клеток Купфера. В исследованиях на животных было показано, что для полного восстановления популяции клеток Купфера требуется от 14 до 21 дня. Несмотря на высокие темпы притока и созревания моноцитов, популяции печеночных клеток Купфера поддерживаются в тесном контакте. Очевидно, что существует высокая скорость оборота, при этом средняя продолжительность жизни клетки Купфера оценивается в 3,8 дня. Однако окончательная судьба клеток Купфера in vivo еще не полностью изучена. [4] [7] [3]
Функция
Основная функция клеток Купфера заключается в удалении инородных частиц и мусора, поступивших из печеночной портальной системы при прохождении через печень. Клетки Купфера могут захватывать крупные частицы путем фагоцитоза , а более мелкие частицы — путем пиноцитоза . [4] Клетки Купфера являются неотъемлемой частью врожденных реакций иммунной системы. Они важны для защиты хозяина и играют роль в метаболизме многих различных соединений, включая липиды, белковые комплексы и мелкие частицы. Они также полезны для удаления апоптотических клеток из кровообращения. [2] [3]
Количество клеток Купфера в печени поддерживается постоянным. Клетки Купфера обладают пролиферативной способностью, что позволяет клеточным популяциям пополняться: это полная противоположность макрофагам, полученным из моноцитов, которые не имеют пролиферативного потенциала. Старые или дефектные клетки удаляются посредством апоптоза, а также путем фагоцитирования соседними клетками Купфера.
Клетки Купфера неоднородны по своей функции, в зависимости от их расположения в дольках печени . Клетки в перипортальной зоне напрямую подвергаются воздействию кровотока и проявляют большую лизосомальную активность для более эффективной обработки поступающих чужеродных веществ. Напротив, клетки в центрилобулярной зоне испытывают меньшую перфузию и оснащены большими запасами супероксида для борьбы с глубоко проникающими травмами и инфекциями.
В ответ на инфекцию или раздражение клетки Купфера могут вырабатывать воспалительные цитокины , ФНО-альфа , кислородные радикалы и протеазы . Избыточное производство этих медиаторов связано с развитием поражения печени. [4]
Помимо очистки от бактерий, клетки Купфера также отвечают за переработку гемоглобина , разрушая стареющие эритроциты посредством фагоцитарного действия. Цепи глобина используются повторно, в то время как часть, содержащая железо, гем , далее расщепляется на железо, которое используется повторно, и билирубин , который конъюгируется с глюкуроновой кислотой в гепатоцитах и секретируется в желчь .
Helmy et al. идентифицировали рецептор, присутствующий в клетках Купфера, комплементарный рецептор семейства иммуноглобулинов (CRIg). Мыши без CRIg не могли очищать систему комплемента от патогенов, покрытых оболочкой. CRIg сохраняется у мышей и людей и является критическим компонентом врожденной иммунной системы. [8]
Клиническое значение
Клетки Купфера — невероятно пластичные клетки, которые обладают способностью поляризовать определенные состояния активации и могут выполнять различные функции в различных микросредах. M1 (классическая активация) и M2 (альтернативная активация) обозначают две крайности поляризации макрофагов . Клетки Купфера, поляризованные M1, вырабатывают большое количество провоспалительных цитокинов, таких как TNF-альфа. С другой стороны, клетки Купфера, поляризованные M2, вырабатывают большое количество противовоспалительных медиаторов, например, IL-10. [9] [4]
Клетки Купфера играют роль в патогенезе повреждения печени в ответ на сепсис. Макрофаги в печени активируют и высвобождают как ИЛ-1, так и ФНО-альфа. В свою очередь, это активирует лейкоциты и синусоидальные эндотелиальные клетки для экспрессии ICAM-1 . Это приводит к повреждению тканей эндотелия из-за протеаз, кислородных радикалов, простаноидов и других веществ из лейкоцитов.
Активация клеток Купфера способствует патогенезу как хронической, так и острой алкогольной болезни печени в ответ на вызванное этанолом поражение печени, распространенное у хронических алкоголиков. Хронический алкоголизм и поражение печени имеют дело с системой двойного удара. В то время как первый удар является прямым, опосредованным прямой токсичностью этанола и его метаболических побочных продуктов, второй удар является косвенным, опосредованным повышенным поглощением липополисахарида ( эндотоксина) из кишечника.
Этанол увеличивает проницаемость кишечного эпителия, в результате чего эндотоксин, вырабатываемый кишечной флорой, просачивается из просвета кишечника в печень через воротную вену . Присутствие эндотоксина вызывает сильную поляризацию M1 клеток Купфера. Большое количество активных форм кислорода, провоспалительных цитокинов и хемокинов вырабатывается активированными клетками Купфера, что приводит к повреждению печени.
Каскад начинается с опосредованной эндотоксином активации Toll-подобного рецептора 4 ( TLR4 ) и CD14 , рецепторов на клетках Купфера, которые интернализуют эндотоксин. Это, в свою очередь, активирует транскрипцию провоспалительных цитокинов и фактора некроза опухоли-альфа (TNFα) с сопутствующей продукцией супероксидов .
Цитокины и супероксиды продолжают вызывать воспаление и окислительное повреждение соответственно, в то время как TNFα запускает звездчатые клетки в печени, чтобы инициировать синтез коллагена . Эти процессы приводят к фиброзу или рубцеванию печени. Фиброз в конечном итоге вызывает цирроз , потерю функции печени из-за обширного рубцевания. [10]
История
Клетки были впервые обнаружены Карлом Вильгельмом фон Купфером в 1876 году. [11] Ученый назвал их «Sternzellen» (звездчатые клетки или печеночные звездчатые клетки ), но ошибочно считал, что они являются неотъемлемой частью эндотелия кровеносных сосудов печени и что они произошли от него. В 1898 году, после нескольких лет исследований, Тадеуш Брович правильно определил их как макрофаги . [12] [13] [14] [15]
Ссылки
- ^ Bonnardel J, T'Jonck W, Gaublomme D, Browaeys R, Scott CL, Martens L и др. (октябрь 2019 г.). «Звездчатые клетки, гепатоциты и эндотелиальные клетки отпечатывают идентичность клеток Купфера на моноцитах, колонизирующих нишу макрофагов печени». Immunity . 51 (4): 638–654.e9. doi :10.1016/j.immuni.2019.08.017. PMC 6876284 . PMID 31561945.
- ^ ab Нгуен-Лефевр, Ань Ту; Хорузско, Анатолий (2015). «Метаболизм и функция клеток Купфера». Журнал энзимологии и метаболизма . 1 (1). PMC 4771376. PMID 26937490 .
- ^ abc Dixon, Laura J.; Barnes, Mark; Tang, Hui; Pritchard, Michele T.; Nagy, Laura E. (апрель 2013 г.). «Клетки Купфера в печени». Comprehensive Physiology . 3 (2): 785–797. doi :10.1002/cphy.c120026. ISSN 2040-4603. PMC 4748178. PMID 23720329 .
- ^ abcde Basit, Hajira; Tan, Michael L.; Webster, Daniel R. (2020), "Гистология, Купферовская клетка", StatPearls , Treasure Island (FL): StatPearls Publishing, PMID 29630278 , получено 25.08.2020
- ^ Naito M, Hasegawa G, Takahashi K (ноябрь 1997 г.). «Развитие, дифференциация и созревание клеток Купфера». Microscopy Research and Technique . 39 (4): 350–64. doi :10.1002/(SICI)1097-0029(19971115)39:4<350::AID-JEMT5>3.0.CO;2-L. PMID 9407545. S2CID 21193303.
- ^ Скотт С., Чжэн Ф., Де Бэтселиер П. и др. (27 января 2016 г.). «Моноциты, полученные из костного мозга, приводят к самообновлению и полной дифференциации клеток Купфера». Nature Communications . 7, 10321 (2016): 10321. Bibcode :2016NatCo...710321S. doi : 10.1038/ncomms10321 . PMC 4737801 . PMID 26813785.
- ^ Чен, Цзяцзя; Дэн, Сяои; Лю, Юнцзянь; Тан, Цюхуа; Хуан, Гуйдун; Че, Циши; Го, Цзяо; Су, Чжэнцюань (2020). «Купферовские клетки при неалкогольной жировой болезни печени: друг или враг?». Международный журнал биологических наук . 16 (13): 2367–2378. дои : 10.7150/ijbs.47143. ПМЦ 7378652 . ПМИД 32760204 . Проверено 31 августа 2020 г.
- ^ Helmy KY, Katschke KJ, Gorgani NN, Kljavin NM, Elliott JM, Diehl L, et al. (март 2006 г.). "CRIg: рецептор комплемента макрофагов, необходимый для фагоцитоза циркулирующих патогенов". Cell . 124 (5): 915–27. doi : 10.1016/j.cell.2005.12.039 . PMID 16530040. S2CID 15525209.
- ^ Цзэн, Тао; Чжан, Цуй-Ли; Сяо, Мо; Ян, Руй; Се, Кэ-Цинь (2016). «Критическая роль клеток Купфера в патогенезе алкогольной болезни печени: от фундаментальной науки до клинических испытаний». Frontiers in Immunology . 7 : 538. doi : 10.3389/fimmu.2016.00538 . ISSN 1664-3224. PMC 5126119. PMID 27965666 .
- ^ Уилер МД (2003). «Эндотоксин и активация клеток Купфера при алкогольной болезни печени». Alcohol Research & Health . 27 (4): 300–6. PMC 6668869. PMID 15540801 .
- ^ Haubrich WS (июль 2004 г.). «Купфер из клеток Купфера». Гастроэнтерология . 127 (1): 16. doi :10.1053/j.gastro.2004.05.041. PMID 15236167.
- ^ Шиманская Р., Шмидт-Поспула М. (1979). «[Исследования ретикулоэндотелиальных клеток печени Тадеуша Бровица и Карла Купфера. Исторический очерк]». Архив истории медицины . 42 (3): 331–6. ПМИД 386989.
- ^ Stachura J, Gałązka K (декабрь 2003 г.). «История и современное состояние польской гастроэнтерологической патологии». Журнал физиологии и фармакологии . 54 Suppl 3: 183–92. PMID 15075472.
- ^ Срудка А, Грыглевский Р.В., Щепаньский В. (2006). «Клетки Бровича или Купфера?». Польский журнал патологии . 57 (4): 183–5. ПМИД 17285760.
- ^ Wake K (2009). «[Фагоцитарные клетки Бровича и так называемые звездчатые клетки Купфера]». Kaibogaku Zasshi . 84 (1): 17–21. PMID 19413196.
Внешние ссылки
- Анатомическое фото: пищеварительный тракт/млекопитающее/печень5/печень4 - Сравнительная органология Калифорнийского университета в Дэвисе - "Млекопитающее, печень (ЭМ, низкое)"
- Гистологическое изображение: 15508loa – Система обучения гистологии в Бостонском университете