Митохондриальный противовирусный сигнальный белок
| МАВС | |||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Идентификаторы | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Псевдонимы | MAVS , CARDIF, IPS-1, IPS1, VISA, митохондриальный противовирусный сигнальный белок | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Внешние идентификаторы | ОМИМ : 609676; МГИ : 2444773; Гомологен : 17004; Генные карты : МАВС; ОМА :МАВС - ортологи | ||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Викиданные | |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
Митохондриальный противовирусный сигнальный белок ( MAVS ) — это белок , необходимый для противовирусного врожденного иммунитета . MAVS находится во внешней мембране митохондрий, пероксисом и митохондриально-ассоциированной эндоплазматической ретикулумной мембране (MAM). [5] [6] При вирусной инфекции группа цитозольных белков обнаруживает присутствие вируса и связывается с MAVS, тем самым активируя MAVS. Активация MAVS приводит к тому, что инфицированная вирусом клетка секретирует цитокины . Это вызывает иммунный ответ , который убивает инфицированные вирусом клетки хозяина, что приводит к элиминации вируса.
Структура
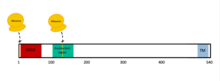
MAVS также известен как стимулятор промотора IFN-β I (IPS-1), адаптер домена набора активации каспазы, индуцирующий IFN-β (CARDIF), или адаптер сигнализации, индуцированной вирусом (VISA). [7] MAVS кодируется геном MAVS . [7] [8] MAVS представляет собой белок из 540 аминокислот, который состоит из трех компонентов: N-концевого домена набора активации каспазы (CARD), богатого пролином домена и трансмембранного C-концевого домена (TM). [7]
После того, как ген MAVS был транскрибирован в РНК, рибосомы могут транслировать белок MAVS из двух разных сайтов. [7] Первоначальный сайт трансляции генерирует полноразмерный белок MAVS. Альтернативный сайт трансляции генерирует более короткий белок, называемый «miniMAVS» или короткий MAVS (sMAVS). [7] sMAVS — это белок MAVS из 398 аминокислот, в котором отсутствует домен CARD. Это важно, поскольку домен CARD — это место, где связываются два цитозольных белка для активации MAVS, сигнализируя о наличии вируса в клетке. [7]
Функция
Вирусы с двухцепочечной РНК распознаются либо трансмембранным толл-подобным рецептором 3 ( TLR3 ), либо одним из двух цитозольных белков, рецепторами, подобными гену I, индуцируемому ретиноевой кислотой ( RIG-I ), и геном 5, ассоциированным с дифференцировкой меланомы ( MDA5 ). [7] [8] [9] [10] RIG-I и MDA5 различаются по вирусной РНК, которую они распознают, но у них есть много общих структурных особенностей, включая N-концевой CARD, который позволяет им связываться с MAVS. [7] Активация MAVS приводит к повышению уровня провоспалительных цитокинов посредством активации факторов транскрипции, ядерного фактора kB ( NF-κB ), регуляторного фактора интерферона 1 ( IRF1 ) и регуляторного фактора интерферона 3 ( IRF3 ). [7] [8] [9] NF-κB, IRF1 и IRF3 являются факторами транскрипции и играют важную роль в выработке цитокинов.

Известно , что в состоянии покоя клетки белок, называемый митофузином 2 (MFN2), взаимодействует с MAVS, предотвращая связывание MAVS с цитозольными белками, такими как RIG-I и MDA5. [7] [8] После распознавания вируса в цитозоле митохондриально-ассоциированные мембраны ЭР (MAM) и митохондрии физически связываются MFN2, а RIG-I связывается со вторым белком RIG-I, образуя белковый комплекс. [7] [8] [9] Этот комплекс связывается с TRIM25 и молекулярным шапероном 14-3-3e, образуя комплекс, называемый «транслокон». [7] [8] [9] [10] Транслокон перемещается в митохондрии, где связывается с областью CARD на MAVS, что приводит к активации MAVS. [7] [8] [9] [10] Затем белки MAVS связываются друг с другом через домены CARD и TM, чтобы привлечь несколько нижестоящих сигнальных факторов для формирования сигнального комплекса MAVS. [7] [8] Формированию этого сигнального комплекса MAVS способствуют повышенные уровни митохондриальных активных форм кислорода (mROS) , независимо от РНК-сенсорики. [8] [9] Сигнальный комплекс MAVS взаимодействует с TANK-связывающей киназой 1 и/или протеинкиназами IKKA (CHUK) и IKKB (IKBKB), что приводит к фосфорилированию и ядерной транслокации IRF3. [7] Хотя передача и регуляция сигнала MAVS не полностью изучены, активированные белки MAVS в митохондриях, ЭР и пероксисоме необходимы для максимизации противовирусного врожденного иммунного ответа.
Белок MAVS индуцирует апоптоз в инфицированных вирусом клетках хозяина, взаимодействуя с протеазой, называемой каспазой 8. [ 7] Активация апоптоза каспазой 8 не зависит от апоптотического пути Bax/Bak, основного пути апоптоза в клетках. [7]
Вирусное уклонение
Некоторые вирусы, такие как человеческий цитомегаловирус (HCMV) и вирус гепатита C (HCV), адаптировались для подавления функции MAVS в противовирусном врожденном иммунном ответе, способствуя репликации вируса. [7] [11] HCMV ослабляет MAVS через вирусный ингибитор белка апоптоза, локализованный в митохондриях (vMIA), тем самым снижая провоспалительный цитокиновый ответ. [11] vMIA также локализуется в пероксисоме, где он взаимодействует с цитоплазматическим шаперонным белком Pex19, отключая транспортный аппарат пероксисомальных мембранных белков. [11] Штамм NS3-NS4A вируса гепатита C инактивирует сигнализацию MAVS, расщепляя белок MAVS непосредственно выше домена, нацеленного на мембрану MAVS, в MAM и пероксисоме, предотвращая нисходящую сигнализацию MAVS. [7]
Регулирование
Экспрессия и функция MAVS регулируются на транскрипционном, посттранскрипционном и посттрансляционном уровнях. На транскрипционном уровне активные формы кислорода (ROS), образующиеся во время противовирусного ответа, действуют как отрицательный регулятор . [7] [8] [9] MAVS, кроме того, кодирует ряд вариантов сплайсинга, которые, как было предложено, регулируют MAVS. На посттранскрипционном уровне на MAVS присутствуют два трансляционных сайта, которые могут генерировать два белка MAVS. Альтернативный сайт трансляции находится выше по течению, что приводит к экспрессии sMAVS. [7] [8] [9] На трансляционном уровне такие белки, как семейство убиквитин E3-лигаз, регулируют активность MAVS. [7] [8] [9]
Ссылки
- ^ abc GRCh38: Ensembl выпуск 89: ENSG00000088888 – Ensembl , май 2017 г.
- ^ abc GRCm38: Ensembl выпуск 89: ENSMUSG00000037523 – Ensembl , май 2017 г.
- ^ "Human PubMed Reference:". Национальный центр биотехнологической информации, Национальная медицинская библиотека США .
- ^ "Mouse PubMed Reference:". Национальный центр биотехнологической информации, Национальная медицинская библиотека США .
- ^ Vazquez C, Beachboard DC, Horner SM (2017). «Методы визуализации субклеточной локализации MAVS». Врожденный противовирусный иммунитет . Методы в молекулярной биологии. Том 1656. С. 131– 142. doi :10.1007/978-1-4939-7237-1_7. ISBN 978-1-4939-7236-4. PMC 6103534 . PMID 28808966.
- ^ Seth RB, Sun L, Ea CK, Chen ZJ (сентябрь 2005 г.). «Идентификация и характеристика MAVS, митохондриального противовирусного сигнального белка, который активирует NF-kappaB и IRF 3». Cell . 122 (5): 669– 682. doi : 10.1016/j.cell.2005.08.012 . PMID 16125763. S2CID 11104354.
- ^ abcdefghijklmnopqrstu v Vazquez C, Horner SM (июль 2015 г.). "MAVS Coordination of Antiviral Innate Immunity". Journal of Virology . 89 (14): 6974– 6977. doi :10.1128/JVI.01918-14. PMC 4473567. PMID 25948741 .
- ^ abcdefghijkl Mohanty A, Tiwari-Pandey R, Pandey NR (сентябрь 2019 г.). «Митохондрии: незаменимые участники врожденного иммунитета и хранители воспалительного ответа». Журнал клеточной коммуникации и сигнализации . 13 (3): 303– 318. doi :10.1007/s12079-019-00507-9. PMC 6732146. PMID 30719617 .
- ^ abcdefghi Jacobs JL, Coyne CB (декабрь 2013 г.). «Механизмы регуляции MAVS на митохондриальной мембране». Журнал молекулярной биологии . 425 (24): 5009– 5019. doi :10.1016/j.jmb.2013.10.007. PMC 4562275. PMID 24120683 .
- ^ abc Jiang QX (2019). «Структурная изменчивость пути RLR-MAVS и чувствительное обнаружение вирусных РНК». Медицинская химия . 15 (5): 443– 458. doi :10.2174/1573406415666181219101613. PMC 6858087. PMID 30569868 .
- ^ abc Ashley CL, Abendroth A, McSharry BP, Slobedman B (2019). «Интерферон-независимые врожденные ответы на цитомегаловирус». Frontiers in Immunology . 10 : 2751. doi : 10.3389/fimmu.2019.02751 . PMC 6917592. PMID 31921100 .
Дальнейшее чтение
- Nagase T, Ishikawa K, Kikuno R, Hirosawa M, Nomura N, Ohara O (октябрь 1999 г.). «Предсказание кодирующих последовательностей неидентифицированных генов человека. XV. Полные последовательности 100 новых клонов кДНК из мозга, которые кодируют большие белки in vitro». DNA Research . 6 (5): 337– 345. doi : 10.1093/dnares/6.5.337 . PMID 10574462.
- Мацуда А., Сузуки И., Хонда Г., Мурамацу С., Мацузаки О., Нагано И. и др. (май 2003 г.). «Крупномасштабная идентификация и характеристика человеческих генов, активирующих сигнальные пути NF-kappaB и MAPK». Онкоген . 22 (21): 3307– 3318. doi :10.1038/sj.onc.1206406. PMID 12761501. S2CID 38880905.
- Kawai T, Takahashi K, Sato S, Coban C, Kumar H, Kato H и др. (октябрь 2005 г.). «IPS-1, адаптер, запускающий индукцию интерферона I типа, опосредованную RIG-I и Mda5». Nature Immunology . 6 (10): 981– 988. doi :10.1038/ni1243. PMID 16127453. S2CID 31479259.
- Meylan E, Curran J, Hofmann K, Moradpour D, Binder M, Bartenschlager R, Tschopp J (октябрь 2005 г.). «Cardif — это адаптерный белок в противовирусном пути RIG-I, на который нацелен вирус гепатита C» (PDF) . Nature . 437 (7062): 1167– 1172. Bibcode : 2005Natur.437.1167M. doi : 10.1038/nature04193. PMID 16177806. S2CID 4391603.
- Li XD, Sun L, Seth RB, Pineda G, Chen ZJ (декабрь 2005 г.). «Протеаза вируса гепатита С NS3/4A отщепляет митохондриальный противовирусный сигнальный белок от митохондрий, чтобы обойти врожденный иммунитет». Труды Национальной академии наук Соединенных Штатов Америки . 102 (49): 17717– 17722. doi : 10.1073/pnas.0508531102 . PMC 1308909. PMID 16301520 .
- Oh JH, Yang JO, Hahn Y, Kim MR, Byun SS, Jeon YJ и др. (декабрь 2005 г.). «Транскриптомный анализ рака желудка у человека». Mammalian Genome . 16 (12): 942– 954. doi :10.1007/s00335-005-0075-2. PMID 16341674. S2CID 69278.
- Loo YM, Owen DM, Li K, Erickson AK, Johnson CL, Fish PM и др. (апрель 2006 г.). «Вирусный и терапевтический контроль стимулятора IFN-beta-промотора 1 во время инфекции вируса гепатита C». Труды Национальной академии наук Соединенных Штатов Америки . 103 (15): 6001– 6006. Bibcode : 2006PNAS..103.6001L. doi : 10.1073/pnas.0601523103 . PMC 1458687. PMID 16585524 .
- Cheng G, Zhong J, Chisari FV (май 2006 г.). «Ингибирование сигнализации, индуцированной dsRNA, в клетках, инфицированных вирусом гепатита C, с помощью механизмов, зависимых и независимых от протеазы NS3». Труды Национальной академии наук Соединенных Штатов Америки . 103 (22): 8499– 8504. Bibcode : 2006PNAS..103.8499C. doi : 10.1073/pnas.0602957103 . PMC 1482521. PMID 16707574 .
- Лин Р., Лакост Дж., Нахаи П., Сунь Кью, Ян Л., Паз С. и др. (июнь 2006 г.). «Диссоциация молекулярного комплекса MAVS/IPS-1/VISA/Cardif-IKKepsilon от внешней мембраны митохондрий путем протеолитического расщепления NS3-4A вируса гепатита С». Журнал вирусологии . 80 (12): 6072–6083 . doi :10.1128/JVI.02495-05. ПМЦ 1472616 . ПМИД 16731946.
- Saha SK, Pietras EM, He JQ, Kang JR, Liu SY, Oganesyan G, et al. (Июль 2006 г.). «Регулирование противовирусных ответов путем прямого и специфического взаимодействия между TRAF3 и Cardif». The EMBO Journal . 25 (14): 3257– 3263. doi :10.1038/sj.emboj.7601220. PMC 1523175. PMID 16858409 .
- Beausoleil SA, Villén J, Gerber SA, Rush J, Gygi SP (октябрь 2006 г.). «Подход на основе вероятности для высокопроизводительного анализа фосфорилирования белков и локализации участков». Nature Biotechnology . 24 (10): 1285– 1292. doi :10.1038/nbt1240. PMID 16964243. S2CID 14294292.
- Opitz B, Vinzing M, van Laak V, Schmeck B, Heine G, Günther S и др. (ноябрь 2006 г.). «Legionella pneumophila индуцирует IFNbeta в эпителиальных клетках легких через IPS-1 и IRF3, которые также контролируют репликацию бактерий». Журнал биологической химии . 281 (47): 36173– 36179. doi : 10.1074/jbc.M604638200 . PMID 16984921.
- Чен З., Бенюро И., Рейнбранд Р., Йи Дж., Ван Т., Вартер Л. и др. (январь 2007 г.). «Вирус GB B нарушает передачу сигналов RIG-I путем NS3/4A-опосредованного расщепления адаптерного белка MAVS». Журнал вирусологии . 81 (2): 964–976 . doi :10.1128/JVI.02076-06. ПМК 1797450 . ПМИД 17093192.
- Hirata Y, Broquet AH, Menchén L, Kagnoff MF (октябрь 2007 г.). «Активация врожденных иммунных защитных механизмов путем передачи сигналов через RIG-I/IPS-1 в эпителиальных клетках кишечника». Журнал иммунологии . 179 (8): 5425– 5432. doi : 10.4049/jimmunol.179.8.5425 . PMID 17911629.
- Zeng W, Xu M, Liu S, Sun L, Chen ZJ (октябрь 2009 г.). «Ключевая роль полиубиквитинирования Ubc5 и лизина-63 в вирусной активации IRF3». Molecular Cell . 36 (2): 315– 325. doi :10.1016/j.molcel.2009.09.037. PMC 2779157 . PMID 19854139.
- Liu S, Chen J, Cai X, Wu J, Chen X, Wu YT и др. (август 2013 г.). "MAVS привлекает несколько лигаз убиквитина E3 для активации каскадов противовирусной сигнализации". eLife . 2 (e00785): e00785. doi : 10.7554/eLife.00785 . PMC 3743401 . PMID 23951545.
- Liu S, Cai X, Wu J, Cong Q, Chen X, Li T и др. (март 2015 г.). «Фосфорилирование врожденных иммунных адаптерных белков MAVS, STING и TRIF вызывает активацию IRF3». Science . 347 (6227): aaa2630. doi : 10.1126/science.aaa2630 . PMID 25636800.
В данной статье использован текст из Национальной медицинской библиотеки США , являющийся общественным достоянием .