X-инактивация

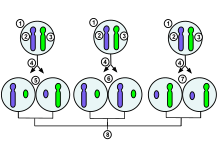
1. Ранняя стадия эмбриональной клетки женского пола
2. Материнская Х-хромосома
3. Отцовская Х-хромосома
4. Митоз и случайная инактивация Х-хромосомы
5. Отцовская хромосома случайным образом инактивируется в одной дочерней клетке, материнская хромосома инактивируется в другой
6. Отцовская хромосома случайным образом инактивируется в обеих дочерних клетках
7. Материнская хромосома случайным образом инактивируется в обеих дочерних клетках
8. Три возможных результата случайной комбинации


Слева: ДНК (DAPI)-окрашенное ядро. Стрелка указывает на местоположение тельца Барра (Xi). Справа: обнаружен связанный с ДНК белок гистонов

X-инактивация (также называемая лионизацией , в честь английского генетика Мэри Лион ) — это процесс, при котором одна из копий X-хромосомы инактивируется у самок млекопитающих териев . Неактивная X-хромосома заглушается, будучи упакованной в транскрипционно неактивную структуру, называемую гетерохроматином . Поскольку почти все самки млекопитающих имеют две X-хромосомы, X-инактивация не позволяет им иметь в два раза больше генных продуктов X-хромосомы , чем самцы, которые обладают только одной копией X-хромосомы (см. компенсацию дозировки ).
Выбор того, какая X-хромосома будет инактивирована в конкретной эмбриональной клетке, случаен у плацентарных млекопитающих, таких как люди, но как только X-хромосома инактивируется, она останется неактивной на протяжении всей жизни клетки и ее потомков в организме (ее клеточной линии). В результате выбор инактивированной X-хромосомы во всех клетках организма представляет собой случайное распределение, часто примерно у половины клеток инактивирована отцовская X-хромосома, а у половины — инактивированная материнская X-хромосома; но обычно X-инактивация неравномерно распределена по клеточным линиям в пределах одного организма ( перекошенная X-инактивация ).
В отличие от случайной инактивации Х-хромосомы у плацентарных млекопитающих, инактивация у сумчатых касается исключительно отцовской Х-хромосомы.
Механизм
Цикл активации Х-хромосомы у грызунов
Приведенные ниже параграфы касаются только грызунов и не отражают XI у большинства млекопитающих. Инактивация X является частью цикла активации X-хромосомы на протяжении всей жизни самки. Яйцеклетка и оплодотворенная зигота изначально используют материнские транскрипты, и весь эмбриональный геном замолкает до активации зиготического генома . После этого все мышиные клетки подвергаются ранней импринтированной инактивации отцовской X-хромосомы в эмбрионах на стадии 4–8 клеток . [3] [4] [5] [6] Внезародышевые ткани (которые дают начало плаценте и другим тканям, поддерживающим эмбрион) сохраняют эту раннюю импринтированную инактивацию, и, таким образом, в этих тканях активна только материнская X-хромосома.
В ранней бластоцисте эта начальная, импринтированная X-инактивация отменяется в клетках внутренней клеточной массы (которые дают начало эмбриону), и в этих клетках обе X-хромосомы снова становятся активными. Затем каждая из этих клеток независимо и случайным образом инактивирует одну копию X-хромосомы. [5] Это событие инактивации необратимо в течение жизни особи, за исключением зародышевой линии. В женской зародышевой линии перед мейотическим входом X-инактивация отменяется, так что после мейоза все гаплоидные ооциты содержат одну активную X-хромосому.
Обзор
Xi обозначает неактивную, Xa — активную X-хромосому. X P обозначает отцовскую, а X M to обозначает материнскую X-хромосому. Когда яйцеклетка (несущая X M ) оплодотворяется сперматозоидом (несущим Y или X P ), образуется диплоидная зигота. От зиготы, через взрослую стадию, до следующего поколения яйцеклеток, X-хромосома претерпевает следующие изменения:
- Зигота Xi P Xi M → подвергается активации зиготического генома , что приводит к:
- Xa P Xa M → подвергается импринтированной (отцовской) X-инактивации , что приводит к:
- Xi P Xa M → подвергается X-активации на ранней стадии бластоцисты , что приводит к:
- Xa P Xa M → подвергается случайной X-инактивации в эмбриональной линии (внутренней клеточной массе) на стадии бластоцисты, что приводит к:
- Xi P Xa M OR Xa P Xi M → подвергается X-реактивации в первичных половых клетках перед мейозом , что приводит к:
- Xa M Xa P диплоидные половые клетки в мейотической остановке. Поскольку мейоз I завершается только овуляцией , половые клетки человека существуют на этой стадии с первых недель развития до полового созревания. Завершение мейоза приводит к:
- Гаплоидные половые клетки (яйцеклетки) Xa M и Xa P.
Цикл активации X лучше всего изучен на мышах, но есть и многочисленные исследования на людях. Поскольку большинство доказательств получено на мышах, приведенная выше схема представляет события у мышей. Завершение мейоза здесь упрощено для ясности. Шаги 1–4 можно изучать на эмбрионах, оплодотворенных in vitro, и на дифференцирующихся стволовых клетках; реактивация X происходит в развивающемся эмбрионе, а последующие (6–7) шаги — внутри женского организма, поэтому изучать их гораздо сложнее.
Сроки
Время каждого процесса зависит от вида, и во многих случаях точное время активно обсуждается. [Вся часть времени инактивации Х-хромосомы у человека в этой таблице весьма сомнительна и должна быть удалена до тех пор, пока не будет надлежащим образом подтверждена эмпирическими данными]
| Процесс | Мышь | Человек | |
| 1 | Активация зиготического генома | Стадия 2–4 клеток [7] | Стадия 2–8 клеток [7] |
| 2 | Импринтированная (отцовская) инактивация Х-хромосомы | Стадия 4–8 клеток [6] [8] | Неясно, происходит ли это у людей [9] |
| 3 | X-активация | Ранняя стадия бластоцисты | Ранняя стадия бластоцисты |
| 4 | Случайная инактивация Х-хромосомы в эмбриональной линии (внутренняя клеточная масса) | Поздняя стадия бластоцисты | Поздняя стадия бластоцисты, после имплантации [9] |
| 5 | X-реактивация в первичных половых клетках перед мейозом | От 4-й недели развития до 14-й недели [10] [11] |
Наследование статуса инактивации в разных поколениях клеток
Потомки каждой клетки, которая инактивировала определенную Х-хромосому, также инактивируют эту же хромосому. Это явление, которое можно наблюдать в окраске черепаховых кошек , когда самки гетерозиготны по гену пигмента, сцепленному с Х-хромосомой , не следует путать с мозаицизмом , который является термином, который конкретно относится к различиям в генотипе различных популяций клеток у одной и той же особи; Х-инактивация, которая является эпигенетическим изменением, приводящим к другому фенотипу, не является изменением на генотипическом уровне. Для отдельной клетки или линии инактивация, таким образом, является перекошенной или « неслучайной », и это может привести к появлению легких симптомов у самок-«носителей» генетических нарушений, сцепленных с Х-хромосомой . [12]
Выбор одной активной Х-хромосомы
Типичные самки обладают двумя X-хромосомами, и в любой данной клетке одна хромосома будет активной (обозначается как Xa), а другая будет неактивной (Xi). Однако исследования людей с дополнительными копиями X-хромосомы показывают, что в клетках с более чем двумя X-хромосомами все еще есть только одна Xa, а все остальные X-хромосомы инактивированы. Это указывает на то, что состояние X-хромосомы по умолчанию у самок — инактивация, но одна X-хромосома всегда выбирается, чтобы оставаться активной.
Понятно, что инактивация Х-хромосомы — это случайный процесс, происходящий примерно во время гаструляции в эпибласте (клетках, которые дадут начало эмбриону). Материнская и отцовская Х-хромосомы имеют одинаковую вероятность инактивации. Это предполагает, что женщины, как ожидается, будут страдать от Х-сцепленных расстройств примерно на 50% чаще, чем мужчины (потому что у женщин две Х-хромосомы, а у мужчин только одна); однако, на самом деле, возникновение этих расстройств у женщин намного ниже. Одним из объяснений этого несоответствия является то, что 12–20% [13] генов на инактивированной Х-хромосоме остаются экспрессированными, тем самым обеспечивая женщинам дополнительную защиту от дефектных генов, кодируемых Х-хромосомой. Некоторые [ кто? ] предполагают, что это несоответствие должно быть свидетельством предпочтительной (неслучайной) инактивации. Преимущественная инактивация отцовской Х-хромосомы происходит как у сумчатых, так и в клеточных линиях, которые формируют мембраны, окружающие эмбрион, [14] тогда как у плацентарных млекопитающих как материнская, так и отцовская Х-хромосома может быть инактивирована в различных клеточных линиях. [15]
Период времени для инактивации Х-хромосомы объясняет это несоответствие. Инактивация происходит в эпибласте во время гаструляции, что дает начало эмбриону. [16] Инактивация происходит на клеточном уровне, что приводит к мозаичной экспрессии, при которой участки клеток имеют неактивную материнскую Х-хромосому, в то время как другие участки имеют неактивную отцовскую Х-хромосому. Например, у женщины, гетерозиготной по гемофилии (заболевание, сцепленное с Х-хромосомой), около половины ее клеток печени будут функционировать нормально, что обычно достаточно для обеспечения нормального свертывания крови. [17] [18] Случайность может привести к значительно большему количеству нефункциональных клеток; однако такие статистические крайности маловероятны. Генетические различия на хромосоме также могут привести к тому, что одна Х-хромосома с большей вероятностью подвергнется инактивации. Кроме того, если одна Х-хромосома имеет мутацию, препятствующую ее росту или делающую ее нежизнеспособной, клетки, которые случайным образом инактивировали эту Х-хромосому, будут иметь селективное преимущество перед клетками, которые случайным образом инактивировали нормальный аллель. Таким образом, хотя инактивация изначально является случайной, клетки, которые инактивируют нормальный аллель (оставляя мутировавший аллель активным), в конечном итоге будут перерастать и заменяться функционально нормальными клетками, в которых почти все имеют одну и ту же активированную X-хромосому. [17]
Предполагается, что существует аутосомно-кодируемый «блокирующий фактор», который связывается с Х-хромосомой и предотвращает ее инактивацию. [19] Модель постулирует, что существует ограничивающий блокирующий фактор, поэтому, как только доступная молекула блокирующего фактора связывается с одной Х-хромосомой, оставшаяся Х-хромосома(ы) не защищена от инактивации. Эта модель подтверждается существованием одной Xa в клетках со многими Х-хромосомами и существованием двух активных Х-хромосом в клеточных линиях с вдвое большим количеством аутосом. [20]
Последовательности в центре инактивации X ( XIC ), присутствующие на X-хромосоме, контролируют подавление X-хромосомы. Предполагается, что гипотетический блокирующий фактор связывается с последовательностями в XIC.
Проявление Х-сцепленных нарушений у гетерозиготных женщин
Эффект гетерозиготности самок X проявляется в некоторых локализованных признаках, таких как уникальный рисунок шерсти трехцветной кошки . Однако может быть сложнее полностью понять выражение нелокализованных признаков у этих самок, таких как проявление болезни.
Поскольку у самцов есть только одна копия Х-хромосомы, все экспрессируемые гены Х-хромосомы (или аллели , в случае множественных вариантных форм для данного гена в популяции) расположены на этой копии хромосомы. Самки, однако, будут в первую очередь экспрессировать гены или аллели, расположенные на той копии Х-хромосомы, которая остается активной. Рассматривая ситуацию для одного гена или нескольких генов, вызывающих индивидуальные различия в определенном фенотипе (т. е. вызывающих вариацию, наблюдаемую в популяции для этого фенотипа), у гомозиготных самок не имеет особого значения, какая копия хромосомы инактивирована, поскольку аллели в обеих копиях одинаковы. Однако у самок, гетерозиготных по каузальным генам, инактивация одной копии хромосомы по сравнению с другой может иметь прямое влияние на их фенотипическую ценность. Из-за этого явления наблюдается увеличение фенотипической изменчивости у самок, гетерозиготных по вовлеченному гену или генам, чем у самок, гомозиготных по этому гену или этим генам. [21] Существует много различных способов, которыми может проявляться фенотипическая вариация. Во многих случаях гетерозиготные женщины могут быть бессимптомными или иметь только незначительные симптомы данного расстройства, например, при Х-сцепленной адренолейкодистрофии. [22]
Дифференциация фенотипа у гетерозиготных женщин усиливается наличием перекоса инактивации Х-хромосомы. Обычно каждая Х-хромосома замолкает в половине клеток, но этот процесс перекашивается, когда происходит преимущественная инактивация хромосомы. Считается, что перекос происходит либо случайно, либо из-за физической характеристики хромосомы, которая может вызывать ее более или менее частое замолкание, например, неблагоприятная мутация. [23] [24]
В среднем каждая Х-хромосома инактивирована в половине клеток, хотя у 5–20 % женщин наблюдается перекос Х-инактивации. [23] В случаях, когда перекос присутствует, может наблюдаться широкий спектр проявления симптомов, в результате чего проявление варьируется от незначительного до тяжелого в зависимости от пропорции перекоса. Крайний случай этого наблюдался, когда у монозиготных близнецов женского пола наблюдалась крайняя дисперсия в проявлении болезни Менкеса (заболевание, сцепленное с Х-хромосомой), что привело к смерти одного близнеца, в то время как другой оставался бессимптомным. [25]
Считается, что перекос Х-инактивации может быть вызван проблемами в механизме, который вызывает инактивацию, или проблемами в самой хромосоме. [23] [24] Однако связь между фенотипом и перекосом все еще остается под вопросом и должна рассматриваться в каждом конкретном случае. Исследование, изучавшее как симптоматических, так и бессимптомных женщин, которые были гетерозиготными по мышечным дистрофиям Дюшенна и Беккера (МДД), не обнаружило очевидной связи между экспрессией транскрипта и перекошенной Х-инактивацией. Исследование предполагает, что оба механизма регулируются независимо, и есть и другие неизвестные факторы. [26]
Хромосомный компонент
Центр инактивации X (или просто XIC) на X-хромосоме необходим и достаточен для того, чтобы вызвать инактивацию X. Хромосомные транслокации , которые помещают XIC на аутосому, приводят к инактивации аутосомы, а X-хромосомы, лишенные XIC, не инактивируются. [27] [28]
XIC содержит четыре нетранслируемых гена РНК , Xist , Tsix , Jpx и Ftx , которые участвуют в инактивации X. XIC также содержит сайты связывания как известных, так и неизвестных регуляторных белков . [29]
РНК Xist и Tsix
Ген специфического транскрипта X-неактивной хромосомы ( Xist ) кодирует большую некодирующую РНК , которая отвечает за опосредование специфического подавления X-хромосомы, с которой она транскрибируется. [30] Неактивная X-хромосома покрыта РНК Xist, [31] тогда как Xa не покрыта (см. рисунок справа). X-хромосомы, в которых отсутствует ген Xist, не могут быть инактивированы. [32] Искусственное размещение и экспрессия гена Xist на другой хромосоме приводит к подавлению этой хромосомы. [33] [27]
До инактивации обе X-хромосомы слабо экспрессируют Xist РНК из гена Xist. Во время процесса инактивации будущая Xa перестает экспрессировать Xist, тогда как будущая Xi резко увеличивает выработку Xist РНК. На будущей Xi Xist РНК постепенно покрывает хромосому, распространяясь от XIC; [33] Xist РНК не локализуется в Xa. Выключение генов вдоль Xi происходит вскоре после покрытия Xist РНК.
Как и Xist, ген Tsix кодирует большую РНК, которая, как полагают, не кодирует белок. РНК Tsix транскрибируется антисмыслово по отношению к Xist, что означает, что ген Tsix перекрывает ген Xist и транскрибируется на противоположной цепи ДНК от гена Xist. [28] Tsix является отрицательным регулятором Xist; X-хромосомы, не экспрессирующие Tsix (и, следовательно, имеющие высокий уровень транскрипции Xist), инактивируются гораздо чаще, чем нормальные хромосомы.
Как и Xist, до инактивации обе X-хромосомы слабо экспрессируют Tsix РНК из гена Tsix. После начала X-инактивации будущая Xi перестает экспрессировать Tsix РНК (и увеличивает экспрессию Xist), тогда как Xa продолжает экспрессировать Tsix в течение нескольких дней.
Rep A — это длинная некодирующая РНК, которая работает с другой длинной некодирующей РНК, Xist, для инактивации X. Rep A ингибирует функцию Tsix, антисмысловой части Xist, в сочетании с устранением экспрессии Xite. Он способствует метилированию области Tsix, привлекая PRC2 и, таким образом, инактивируя одну из X-хромосом. [29]
Заглушение
Неактивная X-хромосома не выражает большинство своих генов, в отличие от активной X-хромосомы. Это происходит из-за подавления Xi репрессивным гетерохроматином , который уплотняет ДНК Xi и предотвращает экспрессию большинства генов.
По сравнению с Xa, Xi имеет высокий уровень метилирования ДНК , низкий уровень ацетилирования гистонов , низкий уровень метилирования гистона H3 лизина-4 и высокий уровень метилирования гистона H3 лизина-9 и метку метилирования H3 лизина-27, которая размещается комплексом PRC2, привлеченным Xist , все из которых связаны с подавлением генов. [34] PRC2 регулирует уплотнение хроматина и ремоделирование хроматина в нескольких процессах, включая ответ на повреждение ДНК . [35] Кроме того, вариант гистона, называемый macroH2A ( H2AFY ), обнаруживается исключительно на нуклеосомах вдоль Xi. [36] [37]
Тельца Барра
ДНК, упакованная в гетерохроматин, например, Xi, более конденсирована, чем ДНК, упакованная в эухроматин , например, Xa. Неактивный X образует дискретное тело внутри ядра, называемое тельцем Барра . [38] Тельца Барра обычно располагаются на периферии ядра , поздно реплицируются в клеточном цикле и, поскольку содержат Xi, содержат модификации гетерохроматина и РНК Xist.
Экспрессированные гены на неактивной Х-хромосоме
Часть генов вдоль Х-хромосомы избегают инактивации на Xi. Ген Xist экспрессируется на высоком уровне на Xi и не экспрессируется на Xa. [39] Многие другие гены избегают инактивации; некоторые экспрессируются одинаково на Xa и Xi, а другие, хотя и экспрессируются на обеих хромосомах, все еще преимущественно экспрессируются на Xa. [40] [41] [42] До четверти генов на человеческой Xi способны к избеганию. [40] Исследования на мышах показывают, что в любом данном типе клеток от 3% до 15% генов избегают инактивации, и что идентичность избегающих генов различается в разных тканях. [41] [42]
Многие из генов, которые избегают инактивации, присутствуют вдоль областей Х-хромосомы, которые, в отличие от большинства Х-хромосомы, содержат гены, также присутствующие на Y-хромосоме . Эти области называются псевдоаутосомными областями, поскольку особи любого пола получат две копии каждого гена в этих областях (как аутосома), в отличие от большинства генов вдоль половых хромосом. Поскольку особи любого пола получат две копии каждого гена в псевдоаутосомной области , для женщин не требуется никакой компенсации дозировки, поэтому постулируется, что эти области ДНК развили механизмы, чтобы избежать X-инактивации. Гены псевдоаутосомных областей Xi не имеют типичных модификаций Xi и имеют мало связанной РНК Xist.
Существование генов вдоль неактивной X, которые не подавлены, объясняет дефекты у людей с атипичными числами X-хромосомы, такие как синдром Тернера (X0, вызванный геном SHOX [43] ) или синдром Клайнфельтера (XXY). Теоретически, X-инактивация должна устранить различия в дозировке генов между пораженными людьми и людьми с типичным набором хромосом. Однако у пораженных людей X-инактивация неполная, и дозировка этих не подавленных генов будет отличаться, поскольку они избегают X-инактивации, подобно аутосомной анеуплоидии .
Точные механизмы, контролирующие выход из Х-инактивации, неизвестны, но было показано, что области молчания и выхода имеют различные хроматиновые метки. [41] [44] Было высказано предположение, что выход из Х-инактивации может быть опосредован экспрессией длинной некодирующей РНК (lncRNA) в пределах доменов хромосом, которые выходят из-под контроля. [2]
Использование в экспериментальной биологии
Стэнли Майкл Гартлер использовал инактивацию Х-хромосомы, чтобы продемонстрировать клональное происхождение раковых заболеваний. Изучение нормальных тканей и опухолей у женщин, гетерозиготных по изоферментам сцепленного с полом гена G6PD, показало, что опухолевые клетки у таких людей экспрессируют только одну форму G6PD, тогда как нормальные ткани состоят из почти равной смеси клеток, экспрессирующих два разных фенотипа. Эта модель предполагает, что одна клетка, а не популяция, вырастает в рак. [45] Однако эта модель оказалась неверной для многих типов рака, что предполагает, что некоторые виды рака могут иметь поликлональное происхождение. [46]
Кроме того, измерение статуса метилирования (инактивации) полиморфного человеческого андрогенового рецептора (HUMARA), расположенного на Х-хромосоме, считается наиболее точным методом оценки клональности в биопсиях женских раковых клеток. [47] С помощью этого метода было протестировано большое количество опухолей, некоторые из которых, такие как почечноклеточная карцинома [48] , оказались моноклональными, в то время как другие (например, мезотелиома [49] ) были зарегистрированы как поликлональные.
Исследователи также исследовали использование инактивации Х-хромосомы для подавления активности аутосомных хромосом. Например, Цзян и др. вставили копию гена Xist в одну копию хромосомы 21 в стволовых клетках , полученных от человека с трисомией 21 ( синдром Дауна ). [50] Вставленный ген Xist вызывает образование телец Барра, запускает стабильные модификации гетерохроматина и подавляет большинство генов на дополнительной копии хромосомы 21. В этих модифицированных стволовых клетках подавление генов, опосредованное Xist, по-видимому, устраняет некоторые дефекты, связанные с синдромом Дауна.
История
В 1959 году Сусуму Оно показал, что две Х-хромосомы млекопитающих различаются: одна из них похожа на аутосомы , другая конденсирована и гетерохроматична. [51] Это открытие дало возможность двум группам исследователей независимо друг от друга предположить, что одна из Х-хромосом подверглась инактивации.
В 1961 году Мэри Лион предложила случайную инактивацию одной женской Х-хромосомы для объяснения пятнистого фенотипа самок мышей, гетерозиготных по генам окраски шерсти . [52] Гипотеза Лион также объясняла выводы о том, что одна копия Х-хромосомы в женских клетках была сильно конденсирована, и что мыши только с одной копией Х-хромосомы развивались как бесплодные самки. Это подсказало [53] Эрнесту Бейтлеру , изучавшему гетерозиготных самок на дефицит глюкозо-6-фосфатдегидрогеназы (Г6ФД), что у таких гетерозигот существуют две популяции эритроцитов: дефицитные клетки и нормальные клетки, [54] в зависимости от того, содержит ли инактивированная Х-хромосома (в ядре клетки-предшественника эритроцита) нормальный или дефектный аллель Г6ФД.
Смотрите также
- Система определения пола
- Компенсация дозировки
- тело Барра
- Гетерохроматин
- Эпигенетика
- Искривленная инактивация Х-хромосомы
- Нарушения развития, предположительно связанные с инактивацией Х-хромосомы:
Ссылки
- ^ Gartler SM, Varadarajan KR, Luo P, Canfield TK, Traynor J, Francke U, Hansen RS (сентябрь 2004 г.). "Нормальные модификации гистонов на неактивной X-хромосоме в клетках с синдромом ICF и Ретта: последствия для белков, связывающих метил-CpG". BMC Biology . 2 : 21. doi : 10.1186/1741-7007-2-21 . PMC 521681 . PMID 15377381.
- ^ ab Reinius B, Shi C, Hengshuo L, Sandhu KS, Radomska KJ, Rosen GD, Lu L, Kullander K, Williams RW, Jazin E (ноябрь 2010 г.). "Смещенная по отношению к самкам экспрессия длинных некодирующих РНК в доменах, избегающих инактивации Х-хромосомы у мышей". BMC Genomics . 11 : 614. doi : 10.1186/1471-2164-11-614 . PMC 3091755 . PMID 21047393.
- ^ Takagi N, Sasaki M (август 1975). «Предпочтительная инактивация отцовской Х-хромосомы в дополнительных эмбриональных мембранах мыши». Nature . 256 (5519): 640– 2. Bibcode :1975Natur.256..640T. doi :10.1038/256640a0. PMID 1152998. S2CID 4190616.
- ^ Cheng MK, Disteche CM (август 2004). «Молчание отцов: ранняя инактивация X». BioEssays . 26 (8): 821– 4. doi :10.1002/bies.20082. PMID 15273983.[ мертвая ссылка ]
- ^ ab Okamoto I, Otte AP, Allis CD, Reinberg D, Heard E (январь 2004 г.). "Эпигенетическая динамика инактивации импринтированной X-хромосомы во время раннего развития мыши". Science . 303 (5658): 644– 9. Bibcode :2004Sci...303..644O. doi :10.1126/science.1092727. PMID 14671313. S2CID 26326026.
- ^ ab Deng Q, Ramsköld D, Reinius B, Sandberg R (январь 2014 г.). «Single-cell RNA-seq reveals dynamic, random monoallelic gene expression in infantian cells» (Секвенирование РНК отдельных клеток выявляет динамическую, случайную моноаллельную экспрессию генов в клетках млекопитающих). Science . 343 (6167): 193– 6. Bibcode :2014Sci...343..193D. doi :10.1126/science.1245316. PMID 24408435. S2CID 206552108.
- ^ ab Xue Z, Huang K, Cai C, Cai L, Jiang CY, Feng Y, Liu Z, Zeng Q, Cheng L, Sun YE, Liu JY, Horvath S, Fan G (август 2013 г.). «Генетические программы в ранних эмбрионах человека и мыши, выявленные с помощью секвенирования РНК отдельных клеток». Nature . 500 (7464): 593– 7. Bibcode :2013Natur.500..593X. doi :10.1038/nature12364. PMC 4950944 . PMID 23892778.
- ^ Borensztein M, Syx L, Ancelin K, Diabangouaya P, Picard C, Liu T, Liang JB, Vassilev I, Galupa R, Servant N, Barillot E, Surani A, Chen CJ, Heard E (март 2017 г.). "Xist-зависимая импринтированная инактивация X и ранние последствия ее сбоя для развития". Nature Structural & Molecular Biology . 24 (3): 226– 233. doi :10.1038/nsmb.3365. PMC 5337400 . PMID 28134930.
- ^ ab Deng X, Berletch JB, Nguyen DK, Disteche CM (июнь 2014 г.). «Регуляция X-хромосомы: разнообразные закономерности в развитии, тканях и болезнях». Nature Reviews. Genetics . 15 (6): 367–78 . doi :10.1038/nrg3687. PMC 4117651. PMID 24733023 .
- ^ Vértesy Á, Arindrarto W, Roost MS, Reinius B, Torrens-Juaneda V, Bialecka M и др. (май 2018 г.). «Родительский гаплотип-специфический одноклеточный транскриптомизм выявляет неполное эпигенетическое перепрограммирование в женских половых клетках человека». Nature Communications . 9 (1): 1873. Bibcode :2018NatCo...9.1873V. doi :10.1038/s41467-018-04215-7. PMC 5951918 . PMID 29760424.
- ^ Guo F, Yan L, Guo H, Li L, Hu B, Zhao Y и др. (июнь 2015 г.). «Транскриптомные и ДНК-метиломные ландшафты первичных зародышевых клеток человека». Cell . 161 (6): 1437– 52. doi : 10.1016/j.cell.2015.05.015 . PMID 26046443.
- ^ Puck JM, Willard HF (январь 1998). «Инактивация X у женщин с Х-сцепленным заболеванием». The New England Journal of Medicine . 338 (5): 325– 8. doi :10.1056/NEJM199801293380611. PMID 9445416.
- ^ Balaton BP, Cotton AM, Brown CJ (30 декабря 2015 г.). «Вывод консенсусного статуса инактивации для генов, сцепленных с Х-хромосомой, из исследований по всему геному». Биология половых различий . 6 (35): 35. doi : 10.1186/s13293-015-0053-7 . PMC 4696107. PMID 26719789 .
- ^ Грейвс JA (1996). «Млекопитающие, которые нарушают правила: генетика сумчатых и однопроходных». Annual Review of Genetics . 30 : 233–60 . doi :10.1146/annurev.genet.30.1.233. PMID 8982455.
- ^ Lyon MF (январь 1972). «Инактивация X-хромосомы и закономерности развития у млекопитающих». Biological Reviews of the Cambridge Philosophical Society . 47 (1): 1– 35. doi :10.1111/j.1469-185X.1972.tb00969.x. PMID 4554151. S2CID 39402646.
- ^ Migeon, B (2010). «Инактивация X-хромосомы в клетках человека». The Biomedical & Life Sciences Collection . Henry Stewart Talks, Ltd: 1– 54. Получено 15 декабря 2013 г.
- ^ ab Gartler SM, Goldman MA (2001). "Инактивация X-хромосомы" (PDF) . Энциклопедия наук о жизни . Nature Publishing Group: 1– 2.
- ^ Connallon T, Clark AG (апрель 2013 г.). «Дифференциальный по полу отбор и эволюция стратегий инактивации X». PLOS Genetics . 9 (4): e1003440. doi : 10.1371/journal.pgen.1003440 . PMC 3630082. PMID 23637618 .
- ^ Авнер, Филипп; Херд, Эдит (январь 2001 г.). «Инактивация X-хромосомы: подсчет, выбор и инициация». Nature Reviews Genetics . 2 (1): 59– 67. doi :10.1038/35047580. ISSN 1471-0064. PMID 11253071. S2CID 5234164.
- ^ Barakat TS, Gribnau J (2010). «Инактивация X-хромосомы и эмбриональные стволовые клетки». В Meshorer E, Plath K (ред.). Клеточная биология стволовых клеток . Landes Bioscience и Springer Science+Business Media.
- ^ Ma L, Hoffman G, Keinan A (март 2015 г.). «X-инактивация информирует дисперсионное тестирование для X-сцепленной ассоциации количественного признака». BMC Genomics . 16 (1): 241. doi : 10.1186/s12864-015-1463-y . PMC 4381508 . PMID 25880738.
- ^ Habekost CT, Pereira FS, Vargas CR, Coelho DM, Torrez V, Oses JP, Portela LV, Schestatsky P, Felix VT, Matte U, Torman VL, Jardim LB (октябрь 2015 г.). "Скорость прогрессирования миелопатии у гетерозигот с Х-сцепленной адренолейкодистрофией". Metabolic Brain Disease . 30 (5): 1279– 84. doi :10.1007/s11011-015-9672-2. PMID 25920484. S2CID 11375978.
- ^ abc Belmont JW (июнь 1996 г.). «Генетический контроль инактивации X и процессы, приводящие к перекосу инактивации X». American Journal of Human Genetics . 58 (6): 1101– 8. PMC 1915050. PMID 8651285 .
- ^ ab Holle JR, Marsh RA, Holdcroft AM, Davies SM, Wang L, Zhang K, Jordan MB (июль 2015 г.). «Гемофагоцитарный лимфогистиоцитоз у пациентки из-за гетерозиготной мутации XIAP и перекошенной инактивации X-хромосомы». Pediatric Blood & Cancer . 62 (7): 1288– 90. doi :10.1002/pbc.25483. PMID 25801017. S2CID 5516967.
- ^ Бургемейстер А.Л., Цирн Б., Оффнер Ф., Калер С.Г., Лемм Г., Россье Э., Бюттель Х.М. (ноябрь 2015 г.). «Болезнь Менкеса с дискордантным фенотипом у монозиготных близнецов женского пола». Американский журнал медицинской генетики. Часть А. 167A (11): 2826–9 . doi :10.1002/ajmg.a.37276. ПМК 6475897 . ПМИД 26239182.
- ^ Бриоски С, Гуаланди Ф, Скоттон С, Армароли А, Боволента М, Фальзарано М.С., Сабателли П, Селватичи Р, Д'Амико А, Пане М, Риччи Г, Сицилиано Г, Тедески С, Пини А, Верчелли Л, Де Грандис Д, Меркури Э, Бертини Э, Мерлини Л, Монджини Т, Ферлини А (август 2012). «Генетическая характеристика женщин-носителей симптоматического МДД: отсутствие связи между Х-инактивацией, балансировкой транскрипционных аллелей МДД и фенотипом». BMC Медицинская генетика . 13:73 . дои : 10.1186/1471-2350-13-73 . ПМЦ 3459813 . ПМИД 22894145.
- ^ ab Lee JT, Jaenisch R (март 1997). "Дальнодействующие цис-эффекты эктопических центров инактивации Х-хромосомы на аутосоме мыши". Nature . 386 (6622): 275– 9. Bibcode :1997Natur.386..275L. doi :10.1038/386275a0. PMID 9069285. S2CID 10899129.
- ^ ab Lee JT, Davidow LS, Warshawsky D (апрель 1999 г.). "Tsix, ген антисмысловой к Xist в центре инактивации X". Nature Genetics . 21 (4): 400– 4. doi :10.1038/7734. PMID 10192391. S2CID 30636065.
- ^ ab Mercer, TR, Dinger, ME, Mattick, JS, (2009). Длинные некодирующие РНК: взгляд на функции. Nature Reviews Genetics. (10) 155–159.
- ^ Hoki Y, Kimura N, Kanbayashi M, Amakawa Y, Ohhata T, Sasaki H, Sado T (январь 2009 г.). «Проксимальный консервативный повтор в гене Xist необходим как геномный элемент для инактивации X у мышей». Development . 136 (1): 139– 46. doi : 10.1242/dev.026427 . PMID 19036803.
- ^ Ng K, Pullirsch D, Leeb M, Wutz A (январь 2007 г.). «Xist и порядок подавления» (обзорная статья) . EMBO Reports . 8 (1): 34– 9. doi :10.1038/sj.embor.7400871. PMC 1796754. PMID 17203100. Рисунок
1 РНК Xist охватывает X, с которого она транскрибируется.
{{cite journal}}: Внешняя ссылка в|quote= - ^ Penny GD, Kay GF, Sheardown SA, Rastan S, Brockdorff N (1996). "Требование Xist при инактивации X-хромосомы". Nature . 379 (6561): 131– 7. Bibcode :1996Natur.379..131P. doi :10.1038/379131a0. PMID 8538762. S2CID 4329368.
- ^ ab Herzing LB, Romer JT, Horn JM, Ashworth A (март 1997). "Xist имеет свойства центра инактивации X-хромосомы". Nature . 386 (6622): 272– 5. Bibcode :1997Natur.386..272H. doi :10.1038/386272a0. PMID 9069284. S2CID 4371247.
- ^ Ng K, Pullirsch D, Leeb M, Wutz A (январь 2007 г.). "Xist и порядок подавления" (обзорная статья) . EMBO Reports . 8 (1): 34– 9. doi :10.1038/sj.embor.7400871. PMC 1796754. PMID 17203100. Таблица
1. Характеристики неактивной территории X
{{cite journal}}: Внешняя ссылка в|quote=
Lucchesi JC, Kelly WG, Panning B (2005). «Ремоделирование хроматина при компенсации дозировки». Annual Review of Genetics . 39 : 615–51 . CiteSeerX 10.1.1.328.2992 . doi :10.1146/annurev.genet.39.073003.094210. PMID 16285873. - ^ Veneti Z, Gkouskou KK, Eliopoulos AG (июль 2017 г.). «Комплекс репрессора Polycomb 2 в геномной нестабильности и раке». Int J Mol Sci . 18 (8): 1657. doi : 10.3390/ijms18081657 . PMC 5578047. PMID 28758948 .
- ^ Costanzi C, Pehrson JR (июнь 1998). «Гистон macroH2A1 концентрируется в неактивной X-хромосоме самок млекопитающих». Nature . 393 (6685): 599– 601. Bibcode :1998Natur.393..599C. doi :10.1038/31275. PMID 9634239. S2CID 205001095.
- ^ Costanzi C, Stein P, Worrad DM, Schultz RM, Pehrson JR (июнь 2000 г.). «Гистон macroH2A1 концентрируется в неактивной X-хромосоме женских предимплантационных эмбрионов мышей» (PDF) . Development . 127 (11): 2283– 9. doi :10.1242/dev.127.11.2283. PMID 10804171.
- ^ Barr ML, Bertram EG (апрель 1949). «Морфологическое различие между нейронами самцов и самок и поведение ядрышкового спутника во время ускоренного синтеза нуклеопротеина». Nature . 163 (4148): 676– 677. Bibcode :1949Natur.163..676B. doi :10.1038/163676a0. PMID 18120749. S2CID 4093883.
- ^ Plath K, Mlynarczyk-Evans S, Nusinow DA, Panning B (2002). "Xist РНК и механизм инактивации X-хромосомы". Annual Review of Genetics . 36 : 233–78 . doi :10.1146/annurev.genet.36.042902.092433. PMID 12429693.
- ^ ab Carrel L, Willard HF (март 2005 г.). «Профиль инактивации X выявляет обширную изменчивость экспрессии генов, связанных с X-хромосомой, у женщин». Nature . 434 (7031): 400– 4. Bibcode :2005Natur.434..400C. doi :10.1038/nature03479. PMID 15772666. S2CID 4358447.
- ^ abc Calabrese JM, Sun W, Song L, Mugford JW, Williams L, Yee D, Starmer J, Mieczkowski P, Crawford GE, Magnuson T (ноябрь 2012 г.). "Сайт-специфическое подавление регуляторных элементов как механизм инактивации X". Cell . 151 (5): 951– 63. doi :10.1016/j.cell.2012.10.037. PMC 3511858 . PMID 23178118.
- ^ ab Yang F, Babak T, Shendure J, Disteche CM (май 2010 г.). «Глобальный обзор побега от инактивации X с помощью секвенирования РНК у мышей». Genome Research . 20 (5): 614– 22. doi :10.1101/gr.103200.109. PMC 2860163 . PMID 20363980.
- ^ "Синдром Тернера: MedlinePlus Genetics". medlineplus.gov . Получено 10 февраля 2023 г. .
- ^ Berletch JB, Yang F, Disteche CM (июнь 2010 г.). «Избегание инактивации X у мышей и людей». Genome Biology . 11 (6): 213. doi : 10.1186 /gb-2010-11-6-213 . PMC 2911101. PMID 20573260.
- ^ Линдер Д., Гартлер СМ. (октябрь 1965 г.). «Мозаицизм глюкозо-6-фосфатдегидрогеназы: использование в качестве клеточного маркера при изучении лейомиом». Science . 150 (3692): 67– 9. Bibcode :1965Sci...150...67L. doi :10.1126/science.150.3692.67. PMID 5833538. S2CID 33941451.
- ^ Parsons BL (2008). «Многие различные типы опухолей имеют поликлональное происхождение: доказательства и последствия». Mutation Research . 659 (3): 232– 47. doi :10.1016/j.mrrev.2008.05.004. PMID 18614394.
- ^ Chen GL, Prchal JT (сентябрь 2007 г.). «Тестирование клональности, сцепленной с Х-хромосомой: интерпретация и ограничения». Blood . 110 (5): 1411– 9. doi :10.1182/blood-2006-09-018655. PMC 1975831 . PMID 17435115.
- ^ Petersson F, Branzovsky J, Martinek P, Korabecna M, Kruslin B, Hora M и др. (Июль 2014 г.). «Лейомиоматозная строма при почечноклеточной карциноме является поликлональной и не является частью неопластического процесса». Virchows Archiv . 465 (1): 89– 96. doi :10.1007/s00428-014-1591-9. PMID 24838683. S2CID 24870232.
- ^ Comertpay S, Пасторино С, Танджи М, Меззапель Р, Стрианезе О, Наполитано А, Бауманн Ф, Вайгель Т, Фридберг Дж, Шугарбейкер П, Крауз Т, Ван Э, Пауэрс А, Гаудино Г, Канодиа С, Пасс ХИ, Парсонс Б.Л., Ян Х., Карбон М. (декабрь 2014 г.). «Оценка клонального происхождения злокачественной мезотелиомы». Журнал трансляционной медицины . 12 :301. дои : 10.1186/s12967-014-0301-3 . ПМЦ 4255423 . ПМИД 25471750.
- ^ Jiang J, Jing Y, Cost GJ, Chiang JC, Kolpa HJ, Cotton AM и др. (август 2013 г.). «Перевод компенсации дозировки в трисомию 21». Nature . 500 (7462): 296– 300. Bibcode :2013Natur.500..296J. doi :10.1038/nature12394. PMC 3848249 . PMID 23863942.
- ^ Ohno S, Kaplan WD, Kinosita R (октябрь 1959). «Формирование полового хроматина одной X-хромосомой в клетках печени Rattus norvegicus». Experimental Cell Research . 18 (2): 415– 8. doi :10.1016/0014-4827(59)90031-X. PMID 14428474.
- ^ Lyon MF (апрель 1961 г.). «Действие гена в X-хромосоме мыши (Mus musculus L.)». Nature . 190 (4773): 372– 3. Bibcode :1961Natur.190..372L. doi :10.1038/190372a0. PMID 13764598. S2CID 4146768.
- ^ Beutler E (январь 2008). «Дефицит глюкозо-6-фосфатдегидрогеназы: историческая перспектива». Кровь . 111 (1): 16–24 . doi : 10.1182/blood-2007-04-077412 . PMID 18156501.
- ^ Beutler E, Yeh M, Fairbanks VF (январь 1962 г.). «Нормальная человеческая женщина как мозаика активности X-хромосомы: исследования с использованием гена дефицита C-6-PD в качестве маркера». Труды Национальной академии наук Соединенных Штатов Америки . 48 (1): 9– 16. Bibcode : 1962PNAS...48....9B. doi : 10.1073/pnas.48.1.9 . PMC 285481. PMID 13868717.
Дальнейшее чтение
- Huynh KD, Lee JT (май 2005 г.). «Инактивация X-хромосомы: гипотеза, связывающая онтогенез и филогенез». Nature Reviews. Genetics . 6 (5): 410– 8. doi :10.1038/nrg1604. PMID 15818384. S2CID 19245310.
- Goto T, Monk M (июнь 1998 г.). «Регулирование инактивации X-хромосомы в развитии у мышей и людей» (обзорная статья) . Microbiology and Molecular Biology Reviews . 62 (2): 362–78 . doi :10.1128/MMBR.62.2.362-378.1998. PMC 98919. PMID 9618446 .
- Lyon MF (декабрь 2003 г.). «Лайон и гипотеза LINE». Семинары по клеточной и эволюционной биологии (обзорная статья). 14 (6): 313– 8. doi :10.1016/j.semcdb.2003.09.015. PMID 15015738.
- Ng K, Pullirsch D, Leeb M, Wutz A (январь 2007 г.). «Xist и порядок подавления» (обзорная статья) . EMBO Reports . 8 (1): 34– 9. doi :10.1038/sj.embor.7400871. PMC 1796754. PMID 17203100 .
- Cerase A, Pintacuda G, Tattermusch A, Avner P (август 2015 г.). "Локализация и функция Xist: новые идеи с нескольких уровней". Genome Biology . 16 (1): 166. doi : 10.1186/s13059-015-0733-y . PMC 4539689 . PMID 26282267.
