Нитрон-олефиновое (3+2) циклоприсоединение
Реакция циклоприсоединения нитрона к олефину (3+2) представляет собой соединение нитрона с алкеном или алкином для получения изоксазолина или изоксазолидина посредством процесса циклоприсоединения (3+2) . [1] Эта реакция представляет собой 1,3-диполярное циклоприсоединение , в котором нитрон действует как 1,3-диполь , а алкен или алкин — как диполярофил.
Механизм и стереохимия
Когда нитроны объединяются либо с алкенами, либо с алкинами, циклоприсоединение (3+2) приводит к образованию новой связи C–C и новой связи C–O. Циклоприсоединение стереоспецифично по отношению к конфигурации алкена; однако диастереоселективность в реакциях C-замещенных нитронов часто низкая. [2] Региоселективность контролируется доминирующими граничными орбиталями, взаимодействующими во время реакции, и субстраты с электронно-различимыми заместителями имеют тенденцию реагировать с высокой региоселективностью. Внутримолекулярные версии реакции использовались для синтеза сложных полициклических углеродных каркасов. Восстановление связи N–O приводит к 1,3-аминоспиртам.

Циклоприсоединение (3+2) само по себе является согласованным перициклическим процессом, региохимия которого контролируется граничными молекулярными орбиталями на нитроне (диполь) и диполярофиле. [3] Когда R' является электронодонорной группой, алкилом или арилом, доминирующими FMO являются HOMO диполярофила и LUMO нитрона. Таким образом, соединяя атомы, коэффициенты которых в этих орбиталях наибольшие, предсказывается, что 5-замещенный изоксазолидин будет преобладать. С другой стороны, когда диполярофил беден электронами, взаимодействие HOMO нитрона - LUMO диполярофила является наиболее важным, и 4-замещенный продукт является предпочтительным.

Область применения и ограничения
Алкильные и арильные терминальные алкены реагируют с высокой региоселективностью, давая 5-замещенные изоксазолидины. Этот результат согласуется с пограничным молекулярным орбитальным (кинетическим) контролем распределения изомеров: кислород нитрона, который обладает наибольшим орбитальным коэффициентом в HOMO нитрона, образует связь с внутренним углеродом алкена, который обладает наибольшим орбитальным коэффициентом в LUMO алкена. [4]

Конфигурация 1,2-дизамещенных алкенов сохраняется в продуктах циклоприсоединения. В соответствии с контролем FMO реакции, более электроноакцепторный заместитель на этих субстратах оказывается в 4-м положении продукта. Другими словами, углерод с наибольшим коэффициентом LUMO в диполярофиле (удалённом от электроноакцепторной группы) образует связь с кислородом нитрона, который обладает наибольшим коэффициентом HOMO в нитроне. [5]

Алкины также могут служить диполярофилами в этой реакции. Правила прогнозирования продуктов циклоприсоединения алкенов на основе соответствующих FMO применимы и к замещенным алкинам — алкины с низким содержанием электронов имеют тенденцию давать 4-замещенные продукты, тогда как богатые электронами, алкильные и арильные алкины дают 5-замещенные продукты. [6]

Внутримолекулярные варианты реакции очень полезны для синтеза сложных полициклических каркасов. Эти реакции обычно происходят при гораздо более низких температурах, чем межмолекулярные циклоприсоединения. Региохимию сложнее предсказать для внутримолекулярных реакций: могут получиться как мостиковые, так и конденсированные продукты, и возможны как цис- , так и транс -конденсированные кольца. [7]

Существующий стереоцентр в связке между алкеном и нитроном часто приводит к образованию одного диастереомера продукта. В этом примере более объемный фенильный заместитель оказывается на экзограни бициклической кольцевой системы. [8]

Синтетические приложения
Синтез (±)-люпинина
2,3,4,5-Тетрагидропиридин-1-оксид может быть использован для построения конденсированных гетероциклов в алкалоидах и других природных продуктах. Синтез (±) -лупинина использует перегруппировку мезилата с расширением кольца, что обеспечивает быстрый доступ к цели. [9]

Синтез гидроксикотинина
Структура гидроксикотинина, человеческого метаболита никотина, была подтверждена с помощью независимого синтеза с использованием нитрон-олефинового циклоприсоединения. [10]

Синтез (+)-порантеридина
Перегруппировка (3+2) циклоаддукта дает (+)-порантеридин. [11] Циклоаддукт подвергается гидрированию, кислотному гидролизу, окислению, основному гидролизу и циклизации для получения целевого соединения.

Реакция Кинугаса с образованием β-лактамов
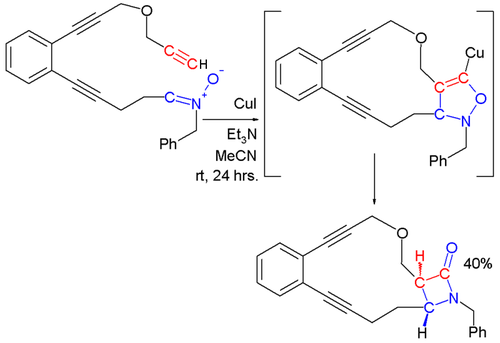
В реакции Кинугасы нитрон и ацетилид меди реагируют, в конечном итоге образуя β-лактам . [12] [13] На первом этапе этой реакции ацетилид металла образуется в результате реакции терминального алкина с солью меди. 1,3-диполярное циклоприсоединение нитрона с ацетилидом металла дает 5-членное кольцо, которое перестраивается, образуя β-лактам.
Другие реакции
Другим примером (3+2) циклоприсоединения является тот, в котором аддукт Бейлиса-Хиллмана является диполярофилом. Он реагирует с C-фенил-N-метилнитроном с образованием изоксазолидина . [ 14]
Ссылки
- ^ Конфалоне, ПН; Хуайе, ЭМ . Org. React. 1988 , 36 , 1. doi :10.1002/0471264180.or036.01
- ^ Туфариелло, Джей Джей; Али, ЮАР; Клингеле. HO J. Org. хим. 1979 , 44 , 4213.
- ^ Хоук, К. Н. Дж. Американского химического общества 1972 , 94 , 8953.
- ^ Хейсген, Р.; Хаук, Х.; Граши, Р.; Зейдль, H. Chem. Бер. 1968 , 101 , 2568.
- ^ Жукла, М. Тетраэдр 1973 , 29 , 2315.
- ^ Винтерфельдт, Э.; Крон, В.; Страке, H. Chem. Бер. 1969 , 102 , 2346.
- ^ ЛеБел, Северная Каролина; Пост, МЭ; Ванг, Джей Джей Дж. Ам. хим. Соц. 1964 , 86 , 3759–3767. дои : 10.1021/ja01072a031
- ^ Виник, Ф.Дж.; Фенглер, IE; Гшвенд, HW J. Org. хим. 1977 , 42 , 2936.
- ^ Туфариелло, Джей Джей; Тегелер, Дж. Дж. Тетраэдр Летт. , 1976 , 4037–4040. дои : 10.1016/S0040-4039(00)92569-3
- ^ Дань, Э.; Кастаньоли-младший, Нью- Джерси Мед. хим. 1972 , 15 , 356–360. дои : 10.1021/jm00274a005
- ^ Госсингер, Э. Tetrahedron Lett. 1980 , 21 , 2229.
- ^ Реакции фенилацетилида меди(I) с нитронами Манабу Кинугаса и Сидзунобу Хашимото J. Chem. Soc., Chem. Commun., 1972 , 466 - 467, doi :10.1039/C39720000466
- ^ Новый синтез циклических ендиинов, слитых с β-лактамами, с помощью внутримолекулярной реакции Кинугасы Runa Pal и Amit Basak Chem. Коммун. , 2006 , 2992–2994, дои : 10.1039/b605743h
- ^ Диастереоселективность 1,3-диполярного циклоприсоединения нитрона к аддуктам Бейлиса-Хиллмана Бранислав Дугович, Любор Фишера, Кристиан Хаметнер и Нада Пронайовац. Аркивок 2004 BS-834A Артикул