Кератансульфат
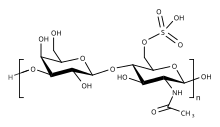
Кератансульфат ( КС ), также называемый кератосульфатом , представляет собой один из нескольких сульфатированных гликозаминогликанов (структурных углеводов), которые были обнаружены, в частности, в роговице , хрящах и костях . Он также синтезируется в центральной нервной системе , где участвует как в развитии [1] , так и в образовании глиальных рубцов после травмы. [2] Кератансульфаты представляют собой крупные, сильно гидратированные молекулы, которые в суставах могут действовать как подушка для поглощения механических ударов .
Структура
Как и другие гликозаминогликаны, кератансульфат представляет собой линейный полимер , состоящий из повторяющейся дисахаридной единицы. Кератансульфат встречается в виде протеогликана (PG), в котором цепи KS прикреплены к белкам клеточной поверхности или внеклеточного матрикса , называемым основными белками. Основные белки KS включают люмикан , кератокан , мимекан , фибромодулин , PRELP , остеоадгерин и аггрекан .
Основная повторяющаяся дисахаридная единица в кератансульфате -3 Gal β1-4 GlcNAc6S β1-. Она может быть сульфатирована в положении углерода 6 (C6) одного или обоих моносахаридов Gal или GlcNAc . Однако детальную первичную структуру конкретных типов KS лучше всего рассматривать как состоящую из трех областей: [3]
- Область связи, на одном конце которой цепь KS связана с основным белком.
- Повторяющаяся область, состоящая из -3 Gal β1-4 GlcNAc β1- повторяющейся дисахаридной единицы и
- Область замыкания цепи, расположенная на противоположном конце цепи KS относительно области связывания белка.
Моносахарид манноза находится в области связи кератансульфата типа I (KSI). Дисахариды в повторяющейся области KSII могут быть фукозилированы , а N-ацетилнейраминовая кислота покрывает конец всех цепей кератансульфата типа II (KSII) и до 70% цепей типа KSI. [4]
классы КС
Обозначения KSI и KSII изначально были присвоены на основе типа ткани, из которой был выделен кератансульфат. KSI был выделен из ткани роговицы , а KSII — из скелетной ткани. [5] [6] Незначительные различия в составе моносахаридов существуют между KS, извлеченными из обоих источников, и даже между KS, извлеченными из одного и того же источника. Однако основные различия возникают в том, как каждый тип KS присоединяется к своему основному белку. [7] Обозначения KSI и KSII теперь основаны на этих различиях в связях белков. KSI связан N - атомом с определенными аминокислотами аспарагина через N -ацетилглюкозамин , а KSII связан O -атомом с определенными аминокислотами серина или треонина через N -ацетилгалактозамин . [8] Основанная на тканях классификация KS больше не существует, поскольку было показано, что типы KS не являются тканеспецифичными. [4] Третий тип KS (KSIII) также был выделен из мозговой ткани, которая связана O -атомом с определенными аминокислотами серина или треонина через маннозу . [9]
KSI роговицы
Количество KS, обнаруженного в роговице, в 10 раз выше, чем в хряще, и в 2-4 раза выше, чем в других тканях. [10] Он вырабатывается кератоцитами роговицы [11] и, как полагают, играет роль динамического буфера гидратации роговицы. При редком прогрессирующем заболевании, называемом макулярной дистрофией роговицы (MCDC), синтез кератансульфата либо отсутствует (MCDC типа I), либо аномален (MCDC типа II). [12]
Некорнеальный KSI
Остеоадгерин , фибромодулин и PRELP являются основными белками, обнаруженными в костях и хрящах, которые модифицируются N-связанными цепями KS. Остеоадгерин и фибромодулин, связанные с цепями KS, короче, чем те, которые обнаружены в роговице, обычно 8-9 дисахаридных единиц в длину. [13] В то время как роговичный KSI состоит из ряда доменов, демонстрирующих различные степени сульфатирования, самая длинная из которых может иметь длину 8-32 дисахаридных единиц. Невосстанавливающий конец фибромодулина KS больше похож по структуре на невосстанавливающий конец кератансульфата типа KSII, чем на роговичный KSI. Поэтому считается, что структура KS определяется специфической для ткани доступностью гликозилтрансфераз, а не типом связи с основным белком. [4]
КСИИ
Хрящевой KSII почти полностью сульфатирован и состоит из дисульфатированных мономеров , иногда прерываемых одним моносульфатированным мономером лактозамина . [8] Фукозилирование также распространено с альфа-связанной фукозой, присутствующей в положении углерода 3 сульфатированного GlcNAc , за исключением случая трахеального KSII, где эта особенность отсутствует.
Смотрите также
- N-ацетилглюкозамин
- Галактоза
- Лумикан
- Синдром Моркио характеризуется накоплением КС
- Протеогликан 4
Ссылки
- ^ Miller B, Sheppard AM, Pearlman AL (апрель 1997 г.). «Развитие экспрессии кератансульфатподобной иммунореактивности различает таламические ядра и корковые домены». J. Comp. Neurol. 380 (4): 533– 52. doi :10.1002/(SICI)1096-9861(19970421)380:4<533::AID-CNE9>3.0.CO;2-2. PMID 9087531.
- ^ Чжан Х., Учимура К., Кадомацу К. (ноябрь 2006 г.). «Кератансульфат мозга и образование глиальных рубцов». Ann. NY Acad. Sci. 1086 (1): 81– 90. Bibcode : 2006NYASA1086...81Z. doi : 10.1196/annals.1377.014. PMID 17185507.
- ^ Tai GH, Huckerby TN, Nieduszynski IA (1996). «Множественные невосстанавливающие концы цепей, выделенные из бычьих роговичных кератансульфатов». J. Biol. Chem . 271 (38): 23535– 23546. doi : 10.1074/jbc.271.38.23535 . PMID 8798563.
- ^ abc Funderburgh JL. (2000). «Кератансульфат: структура, биосинтез и функция». Гликобиология . 10 (10): 951–958 . doi : 10.1093/glycob/10.10.951 . PMID 11030741.
- ^ Мейер К, Линкер А и др. (1 декабря 1953 г.). «Мукополисахариды бычьей роговицы». J. Biol. Chem . 205 (2): 611– 616. doi : 10.1016/S0021-9258(18)49203-4 . PMID 13129238.
- ^ Мейер К.; Хоффман П.; Линкер А. (1958). «Мукополисахариды реберного хряща». Science . 128 (3329): 896. Bibcode :1958Sci...128..896M. doi :10.1126/science.128.3329.896. PMID 13592269.
- ^ Seno N, Meyer K, et al. (1 марта 1965 г.). «Изменения в кератосульфатах». J. Biol. Chem . 240 (3): 1005–1019 . doi : 10.1016/S0021-9258(18)97528-9 . PMID 14284693.
- ^ ab Nieduszynski IA, Huckerby TN и др. (1990). «Существуют два основных типа скелетных кератансульфатов». Biochem. J . 271 (1): 243– 245. doi :10.1042/bj2710243. PMC 1149539 . PMID 2222415.
- ^ Krusius T, Finne J, et al. (25 июня 1986 г.). «Идентификация O-гликозидного маннозо-связанного сиалилированного тетрасахарида и кератансульфатных олигосахаридов в хондроитинсульфатном протеогликане мозга». J. Biol. Chem . 261 (18): 8237– 8242. doi : 10.1016/S0021-9258(19)83901-7 . PMID 2941416.
- ^ Funderburgh JL; Caterson B.; Conrad GW. (1987). «Распределение протеогликанов, антигенно связанных с кератансульфатным протеогликаном роговицы». J. Biol. Chem . 262 (24): 11634– 11640. doi : 10.1016/S0021-9258(18)60856-7 . PMID 2957372.
- ^ Funderburgh JL, Mann MM, Funderburgh ML (ноябрь 2003 г.). «Фенотип кератоцитов опосредует структуру протеогликана: роль фибробластов в фиброзе роговицы». J. Biol. Chem. 278 (46): 45629– 37. doi : 10.1074/jbc.M303292200 . PMC 2877919 . PMID 12933807.
- ^ Макулодистрофия, роговица, 1 - OMIM
- ^ Lauder RM, Huckerby TN, Nieduszynski IA (1997). «Структура цепей сульфата кератана, прикрепленных к фибромодулину из человеческого суставного хряща». Glycoconj. J . 14 (5): 651– 660. doi :10.1023/A:1018552913584. PMID 9298700.
Внешние ссылки
- Хондроитин и кератинсульфат в программе ортопедии системы здравоохранения Университета Дьюка
- Кератан+сульфат в Национальной медицинской библиотеке США, медицинские предметные рубрики (MeSH)