Реакция Аза-Дильса-Альдера
| Реакция Аза-Дильса-Альдера | |
|---|---|
| Назван в честь | Отто Дильс Курт Альдер |
| Тип реакции | Циклоприсоединение |
| Идентификаторы | |
| Идентификатор онтологии RSC | Номер заказа:0000092 |
Реакция Аза-Дильса–Альдера представляет собой модификацию реакции Дильса–Альдера , в которой азот заменяет sp2 - углерод. [1] Атом азота может быть частью диена или диенофила .

Механизм
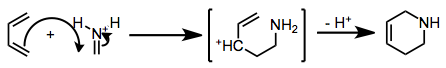
Реакция аза-Дильса-Альдера (IDA) может происходить либо согласованным, либо ступенчатым способом. Переходное состояние с самой низкой энергией для согласованного процесса помещает неподеленную пару имина (или координированную кислоту Льюиса) в экзо -положение. Таким образом, ( E )-имины, в которых неподеленная пара и больший заместитель углерода имина находятся в цис-положении , имеют тенденцию давать экзо- продукты. [2]
(2)
Когда иминный азот протонируется или координируется с сильной кислотой Льюиса, механизм переходит на ступенчатый путь Манниха-Михаэля. [3]
(3)
Присоединение электроноакцепторной группы к иминному азоту увеличивает скорость. Обычно преобладает экзо- изомер (особенно при использовании циклических диенов), хотя селективность варьируется. [4]
(7)
Область применения и ограничения
Стереоселективные варианты
Во многих случаях циклические диены дают более высокую диастереоселективность, чем ациклические диены. Использование хиральных вспомогательных веществ на основе аминокислот, например, приводит к хорошей диастереоселективности в реакциях циклопентадиена, но не в реакциях ациклических диенов. [5]
(6)
Асимметричные варианты
Для осуществления диастереоселекции использовались хиральные вспомогательные вещества либо на иминоатоме азота [6], либо на иминоатоме углерода [7] .
(5)
В энантиоселективной реакции Дильса-Альдера (ДА) анилина , формальдегида и циклогексенона , катализируемой (S) -пролином , даже диен маскируется. [8]

Имины, полученные in situ
Имин часто генерируется in situ из амина и формальдегида . Примером может служить реакция циклопентадиена с бензиламином в азанорборнен .. [9]

Каталитический цикл начинается с реакций ароматического амина с формальдегидом до имина и реакции кетона с пролином до диена. Второй шаг, эндотриг-циклизация , приводит к одному из двух возможных энантиомеров (99% ee ), поскольку атом азота имина образует водородную связь с карбоксильной кислотной группой пролина на Si-грани . Гидролиз конечного комплекса высвобождает продукт и регенерирует катализатор.

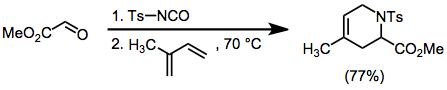
Тозилимины могут быть получены in situ из тозилизоцианата и альдегидов. Циклоприсоединения этих промежуточных продуктов с диенами дают отдельные конституционные изомеры, но протекают с умеренной стереоселективностью. [10]
(8)
Реакции сульфониламинов, катализируемые кислотой Льюиса, также демонстрируют умеренную стереоселективность. [11]
(9)
Простые неактивированные имины реагируют с углеводородными диенами только с помощью кислоты Льюиса; однако, как электронно-богатые, так и электронно-бедные диены реагируют с неактивированными иминами при нагревании. Винилкетены, например, дают дигидропиридоны при [4+2] циклоприсоединении с иминами. Регио- и стереоселективность необычно высоки в реакциях этого класса диенов. [12]
(10)
Винилаленовые реакции в присутствии кислоты Льюиса протекают аналогичным образом, часто с высокой диастереоселективностью. [13]
(11)
Ацилиминиевые субстраты
В реакциях циклоприсоединения также участвуют ионы ацилиминиума. Эти катионы образуются при удалении хлорида из хлорметилированных амидов: [14]
- RCONRCH 2 Cl → RCONR/dCH+2 + Cl −
Образующиеся ацилиминиевые катионы выполняют функции гетеродиенов, а также диенофилов .
Использование в синтезе натуральных продуктов
Реакция аза-Дильса-Альдера была применена для синтеза ряда алкалоидных природных продуктов. Диен Данишефского используется для образования шестичленного кольца на пути к филлантину. [15]
(12)
Смотрите также
Ссылки
- ^ Kobayashi, S. (2002). "Каталитические энантиоселективные реакции аза-Дильса-Альдера". В Kobayashi, S.; Jørgensen, KA (ред.). Реакции циклоприсоединения в органическом синтезе . John Wiley & Sons . стр. 187–210. ISBN 9783527301591.
- ^ Whiting, A.; Windsor, CM (1998). «Что заставляет нейтральный иминодиенофил подвергаться термической, некатализируемой реакции Дильса-Альдера?». Tetrahedron . 54 (22): 6035. doi :10.1016/S0040-4020(98)00284-1.
- ^ Hermitage, S.; Jay, DA; Whiting, A. (2002). «Доказательства несогласованного \4+2]-циклоприсоединения N-арилиминов при их действии как диенофилов, так и диенов в условиях катализа кислотой Льюиса». Tetrahedron Lett . 43 (52): 9633. doi :10.1016/S0040-4039(02)02392-4.
- ^ Corey, EJ; Yuen, P.-W. (1989). "Короткий стереоспецифический путь к хиральным транс-2,6-дизамещенным хинуклидинам". Tetrahedron Lett . 30 (43): 5825. doi :10.1016/S0040-4039(01)93481-1.
- ^ Вальдманн, Х. (1989). «Асимметрия Hetero-Diels-Alder-Reaktionen in wäßriger Lösung unter Verwendung von Aminosäureestern als chiralen Auxiliaren». Либигс Анн. Хим . 1989 (3): 231–238. дои : 10.1002/jlac.198919890145.
- ^ Хедберг, К.; Пинхо, П.; Рот, П.; Андерссон, П.Г. (2000). «Реакция Дильса-Альдера гетероциклических иминовых диенофилов». J. Org. Chem . 65 (9): 2810–2. doi :10.1021/jo9916683. PMID 10808461.
- ^ Ишимару, К.; Ватанабе, К.; Ямамото, И.; Акиба, К.-И. (1994). "Стереоконтроль в циклоприсоединении типа \4+2] альдимина, полученного из (S)-этиллактата с 2-силокси-1,3-бутадиеном". Synlett . 1994 (7): 495. doi :10.1055/s-1994-22902.
- ^ Прямые каталитические энантиоселективные реакции Аза-Дильса-Альдера Хенрик Сунден, Исмаил Ибрагим, Ларс Эрикссон, Армандо Кордова Angewandte Chemie International Edition 4877 2005 Аннотация
- ^ Грико, П. А.; Ларсен, С. Д. (1990). "N-бензил-2-азанорборнен". Органические синтезы . 68 : 206. doi :10.15227/orgsyn.068.0206.
- ^ Шрейдер, Т.; Стеглич, В. (1990). «Фосфорный аналог аминозаурена IV.1 Синтез 1-аминофосфонаурен в результате реакции Дильса-Альдера на (N-ацилиминометил)фосфонсауредиэтилестерн». Синтез . 1990 (12): 1153. doi :10.1055/s-1990-27122.
- ^ Кроу, GR; Пюн, К.; Родебо, Р.; Мараковский, Дж. (1974). «Гетеродиенофилы-В». Тетраэдр . 30 (17): 2977. doi :10.1016/S0040-4020(01)97542-8.
- ^ Беннетт, Д.М.; Окамото, И.; Данхайзер, Р.Л. (1999). «Гетеро 4 + 2 циклоприсоединения (триалкилсилил)винилкетенов. Синтез альфа, бета-ненасыщенных дельта-валеролактонов и -лактамов». Org. Lett . 1 (4): 641–4. doi :10.1021/ol9907217. PMID 10823193.
- ^ Регас, Д.; Афонсо, М.М.; Родригес, М.Л.; Паленсуэла, JA (2003). «Синтез октагидрохинолинов посредством реакции винилалленов и иминов, катализируемой кислотой Льюиса». J. Org. Chem . 68 (20): 7845–52. doi :10.1021/jo034480z. PMID 14510565.
- ^ Weinreb, Steven M.; Scola, Paul M. (1989). «N-ацилимины и родственные гетеродиены в реакциях [4+2]-циклоприсоединения». Chemical Reviews . 89 (7): 1525–1534. doi :10.1021/cr00097a008.
- ^ Хан, Г.; ЛаПорт, Миннесота; Фолмер, Джей-Джей; Вернер, К.М.; Вайнреб, С.М. (2000). «Полный синтез алкалоидов Securinega (+)-14,15-дигидронорсекуринина, (-)-норсекуринина и филлантина». Дж. Орг. Хим . 65 (20): 6293–306. дои : 10.1021/jo000260z. ПМИД 11052071.