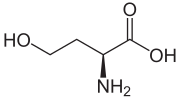
гомосерин
 | |
 | |
| Имена | |
|---|---|
| Название ИЮПАК ( S )-2-амино-4-гидроксибутановая кислота | |
| Идентификаторы | |
3D модель ( JSmol ) |
|
| ХЭБИ | |
| ChEMBL | |
| ChemSpider | |
| Информационная карта ECHA | 100.010.538 |
| Номер ЕС |
|
CID PubChem |
|
| УНИИ | |
Панель инструментов CompTox ( EPA ) |
|
| |
| |
| Характеристики | |
| С4Н9НО3 | |
| Молярная масса | 119,12 г/моль |
| Температура плавления | 203 °C (разлагается) |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |
Гомосерин (также называемый изотреонином) — это α- аминокислота с химической формулой HO 2 CCH(NH 2 )CH 2 CH 2 OH. L -Гомосерин не является одной из распространенных аминокислот, кодируемых ДНК. Он отличается от протеиногенной аминокислоты серина вставкой дополнительной единицы -CH 2 - в основную цепь. Гомосерин, или его лактонная форма, является продуктом расщепления пептида бромцианом путем деградации метионина .
Гомосерин является промежуточным продуктом в биосинтезе трех незаменимых аминокислот : метионина , треонина ( изомер гомосерина) и изолейцина . [1] Его полный биосинтетический путь включает гликолиз , цикл трикарбоновых кислот (ЦТК) или лимонной кислоты (цикл Кребса) и метаболический путь аспартата. Он образуется путем двух восстановлений аспарагиновой кислоты через посредничество аспартатполуальдегида. [2] В частности, фермент гомосериндегидрогеназа в сочетании с НАДФН катализирует обратимую реакцию, которая взаимопревращает L -аспартат-4-полуальдегид в L -гомосерин. Затем два других фермента, гомосеринкиназа и гомосерин O-сукцинилтрансфераза, используют гомосерин в качестве субстрата и производят фосфогомосерин и O -сукцинилгомосерин соответственно. [3]
Приложения
В коммерческих целях гомосерин может служить предшественником синтеза изобутанола и 1,4-бутандиола . [4] Очищенный гомосерин используется в структурных исследованиях ферментов. [5] Кроме того, гомосерин сыграл важную роль в исследованиях по выяснению синтеза пептидов и синтеза протеогликановых гликопептидов. [6] Бактериальные клеточные линии могут производить большое количество этой аминокислоты. [3] [4]
Биосинтез
Гомосерин производится из аспартата через аспартат-4-полуальдегид, который производится из β-фосфоаспартата. Под действием гомосериндегидрогеназ полуальдегид преобразуется в гомосерин. [7]

L -гомосерин является субстратом для гомосеринкиназы , дающей фосфогомосерин (гомосерин-фосфат), который преобразуется треонинсинтазой в L - треонин.
Гомосерин преобразуется в O -сукцинилгомосерин с помощью гомосерин-O-сукцинилтрансферазы , предшественника L -метионина. [8]
Гомосерин аллостерически ингибирует аспартаткиназу и глутаматдегидрогеназу . [3] Глутаматдегидрогеназа обратимо преобразует глутамат в α-кетоглутарат , а α-кетоглутарат преобразуется в оксалоацетат через лимонный цикл. Треонин действует как еще один аллостерический ингибитор аспартаткиназы и гомосериндегидрогеназы, но он является конкурентным ингибитором гомосеринкиназы. [8]
Ссылки
- ^ Танака М., Киши Т., Киносита С. (сентябрь 1961 г.). «Исследования синтеза l-аминокислот: часть III. Синтез l-гомосерина из l-аспарагиновой кислоты». Сельскохозяйственная и биологическая химия . 25 (9): 678–679. doi :10.1080/00021369.1961.10857862. ISSN 0002-1369.
- ^ Берг, Дж. М.; Страйер, Л. и др. (2002), Биохимия . У. Х. Фриман. ISBN 0-7167-4684-0
- ^ abc Liu P, Zhang B, Yao ZH, Liu ZQ, Zheng YG (октябрь 2020 г.). Zhou NY (ред.). «Мультиплексное проектирование метаболической сети для производства l-гомосерина в Escherichia coli». Прикладная и экологическая микробиология . 86 (20). Bibcode : 2020ApEnM..86E1477L. doi : 10.1128/AEM.01477-20. PMC 7531971. PMID 32801175 .
- ^ ab Huang JF, Zhang B, Shen ZY, Liu ZQ, Zheng YG (июль 2018 г.). «Метаболическая инженерия E. coli для производства O-сукцинил-l-гомосерина с высоким выходом». 3 Biotech . 8 (7): 310. doi :10.1007/s13205-018-1332-x. PMC 6037649 . PMID 30002999.
- ^ Akai S, Ikushiro H, Sawai T, Yano T, Kamiya N, Miyahara I (февраль 2019 г.). «Кристаллическая структура гомосериндегидрогеназы в комплексе с l-гомосерином и НАДФН в закрытой форме». Журнал биохимии . 165 (2): 185–195. doi :10.1093/jb/mvy094. PMID 30423116.
- ^ Yang W, Ramadan S, Yang B, Yoshida K, Huang X (декабрь 2016 г.). «Гомосерин как предшественник аспарагиновой кислоты для синтеза протеогликанового гликопептида, содержащего аспарагиновую кислоту и сульфатированную гликановую цепь». Журнал органической химии . 81 (23): 12052–12059. doi :10.1021/acs.joc.6b02441. PMC 5215661. PMID 27809505 .
- ^ Виола, Рональд Э. (2001). «Центральные ферменты семейства аспартата биосинтеза аминокислот». Accounts of Chemical Research . 34 (5): 339–349. doi :10.1021/ar000057q. PMID 11352712.
- ^ ab Petit C, Kim Y, Lee SK, Brown J, Larsen E, Ronning DR и др. (январь 2018 г.). «Уменьшение ингибирования обратной связи в гомосериновой киназе (ThrB) Corynebacterium glutamicum усиливает биосинтез l-треонина». ACS Omega . 3 (1): 1178–1186. doi :10.1021/acsomega.7b01597. PMC 6045374 . PMID 30023797.



