Глутамат-префенатаминотрансфераза
| Глутамат-префенатаминотрансфераза | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Идентификаторы | |||||||||
| Номер ЕС | 2.6.1.79 | ||||||||
| Базы данных | |||||||||
| ИнтЭнз | IntEnz вид | ||||||||
| БРЕНДА | запись BRENDA | ||||||||
| ExPASy | NiceZyme вид | ||||||||
| КЕГГ | запись KEGG | ||||||||
| МетаЦик | метаболический путь | ||||||||
| ПРИАМ | профиль | ||||||||
| Структуры PDB | RCSB PDB PDBe PDBsum | ||||||||
| |||||||||
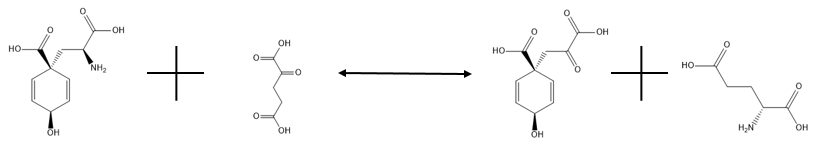
В энзимологии глутамат-префенатаминотрансфераза ( EC 2.6.1.79, также известная как префенаттрансаминаза, PAT и L - глутамат:префенатаминотрансфераза) представляет собой фермент , катализирующий химическую реакцию
- L-арогенат + префенат 2-оксоглутарата + L-глутамат
Таким образом, два субстрата этого фермента — L-арогенат и 2-оксоглутарат , тогда как два его продукта — префенат и L-глутамат . Однако у большинства видов растений, использующих этот фермент, левая сторона реакции является сильно предпочтительной. Поэтому глутамат используется в качестве донора аминогруппы для превращения префената в арогенат.
Номенклатура
Этот фермент принадлежит к семейству трансфераз , а именно трансаминаз , которые переносят азотистые группы. Систематическое название этого класса ферментов — L-арогенат:2-оксоглутаратаминотрансфераза . Другие общеупотребительные названия включают префенаттрансаминазу (неоднозначно) , PAT (неоднозначно) и L-глутамат:префенатаминотрансферазу . Он работает в пути биосинтеза фенилаланина и тирозина .
Распространение видов
Ген, кодирующий этот фермент, недавно был идентифицирован у различных видов растений и микроорганизмов, что означает, что все гены в этом пути теперь идентифицированы и учтены. Этот путь встречается у многих различных видов растений. Поскольку фенилаланин является незаменимой аминокислотой , люди (и другие животные) утратили способность производить его самостоятельно и поэтому должны получать его из своего рациона. Таким образом, активность этого фермента у различных видов растений также влияет на выживание животных. У этих животных тирозин синтезируется из фенилаланина с помощью фермента фенилаланингидроксилазы , тогда как у растений есть свой собственный метод синтеза тирозина.
Функция
Глутамат-префенатаминотрансфераза катализирует обратимую реакцию, показанную ниже:

и его основная цель — преобразовать префенат в арогенат через трансаминирование, используя глутамат в качестве донора аминогруппы. Как уже говорилось ранее, левая сторона реакции является сильно предпочтительной. Это необходимый процесс для любого организма, которому необходимо преобразовать арогенат в фенилаланин или тирозин, поскольку арогенат является промежуточным продуктом в реакциях, синтезирующих эти аминокислоты, альтернативный путь к тому, который включает фенилпируват и гидроксифенилпируват. В отсутствие глутамата аспартат может выступать в качестве донора аминогруппы в реакции без необходимости в другом ферменте, но эта реакция протекает медленнее. Подробности активности этого фермента все еще остаются загадкой.
Структура
О структуре глутамат-префенатаминотрансферазы известно немного. Однако некоторые данные указывают на то, что фермент может иметь структуру субъединицы α2 - β2 .
Ссылки и дополнительная литература
- Bonner CA, Jensen RA (1985). "Новые особенности префенатаминотрансферазы из клеточных культур Nicotiana silvestris". Arch. Biochem. Biophys . 238 (1): 237–46. CiteSeerX 10.1.1.410.8500 . doi :10.1016/0003-9861(85)90161-4. PMID 3985619.
- Боннер С, Дженсен Р (1987). "Префенатаминотрансфераза". Метаболизм ароматических аминокислот и аминов . Методы в энзимологии. Т. 142. С. 479–87. doi :10.1016/S0076-6879(87)42059-4. ISBN 9780121820428. PMID 3298985.
- Siehl DL, Connelly JA, Conn EE (1986). «Биосинтез тирозина в Sorghum bicolor: характеристики префенатаминотрансферазы». Z. Naturforsch. C . 41 (1–2): 79–86. doi : 10.1515/znc-1986-1-213 . PMID 2939644. S2CID 9370252.
- Graindorge M, Giustini C, Jacomin AC, Kraut A, Curien G, Matringe M (2010). «Идентификация гена растения, кодирующего глутамат/аспартат-префенатаминотрансферазу: последний бездомный фермент биосинтеза ароматических аминокислот». FEBS Lett . 584 (20): 4357–60. doi :10.1016/j.febslet.2010.09.037. PMID 20883697. S2CID 13591470.
- Maeda H, Yoo H, Dudareva N (2011). «Префенатаминотрансфераза направляет биосинтез фенилаланина в растениях через арогенат». Nat. Chem. Biol . 7 (1): 19–21. doi :10.1038/nchembio.485. PMID 21102469.
- De-Eknamkul W, Ellis BE (1988). «Очистка и характеристика префенатаминотрансферазы из клеточных культур Anchusa officinalis». Arch. Biochem. Biophys . 267 (1): 87–94. doi :10.1016/0003-9861(88)90011-2. PMID 3196038.
- Dal Cin V, Tieman DM, Tohge T, McQuinn R, de Vos RC, Osorio S, Schmelz EA, Taylor MG, Smits-Kroon MT, Schuurink RC, Haring MA, Giovannoni J, Fernie AR, Klee HJ (2011). «Идентификация генов в метаболическом пути фенилаланина с помощью эктопической экспрессии фактора транскрипции MYB в плодах томата». Plant Cell . 23 (7): 2738–53. doi :10.1105/tpc.111.086975. PMC 3226207 . PMID 21750236.
- Graindorge M, Giustini C, Kraut A, Moyet L, Curien G, Matringe M (2014). «Три различных класса аминотрансфераз развили функциональность префенатаминотрансферазы в арогенат-компетентных микроорганизмах». J. Biol. Chem . 289 (6): 3198–208. doi : 10.1074/jbc.M113.486480 . PMC 3916524. PMID 24302739 .
- "Orthology: K15849". Интегрированная система поиска баз данных DBGET . Получено 25 октября 2020 г.