Габакулин
 | |
| Имена | |
|---|---|
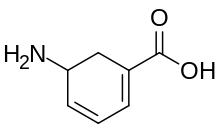
| Название ИЮПАК 5-Аминоциклогекса-1,3-диен-1-карбоновая кислота | |
| Идентификаторы | |
3D модель ( JSmol ) |
|
| ChemSpider | |
CID PubChem |
|
| УНИИ | |
Панель инструментов CompTox ( EPA ) |
|
| |
| |
| Характеристики | |
| С7Н9НО2 | |
| Молярная масса | 139,154 г·моль −1 |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |
Габакулин — это встречающийся в природе нейротоксин, впервые выделенный из бактерий Streptomyces toyacaensis , [1] который действует как мощный и необратимый ингибитор ГАМК-трансаминазы , [2] [3] а также ингибитор обратного захвата ГАМК . [4] [5] Габакулин также известен как гидрохлорид 3-амино-2,3-дигидробензойной кислоты [6] и 5-аминоциклогекса-1,3 диенилкарбоновая кислота. [7] Габакулин повышает уровень ГАМК в мозге и оказывает влияние на судороги у мышей. [7]
Механизм действия
Габакулин включает в себя сопоставимую структуру с ГАМК и дигидробензольное кольцо. Эта сопоставимая структура ГАМК используется для того, чтобы иметь возможность занять место ГАМК на первых этапах трансаминирования, включая трансальдиминирование и 1,3-прототрофный сдвиг в пиридоксамин имин. [8] После этого протон из дигидробензольного кольца отщепляется ферментативным основанием, в результате чего кольцо становится ароматическим. [8] Энергия ароматической стабилизации ароматического кольца является причиной того, что эта реакция является необратимой, в результате чего комплекс не реагирует далее. [8]
Доклинические исследования
Исследования на животных для определения влияния габакулина на уровень ГАМК в мозге были широко проведены примерно в 1970-х годах. [9] Эти исследования in vivo в основном включали использование мышей, которым внутривенно вводили этот препарат. Каждое из этих исследований пришло к выводу, что габакулин имеет большой потенциал для повышения уровня ГАМК в мозге этих мышей в зависимости от времени. [7] Наряду с определением влияния уровня ГАМК, исследования in vivo проводились для изучения способности габакулина подавлять судороги у мышей. Результаты показали, что габакулин оказывал четкий противосудорожный эффект против судорог, вызванных высокими дозами химиоконвульсантов или электрошоком. [10] Токсичность этого соединения также была исследована с использованием моделей животных мышей. Это исследование показало, что в противосудорожных дозах габакулин чрезвычайно эффективен и токсичен по сравнению с другими ингибиторами ГАМК-трансаминазы, с ED 50 35 мг/кг и LD 50 86 мг/кг. [10] Из-за этого потенциального летального эффекта было доказано, что габакулин слишком токсичен для использования в качестве лекарственного средства, однако [8] его все еще можно использовать в качестве соединения для изменения уровней ГАМК в исследованиях экспериментальной эпилепсии . [10]
Регулирование
Габакулин не был одобрен FDA как фармацевтическое вещество; однако его можно использовать как химическое соединение только в исследовательских целях. [11] Это соединение не считается опасным веществом согласно OSHA 29 CFR 1910.1200. [6]
Ссылки
- ^ Kobayashi K, Miyazawa S, Endo A (апрель 1977). «Выделение и ингибирующая активность габакулина, нового мощного ингибитора гамма-аминобутиратаминотрансферазы, продуцируемой Streptomyces». FEBS Letters . 76 (2): 207– 10. doi : 10.1016/0014-5793(77)80153-1 . PMID 862902.
- ^ Rando RR (октябрь 1977). «Механизм необратимого ингибирования трансаминазы гамма-аминомасляной кислоты-альфа-кетоглутаровой кислоты нейротоксином габакулином». Биохимия . 16 (21): 4604– 10. doi :10.1021/bi00640a012. PMID 410442.
- ^ Irifune M, Katayama S, Takarada T и др. (декабрь 2007 г.). «MK-801 усиливает вызванную габакулином потерю рефлекса выпрямления у мышей, но не неподвижность». Can J Anaesth . 54 (12): 998– 1005. doi : 10.1007/BF03016634 . PMID 18056209.
- ^ Аллан РД, Джонстон ГАР, Твитчин Б. Влияние габакулина на поглощение, связывание и метаболизм ГАМК. Neuroscience Letters . 1977;4:51-54.
- ^ Høg S, Greenwood JR, Madsen KB, Larsson OM, Frølund B, Schousboe A, Krogsgaard-Larsen P, Clausen RP (2006). «Структурно-активностные связи селективных ингибиторов захвата ГАМК». Current Topics in Medicinal Chemistry . 6 (17): 1861– 82. doi :10.2174/156802606778249801. PMID 17017962. Архивировано из оригинала 2013-04-14.
- ^ ab Santa Cruz Biotechnology, Inc. "Паспорт безопасности материала габакулина" . Получено 5 декабря 2014 г.
- ^ abc Муцуи, Йошики; Дегучи, Такэхико (1977). «Влияние габакулина, нового мощного ингибитора гамма-аминобутират-трансаминазы, на содержание гамма-аминобутирата в мозге и судороги у мышей». Науки о жизни . 20 (7): 1291–1296 . doi :10.1016/0024-3205(77)90505-7. ПМИД 850479.
- ^ abcd Фрей, Перри; Эйблс, Роберт; Хегеман, Адриан (29 декабря 2006 г.). Механизм ферментативной реакции. Нью-Йорк: Oxford University Press Inc., стр. 262–263 . ISBN 0195122585. Получено 4 декабря 2014 г.
- ^ Рэндо, Роберт; Бангертер, Ф. В. (13 мая 1977 г.). «Ингибирование ГАМК-трансаминазы габакулином in vivo». Biochemical and Biophysical Research Communications . 76 (4): 1276– 1281. doi :10.1016/0006-291X(77)90993-7. PMID 901477.
- ^ abc Loscher, Wolfgang (1980). «Сравнительное исследование фармакологии ингибиторов метаболизма ГАМК». Naunyn-Schmiedeberg's Arch. Pharmacol . 315 (2): 119– 128. doi :10.1007/BF00499254. PMID 6782493. S2CID 26483388.
- ^ PubChem. "Gabaculine". pubchem.ncbi.nlm.nih.gov/ . Национальный центр биотехнологической информации . Получено 9 декабря 2014 г. .


