Терипаратид
 | |
| Клинические данные | |
|---|---|
| Торговые наименования | Фортео, Форстео |
| Биоаналоги | Бонсити, [1] Каулив, [2] Ливогива, [3] Оснуво, [4] Кутавина, [5] Сондельбай, [6] Терибоне, [7] |
| AHFS / Drugs.com | Монография |
| МедлайнПлюс | а603018 |
| Данные лицензии | |
Категория беременности |
|
| Пути введения | Подкожный |
| код АТС |
|
| Правовой статус | |
| Правовой статус |
|
| Фармакокинетические данные | |
| Биодоступность | 95% |
| Метаболизм | Печень (неспецифический протеолиз) |
| Период полувыведения | Подкожно: 1 час |
| Выделение | Почки (метаболиты) |
| Идентификаторы | |
| Номер CAS | |
| CID PubChem |
|
| ИУФАР/БПС |
|
| DrugBank | |
| ChemSpider | |
| УНИИ |
|
| КЕГГ | |
| ChEMBL |
|
| Информационная карта ECHA | 100.168.733 |
| Химические и физические данные | |
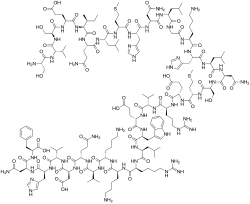
| Формула | С 181 Н 291 Н 55 О 51 Ю 2 |
| Молярная масса | 4 117 .77 г·моль −1 |
| 3D модель ( JSmol ) |
|
| |
| |
 Н Н И (что это?) (проверить) И (что это?) (проверить) | |
Терипаратид , продаваемый под торговой маркой Фортео , представляет собой форму паратиреоидного гормона (ПТГ), состоящую из первых ( N-концевых ) 34 аминокислот , которые являются биоактивной частью гормона. [13] Это эффективный анаболический (стимулирующий формирование костной ткани) агент [15], используемый при лечении некоторых форм остеопороза . [13] [16] Терипаратид представляет собой рекомбинантный аналог человеческого паратиреоидного гормона (ПТГ 1-34). [13] Он имеет последовательность, идентичную 34 N-концевым аминокислотам 84-аминокислотного человеческого паратиреоидного гормона. [13]
Медицинское применение
Терипаратид показан для лечения женщин в постменопаузе с остеопорозом; [13] для увеличения костной массы у мужчин с первичным или гипогонадным остеопорозом; [13] и лечения мужчин и женщин с остеопорозом, связанным с постоянной системной терапией глюкокортикоидами. [13]
Он эффективен для роста костей (например, увеличение плотности костей позвоночника на 8% через год) [17] и снижения риска переломов вследствие хрупкости. [18] [19]
Терипаратид снижает риск перелома бедра более чем наполовину, но не снижает риск перелома руки или запястья. [20]
Противопоказания
Терипаратид противопоказан лицам с открытыми эпифизами, метаболическими заболеваниями костей, болезнью Педжета костей , метастазами в костях, злокачественными новообразованиями скелета в анамнезе или предшествующей внешней лучевой терапией или имплантационной лучевой терапией, затрагивающей скелет. [13] В исследованиях на животных и в одном отчете о клиническом случае с человеком было обнаружено, что он потенциально связан с развитием остеосаркомы у испытуемых после более чем двух лет использования. [21]
Побочные эффекты
Побочные эффекты терипаратида включают головную боль, тошноту, головокружение и боль в конечностях. [18] Терипаратид имеет теоретический риск остеосаркомы , который был обнаружен в исследованиях на крысах, но не подтвержден у людей. [15] Это может быть связано с тем, что, в отличие от людей, кости крыс растут в течение всей их жизни. [15] Опухоли, обнаруженные в исследованиях на крысах, были расположены на конце костей, которые выросли после начала инъекций. [22] После девяти лет на рынке было зарегистрировано только два случая остеосаркомы. [17] Этот риск был расценен FDA как «крайне редкий» (1 на 100 000 человек) [18] и лишь немного превышает заболеваемость среди населения старше 60 лет (0,4 на 100 000). [18]

Механизм действия
Терипаратид — это часть человеческого паратиреоидного гормона (ПТГ), аминокислотная последовательность с 1 по 34, полной молекулы (содержащей 84 аминокислоты). Эндогенный ПТГ является основным регулятором метаболизма кальция и фосфата в костях и почках. ПТГ увеличивает уровень кальция в сыворотке, частично достигая этого за счет увеличения резорбции костей. Таким образом, хронически повышенный ПТГ истощает запасы костей. Однако периодическое воздействие ПТГ активирует остеобласты больше, чем остеокласты. Таким образом, инъекции терипаратида один раз в день имеют чистый эффект стимуляции образования новой кости, что приводит к увеличению минеральной плотности костей. [24] [25] [26]
Общество и культура
Правовой статус
Терипаратид был одобрен для медицинского применения в Соединенных Штатах в 1987 году. [13] [23] Терипаратид (Фортео) был одобрен FDA в ноябре 2002 года для лечения остеопороза у мужчин и женщин в постменопаузе , которые подвержены высокому риску переломов. [27] В октябре 2019 года FDA США одобрило рекомбинантный продукт терипаратида под торговой маркой Bonsity. [1]
Биоаналоги
Рекомбинантный терипаратид продается Eli Lilly and Company под торговыми марками Forteo и Forsteo. В июне 2020 года Alvogen, Inc, партнер Pfenex Inc. по коммерциализации, выпустила инъекцию терипаратида (Bonsity) в США. Инъекция терипаратида была разработана Pfenex Inc и одобрена Управлением по контролю за продуктами и лекарствами США (FDA) в октябре 2019 года. [1] Инъекция терипаратида фармацевтически эквивалентна Фортео (то есть имеет тот же активный ингредиент в той же силе, лекарственной форме и способе введения) и, как было показано, имеет сопоставимую биодоступность. Эти характеристики позволили продукту быть одобренным в соответствии с 505(b)(2) NDA, для которого Фортео был референтным препаратом. Он может стать более дешевым вариантом терипаратида для увеличения плотности костной ткани у пациентов с высоким риском переломов и одобрен FDA для тех же показаний, что и Фортео, что означает, что его можно использовать для тех же пациентов, что и Фортео, включая новых пациентов и тех, кто в настоящее время реагирует на лечение. [28]
Терипаратид был одобрен для медицинского применения в Европейском союзе в июне 2003 года. [14] Синтетический терипаратид от Teva Generics был разрешен для продажи в Европейском союзе. [29] Биоподобный продукт от Gedeon Richter plc был разрешен в Европейском союзе. [30] В октябре 2019 года FDA США одобрило рекомбинантный продукт терипаратида. [1]
В июне 2020 года Комитет по лекарственным средствам для человека (CHMP) Европейского агентства по лекарственным средствам (EMA) рекомендовал одобрить биоаналогичные препараты Кутавина и Ливогива. [5] [3] Кутавина и Ливогива были одобрены для медицинского применения в Европейском союзе в августе 2020 года. [5] [3]
Препарат Оснуво был одобрен для медицинского применения в Канаде в январе 2020 года. [4]
Зондельбай был одобрен для медицинского применения в Европейском Союзе в марте 2022 года. [6] [31]
10 ноября 2022 года Комитет по лекарственным средствам для человека (CHMP) принял положительное заключение, рекомендовав выдать разрешение на продажу лекарственного средства Kauliv, предназначенного для лечения остеопороза. [32] Заявителем на данное лекарственное средство является Strides Pharma Cyprus. [32] Kauliv был одобрен для медицинского применения в Европейском союзе в феврале 2023 года. [33] [2]
Исследовать
Терипаратид проходит клиническое исследование с золедроновой кислотой в качестве средства для лечения несовершенного остеогенеза с целью снижения риска переломов костей. [34]
Комбинированный терипаратид и деносумаб
Комбинированное лечение терипаратидом и деносумабом увеличило МПКТ больше, чем каждый из этих препаратов по отдельности, и больше, чем сообщалось при использовании одобренных методов лечения. Таким образом, комбинированное лечение может быть полезным для лечения пациентов с высоким риском переломов за счет увеличения МПКТ. Однако нет никаких доказательств снижения частоты переломов у пациентов, принимающих комбинацию терипаратида и деносумаба. Первое такое исследование было опубликовано Ледером и соавторами в журнале Lancet в 2013 году, а дополнительные данные впоследствии были опубликованы в JCEM в исследовании женщин с постменопаузальным остеопорозом, демонстрирующем большее увеличение минеральной плотности костной ткани в позвоночнике и бедре при комбинированной терапии по сравнению с каждым из этих препаратов по отдельности. [35] [36]
Ссылки
- ^ abcd "Пакет одобрения препарата: Bonsity". Управление по контролю за продуктами и лекарствами США (FDA) . 26 февраля 2020 г. Архивировано из оригинала 2 апреля 2021 г. Получено 14 сентября 2020 г.
- ^ abc "Kauliv EPAR". Европейское агентство по лекарственным средствам (EMA) . 18 июля 2022 г. Архивировано из оригинала 9 марта 2023 г. Получено 8 марта 2023 г.Текст был скопирован из этого источника, авторские права на который принадлежат Европейскому агентству по лекарственным средствам. Воспроизведение разрешено при условии указания источника.
- ^ abc "Livogiva EPAR". Европейское агентство по лекарственным средствам (EMA) . 26 мая 2020 г. Архивировано из оригинала 30 января 2021 г. Получено 25 января 2021 г.
- ^ ab "Summary Basis of Decision (SBD) for Osnuvo". Health Canada . 23 октября 2014 г. Архивировано из оригинала 30 мая 2022 г. Получено 29 мая 2022 г.
- ^ abc "Qutavina EPAR". Европейское агентство по лекарственным средствам (EMA) . 26 мая 2020 г. Архивировано из оригинала 30 января 2021 г. Получено 25 января 2021 г.
- ^ abc "Sondelbay EPAR". Европейское агентство по лекарственным средствам . 24 января 2022 г. Архивировано из оригинала 4 марта 2023 г. Получено 3 марта 2023 г.
- ↑ Лисбет Тристан де Бре (18 сентября 2018 г.). «Nota de Seguridad de Medicamentos» (PDF) . Панама: Национальное управление фармацевтики и дрогаса. Архивировано (PDF) из оригинала 4 декабря 2020 года . Проверено 30 сентября 2018 г.
- ^ "Terrosa". Therapeutic Goods Administration (TGA) . 26 мая 2022 г. Архивировано из оригинала 30 сентября 2022 г. Получено 7 июля 2024 г.
- ^ "Использование терипаратида во время беременности". Drugs.com . 25 ноября 2019 г. Архивировано из оригинала 27 октября 2020 г. Получено 14 сентября 2020 г.
- ^ «Список всех препаратов с предупреждениями в черном ящике, составленный FDA (используйте ссылки «Загрузить полные результаты» и «Просмотреть запрос»). nctr-crs.fda.gov . FDA . Получено 22 октября 2023 г. .
- ^ "Forteo teriparatide (rbe) 250 микрограмм раствор для инъекционного картриджа, Eli Lilly Australia Pty Ltd, CON-1240". Therapeutic Goods Administration (TGA) . 17 июня 2024 г. Архивировано из оригинала 17 июня 2024 г. Получено 17 июня 2024 г.
- ^ "Ritosa teriparatide 250 мкг/мл раствор для инъекций, предварительно заполненный картридж (408423)". Therapeutic Goods Administration (TGA) . 3 мая 2024 г. Архивировано из оригинала 17 июня 2024 г. Получено 17 июня 2024 г.
- ^ abcdefghij "Forteo-teriparatide injection, solution". DailyMed . 29 апреля 2021 г. Архивировано из оригинала 19 января 2022 г. Получено 8 марта 2023 г.
- ^ ab "Forsteo EPAR". Европейское агентство по лекарственным средствам (EMA) . 17 сентября 2018 г. Архивировано из оригинала 27 июня 2020 г. Получено 26 июня 2020 г.
- ^ abc Riek AE , Towler DA (2011). «Фармакологическое лечение остеопороза». Missouri Medicine . 108 (2): 118–23 . PMC 3597219. PMID 21568234.
- ^ Сааг К.Г., Шейн Э., Боонен С., Марин Ф., Донли Д.В., Тейлор К.А. и др. (ноябрь 2007 г.). «Терипаратид или алендронат при остеопорозе, вызванном глюкокортикоидами». Медицинский журнал Новой Англии . 357 (20): 2028– 39. doi : 10.1056/NEJMoa071408 . ПМИД 18003959.
- ^ ab Kawai M, Mödder UI, Khosla S, Rosen CJ (февраль 2011 г.). «Возникающие терапевтические возможности для восстановления скелета». Nature Reviews. Drug Discovery . 10 (2): 141– 56. doi :10.1038/nrd3299. PMC 3135105. PMID 21283108 .
- ^ abcd Rizzoli R, Reginster JY, Boonen S, Bréart G, Diez-Perez A, Felsenberg D и др. (август 2011 г.). «Побочные реакции и лекарственные взаимодействия при лечении женщин с постменопаузальным остеопорозом». Calcified Tissue International . 89 (2): 91– 104. doi :10.1007/s00223-011-9499-8. PMC 3135835. PMID 21637997 .
- ^ Murad MH, Drake MT, Mullan RJ, Mauck KF, Stuart LM, Lane MA и др. (июнь 2012 г.). «Клинический обзор. Сравнительная эффективность медикаментозного лечения для предотвращения переломов вследствие хрупкости: систематический обзор и сетевой метаанализ». Журнал клинической эндокринологии и метаболизма . 97 (6): 1871– 80. doi : 10.1210/jc.2011-3060 . PMID 22466336.
- ^ Диес-Перес А., Марин Ф., Эриксен Э.Ф., Кендлер Д.Л., Креге Дж.Х., Дельгадо-Родригес М. (март 2019 г.). «Влияние терипаратида на переломы бедра и верхних конечностей у пациентов с остеопорозом: систематический обзор и метаанализ». Кость . 120 : 1–8 . doi : 10.1016/j.bone.2018.09.020 . hdl : 10230/36878 . PMID 30268814.
- ^ Harper KD, Krege JH, Marcus R, Mitlak BH (февраль 2007 г.). «Остеосаркома и терипаратид?». Journal of Bone and Mineral Research . 22 (2): 334. doi : 10.1359/jbmr.061111 . PMID 17129179. S2CID 36420876.
- ^ "Forteo". drugs.com . Архивировано из оригинала 15 июня 2018 . Получено 23 января 2018 .
- ^ ab "Teriparatide injection, solution". DailyMed . 1 ноября 2019 г. Архивировано из оригинала 25 мая 2022 г. Получено 8 марта 2023 г.
- ^ Bauer W, Aub JC, Albright F (январь 1929). «Исследования метаболизма кальция и фосфора: V. Изучение костных трабекул как легкодоступного резервного источника кальция». Журнал экспериментальной медицины . 49 (1): 145– 62. doi :10.1084/jem.49.1.145. PMC 2131520. PMID 19869533 .
- ^ Селье Х (1932). «О стимуляции образования новой кости экстрактом паращитовидной железы и облученным эргостеролом». Эндокринология . 16 (5): 547–558 . doi : 10.1210/endo-16-5-547 .
- ^ Dempster DW, Cosman F , Parisien M, Shen V, Lindsay R (декабрь 1993 г.). «Анаболическое действие паратиреоидного гормона на кости». Endocrine Reviews . 14 (6): 690–709 . doi :10.1210/edrv-14-6-690. PMID 8119233.
- ^ "Пакет одобрения препарата: Фортео [терипаратид (происхождение рДНК)] Инъекция; NDA #021318". Управление по контролю за продуктами и лекарствами США (FDA) . Архивировано из оригинала 31 марта 2021 г. Получено 14 сентября 2020 г.
- ^ "Pfenex объявляет о коммерческом запуске инъекций терипаратида в США" (пресс-релиз). Pfenex Inc. 12 июня 2020 г. Архивировано из оригинала 7 апреля 2021 г. Получено 13 октября 2020 г. – через GlobeNewswire.
- ^ BfArM (8 мая 2017 г.). "ОТЧЕТ ОБ ОЦЕНКЕ ПУБЛИЧНОГО ДЕЙСТВИЯ - Децентрализованная процедура - Терипаратид-ратиофарм 20 мкг / 80 мл, раствор для инъекций" (PDF) . Архивировано (PDF) из оригинала 24 июня 2021 г. . Получено 24 июня 2019 г. .
- ^ "Резюме Европейского публичного оценочного отчета (EPAR) для Terrosa". 17 сентября 2018 г. Архивировано из оригинала 14 августа 2019 г. Получено 14 августа 2019 г.
- ^ "Информация о продукте Sondelbay". Единый реестр лекарственных средств . Архивировано из оригинала 4 марта 2023 г. Получено 3 марта 2023 г.
- ^ ab "Kauliv: Pending EC decision". Европейское агентство по лекарственным средствам . 11 ноября 2022 г. Архивировано из оригинала 31 декабря 2022 г. Получено 3 марта 2023 г.Текст был скопирован из этого источника, авторские права на который принадлежат Европейскому агентству по лекарственным средствам. Воспроизведение разрешено при условии указания источника.
- ^ "Информация о продукте Kauliv". Единый реестр лекарственных средств . Архивировано из оригинала 27 января 2023 года . Получено 3 марта 2023 года .
- ^ "Новое исследование для людей с болезнью хрупких костей". BBC News . 16 января 2017 г. Архивировано из оригинала 31 августа 2021 г. Получено 31 августа 2021 г.
- ^ Leder BZ, Tsai JN, Uihlein AV, Burnett-Bowie SA, Zhu Y, Foley K и др. (Май 2014 г.). «Два года применения деносумаба и терипаратида у женщин в постменопаузе с остеопорозом (расширенное исследование DATA): рандомизированное контролируемое исследование». Журнал клинической эндокринологии и метаболизма . 99 (5): 1694– 1700. doi : 10.1210 /jc.2013-4440. PMC 4010689. PMID 24517156.
- ^ Tsai JN, Uihlein AV, Lee H, Kumbhani R, Siwila-Sackman E, McKay EA и др. (Июль 2013 г.). «Терипаратид и деносумаб, по отдельности или в сочетании, у женщин с постменопаузальным остеопорозом: рандомизированное исследование DATA». The Lancet . 382 (9886): 50– 56. doi :10.1016/s0140-6736(13)60856-9. PMC 4083737 . PMID 23683600.
