Нитрат фтора
 | |
 | |
| Имена | |
|---|---|
| Другие имена Нитрил гипофторит | |
| Идентификаторы | |
3D модель ( JSmol ) |
|
| ChemSpider |
|
CID PubChem |
|
| УНИИ |
|
Панель инструментов CompTox ( EPA ) |
|
| |
| |
| Характеристики | |
| Ф Н О 3 | |
| Молярная масса | 81,002 г·моль −1 |
| Плотность | 2,217 г/л [1] |
| Температура плавления | −175 °C (−283,0 °F; 98,1 К) |
| Точка кипения | −46 °C (−51 °F; 227 K) |
| Термохимия | |
Стандартная энтальпия образования (Δ f H ⦵ 298 ) | +10,46 кДж/моль |
| Опасности | |
| Охрана труда и техника безопасности (OHS/OSH): | |
Основные опасности | Взрывоопасный газ |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |
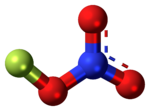
Нитрат фтора — нестабильное производное азотной кислоты с формулой FNO.
3. Он чувствителен к ударам. [1] Из-за своей нестабильности его часто производят из нитрата хлора по мере необходимости [ требуется ссылка ] . Нитрат фтора — инертная молекула, которая, как полагают, играет важную роль в химии атмосферы. [2]
История
В 1935 году профессор Джордж Х. Кэди первым синтезировал нитрат фтора и с тех пор имеет долгую и противоречивую историю. В 1937 году американский химик и биохимик Лайнус Полинг и один из его первых аспирантов, Лоуренс О. Броквей, использовали интенсивности электронной дифракции, чтобы определить структуру связи кислорода и фтора, перпендикулярную плоскости NO2, как неплоскую структуру. Это позже было подтверждено в 1963 и 1966 годах с использованием инфракрасных спектров. [3]
В исследовании 1995 года, проведенном в Университете Тюбингена в Германии, с помощью электронной дифракции было обнаружено, что связь азота и кислорода на удивление длинная, около 150,7 ppm. Эта длина, вероятно, является результатом присутствия электроотрицательных атомов по сравнению с другими подобными структурами, такими как азотная кислота. [3]
Синтез и свойства
Хотя это не до конца изучено, считается, что FNO
3Образуется в результате термомолекулярной рекомбинации FO и NO
2радикалы. Нитрат фтора получают путем перемешивания фтора в газообразной форме, который будет пузыриться через азотную кислоту или твердый KNO3. Из-за чувствительности соединения к ударам, необходимо обращаться с ним с особой осторожностью: [4] [5]
- F2 + HNO3 → FNO3 + HF
- Ф2 + КНО3 → ФНО3 + КФ
Он разлагается в воде с образованием газообразного кислорода , дифторида кислорода , плавиковой кислоты и азотной кислоты. [1]
В нитрате фтора атом кислорода, соединяющий азот и фтор, находится в редкой степени окисления 0 из-за его электроотрицательности, которая ниже, чем у фтора, но выше, чем у азота. Роль электроотрицательности также значительна в структуре нитрата фтора. С помощью анализа электронной дифракции FNO
3Было установлено, что он имеет плоскую структуру с особенно большой длиной связи азота и кислорода. [6]
Нитрат фтора был связан с более высоким потенциалом ионизации из-за центральности фтора. Этот более высокий потенциал ионизации указывает на электронную ионизацию более глубоких орбиталей оболочки. [5]
Приложения
С 1990-х годов нитрат фтора изучался как критический фактор атмосферной химии. Именно в этот период нитрат фтора начал маркироваться как резервуарный вид в атмосфере. [5]
Было установлено, что связь между потенциалом ионизации и наивысшей занятой молекулярной орбиталью (HOMO) в нитрате фтора велика. В исследовании 1996 года исследователи утверждали, что потенциал ионизации HOMO в молекуле является отражением электронодонорных возможностей молекулы, и по мере того, как потенциал ионизации HOMO снижается, электронодонорные возможности молекулы увеличиваются и становятся сильнее. [5]
Несмотря на инертную природу молекулы, исследование 1996 года утверждает, что нитрат фтора может быть наилучшим возможным резервуаром в процессе разрушения озонового слоя. [5]
Ссылки
- ^ abc Ruff, Otto; Kwasnik, Walter (1935). «Фторирование азотной кислоты. Нитроксифторид, NO 3 F». Angewandte Chemie . 48 : 238–240. doi :10.1002/ange.19350481604.
- ^ Дженсен, Джеймс О. (2005-03-07). «Колебательные частоты и структурное определение нитрата фтора». Журнал молекулярной структуры: THEOCHEM . 716 (1): 11–17. doi :10.1016/j.theochem.2004.10.041. ISSN 0166-1280.
- ^ ab Oberhammer, H. (2002-03-13). "Связь NO в ковалентных нитратах и нитритах". Журнал молекулярной структуры . 605 (2): 177–185. doi :10.1016/S0022-2860(01)00766-9. ISSN 0022-2860.
- ^ Эллиотт, Скотт (1983-01-01). "Спектры ультрафиолетового поглощения FNO3 и HOF". Atmospheric Environment . 17 (4): 759–761. doi :10.1016/0004-6981(83)90424-9. ISSN 0004-6981.
- ^ abcde Dianxun, Wang; Peng, Jiang; Qiyuan, Zhang (1996-11-29). "HeI фотоэлектронный спектр (PES) нитрата фтора, FONO2". Chemical Physics Letters . 262 (6): 771–775. doi :10.1016/S0009-2614(96)01154-2. ISSN 0009-2614.
- ^ Каспер, Бернд; Мак, Ханс-Георг; Оберхаммер, Хайнц (1995-04-01). "Структуры некоторых гипофторитов в газовой фазе: FOSF5, FOSO2F, FOClO3 и FONO2". Журнал химии фтора . Доклады, представленные на симпозиуме Американского химического общества - памяти Джорджа Х. Кэди. 71 (2): 215. doi :10.1016/0022-1139(94)06031-G. ISSN 0022-1139.
- Гринвуд, Норман Н.; Эрншоу, Алан (1997). Химия элементов (2-е изд.). Баттерворт-Хайнеманн . ISBN 978-0-08-037941-8.


