Дитионат
| |||
| Имена | |||
|---|---|---|---|
| Название ИЮПАК Дитионат | |||
| Систематическое название ИЮПАК Бис(триоксидосульфат)( S — S )(2−) [1] | |||
| Идентификаторы | |||
| |||
3D модель ( JSmol ) |
| ||
| ЧЭБИ |
| ||
| ChemSpider | |||
CID PubChem |
| ||
Панель инструментов CompTox ( EPA ) |
| ||
| |||
| |||
| Характеристики | |||
| С 2О2− 6 | |||
| Молярная масса | 160,126 г моль −1 | ||
| Кислотность ( pK a ) | 0,5 [2] | ||
| Сопряженная кислота | Дитионовая кислота | ||
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |||
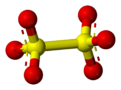
Дитионатный ( или метабисульфатный ) анион , S
2О2−
6, представляет собой оксоанион серы [3], полученный из дитионовой кислоты , H 2 S 2 O 6 . Его химическая формула иногда записывается в полуструктурном формате, как [O 3 SSO 3 ] 2− . Это первый член политионатов .
Атомы серы дитионат-иона находятся в степени окисления +5 из-за наличия связи S–S. Как правило, дитионаты образуют стабильные соединения, которые нелегко окисляются или восстанавливаются. Сильные окислители окисляют их до сульфатов , а сильные восстановители восстанавливают их до сульфитов и дитионитов . [4] Водные растворы дитионатов довольно стабильны и могут кипятиться без разложения. [5]
При γ-облучении кристаллических дитионатов образуется SO•−
3 ион- радикалы . [6] Неспаренный электрон в SO•−
3Радикалы можно обнаружить с помощью электронного парамагнитного резонанса , а дитионат бария был предложен в качестве основы для дозиметра радиации . [7]
Дитионат-ион может действовать как бидентатный лиганд . [8]
Структура дитионат-иона в твердом состоянии в Na 2 S 2 O 6 ·2H 2 O ступенчатая , тогда как в безводной калийной соли она почти затмевается . [4]
Соединения
Соединения, содержащие дитионат-ион, включают:
- дитионат натрия , Na 2 S 2 O 6
- дитионат калия , K2S2O6
- дитионат бария, BaS 2 O 6
Ссылки
- ^ "Дитионат(2−) (CHEBI:29209)". Химические сущности биологического интереса (ChEBI) . Великобритания: Европейский институт биоинформатики.
- ^ Perrin, D. D., ред. (1982) [1969]. Константы ионизации неорганических кислот и оснований в водных растворах . Химические данные ИЮПАК (2-е изд.). Oxford: Pergamon (опубликовано в 1984 г.). Запись 63. ISBN 0-08-029214-3. LCCN 82-16524.
- ^ Международный союз теоретической и прикладной химии (2005). Номенклатура неорганической химии (Рекомендации ИЮПАК 2005). Кембридж (Великобритания): RSC – IUPAC . ISBN 0-85404-438-8 . стр. 130. Электронная версия.
- ^ ab Гринвуд, Норман Н .; Эрншоу, Алан (1997). Химия элементов (2-е изд.). Баттерворт-Хайнеманн . ISBN 978-0-08-037941-8.
- ^ Коттон, Ф. Альберт ; Уилкинсон, Джеффри ; Мурильо, Карлос А.; Бохманн, Манфред (1999), Advanced Inorganic Chemistry (6-е изд.), Нью-Йорк: Wiley-Interscience, ISBN 0-471-19957-5
- ^ Радиационная химия дитионатов GS Murthy, RL Eager и KJ McCallum Can. J. Chem. 49(22),(1971), 3733
- ^ Дитионат бария как ЭПР-дозиметр Баран М.П., Бугай О.А., Колесник СП., Максименко В.М., Тесленко В.В., Петренко Т.Л. Desrosiers MF Radiation Protection Dosimetry 2006 120 , 202; doi :10.1093/rpd/nci531
- ^ Структуры некоторых комплексов меди (II), содержащих S
2О2−
6Ион Ишии М. Вестник Университета Ямагата 5 , 1,(2001), 7