Синтез углеводов
This article may be too technical for most readers to understand. (February 2016) |
Синтез углеводов — это подраздел органической химии, занимающийся созданием сложных углеводных структур из простых единиц (моносахаридов). Создание углеводных структур обычно включает связывание моносахаридов или олигосахаридов через гликозидные связи, процесс, называемый гликозилированием . Поэтому важно конструировать гликозидные связи, которые имеют оптимальную молекулярную геометрию (стереоселективность) и стабильную связь (региоселективность) в месте реакции (аномерный центр). [1]

Фон
В общем, углеводы можно разделить на две группы: простые сахара и сложные углеводы. Простые сахара, также называемые моносахаридами, представляют собой углеводы, которые не могут быть далее расщеплены путем гидролиза . Когда гликозидные связи соединяют две или более единиц моносахаридов, образуются сложные углеводы. Сложные углеводы можно разделить на дисахариды , олигосахариды и полисахариды . Дисахарид образуется из двух моносахаридов. Углеводы, содержащие от 3 до 10 моносахаридов [2], называются олигосахаридом. Высшие олигосахариды, содержащие более 10 моносахаридов, являются полисахаридами.
До сих пор не было единой синтетической стратегии последовательного производства олигосахаридов из-за нюансов в аномерных эффектах мономеров и сложности в углеводных структурах. [3] [4] Используются простые процедуры, такие как однореакторный и твердофазный синтез, которые обеспечивают атомную экономию [5] [3] . Однако необходимы дальнейшие разработки в этих синтетических подходах, поскольку они все еще не полностью контролируются и автоматизированы. [5]
Значение
Гликоконъюгат — это продукт, образованный олигосахаридами, ковалентно связанными с другими биомолекулами, такими как белки и липиды. [6] Они играют незаменимую роль в биологической активности клеток млекопитающих от генерации энергии до передачи сигналов клеткам. [6] [7] [8] Эти гликоконъюгаты с короткими олигосахаридными структурами важны для характеристики и очистки в ходе разработки вакцин на основе гликоконъюгатов. [9] Поэтому исследования в области инженерии предшественников гликозила, которые создают олигосахариды с контролируемым размером, важны для синтеза углеводов. [ необходима цитата ]
Синтез олигосахаридов
Олигосахариды имеют разнообразные структуры. Количество моносахаридов, размер кольца, различная аномерная стереохимия и существование сахаров с разветвленной цепью — все это способствует удивительной сложности структур олигосахаридов. Суть синтеза восстанавливающих олигосахаридов заключается в соединении аномерного гидроксила гликозильных доноров с алкогольными гидроксильными группами гликозильных акцепторов . Защита гидроксильных групп акцептора с целевой алкогольной гидроксильной группой без защиты может обеспечить региохимический контроль. Кроме того, такие факторы, как различные защитные группы, растворитель и методы гликозилирования , могут влиять на то, какой аномер образуется. Эта концепция проиллюстрирована синтезом олигосахаридов на Схеме 1. Синтез олигосахаридов обычно состоит из четырех частей: подготовка гликозильных доноров, подготовка гликозильных акцепторов с одной незащищенной гидроксильной группой, их связывание и процесс снятия защиты . [ необходима цитата ]

Строительные блоки
Распространенными донорами в синтезе олигосахаридов являются гликозилгалогениды , гликозилацетаты, тиогликозиды , трихлорацетимидаты, пентенилгликозиды и гликали . Из всех этих доноров гликозилгалогениды являются классическими донорами, которые сыграли историческую роль в развитии реакций гликозилирования. Доноры тиогликозида и трихлорацетимидата используются чаще других в современных методах гликозилирования. Когда речь идет о методе трихлорацетимидата, одним из преимуществ является то, что нет необходимости вводить реагенты тяжелых металлов в процесс активации. Более того, использование различных оснований может выборочно приводить к различным аномерным конфигурациям. (Схема 2) Что касается тиогликозидов, наибольшая сила заключается в том, что они могут обеспечить временную защиту аномерного центра, поскольку они могут выживать после большинства процессов активации. [10] Кроме того, можно использовать различные методы активации, такие как NIS/AgOTf, NIS/TfOH, IDCP ( йоддиколлидинперхлорат ) , йод и Ph2SO / Tf2O . Кроме того, при получении 1,2-трансгликозидной связи использование тиогликозидов и имидатов может способствовать перегруппировке побочных продуктов ортоэфира, поскольку реакционные смеси достаточно кислые.

Стереоселективность
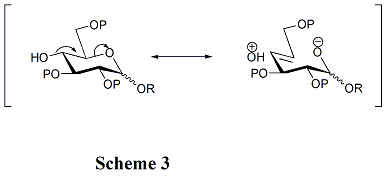
Структуры акцепторов играют решающую роль в скорости и стереоселективности гликозилирования. Как правило, незащищенные гидроксильные группы менее реакционноспособны, когда они находятся между объемными защитными группами. Вот почему гидроксильная группа в OH-4 в пиранозидах нереактивна. Гиперконъюгация происходит, когда OH-4 анти-перипланарна кольцевому кислороду, что также может снизить его реакционную способность. (Схема 3) Кроме того, ацильные защитные группы могут снизить реакционную способность акцепторов по сравнению с алкильными защитными группами из-за их способности оттягивать электроны. Гидроксильная группа в OH-4 производных N-ацетилглюкозамина особенно нереакционна. [11]
Гликозидная связь образуется из гликозильного донора и гликозильного акцептора. Существует четыре типа гликозидных связей: 1, 2-транс-α, 1, 2-транс-бета, 1, 2-цис-α и 1, 2-цис-бета связи. 1, 2-транс гликозидные связи можно легко получить, используя 2-O-ацилированные гликозильные доноры (участие соседней группы). Чтобы предотвратить накопление ортоэфирных интермедиатов , условия гликозилирования должны быть слегка кислыми.
Сложные связи
При соединении моносахаридов олигосахариды должны быть восстановленными, чтобы последовательно соединить гликозильные единицы. Моносахариды в природе предпочитают ɑ-связи из-за аномерного эффекта , [1] но дисахариды с ɑ-связями являются невосстанавливающими, таким образом, дезактивируя последующее соединение моносахаридов. [12] Для того чтобы сделать процесс гликозилирования непрерывным и автоматизированным, гликозидные связи должны поддерживать бета, чтобы сохранить структуру открытой для связывания с большим количеством гликозильных групп.
Несколько сложнее приготовить 1, 2-цис-β-гликозидные связи стереоселективно. Обычно, когда не участвующие группы в положении O-2, 1, 2-цис-β-связь может быть достигнута либо с использованием исторически важных методов галогенид -ионов, либо с использованием 2-O-алкилированных гликозильных доноров, обычно тиогликозидов или трихлорацетимидатов, в неполярных растворителях. [ необходима цитата ]
В начале 1990-х годов связь бета-маннозида все еще была слишком сложной для попыток любителей. Однако метод, представленный Дэвидом Кричем (Схема 4), с защитой 4,6-бензилидена в качестве предварительного условия и аномерным альфа-трифлатом в качестве ключевого промежуточного продукта, по сути, решает эту проблему. Параллельно разрабатываемый, но гораздо более длительный подход внутримолекулярной доставки агликона (IAD) [13] является малоиспользуемой, но тем не менее стереоспецифической альтернативой.

Смотрите также
Ссылки
- ^ ab Tiwari, Vinod Kumar (26 октября 2023 г.). Синтетические стратегии в химии углеводов (1-е изд.). Elsevier. стр. 3–7. ISBN 9780323986496.
- ^ Лорентин, А.; Эдвардс, Калифорния (2013-01-01), «Клетчатка: резистентный крахмал и олигосахариды», в Кабальеро, Бенджамин (ред.), Энциклопедия питания человека (третье издание) , Уолтем: Academic Press, стр. 246–253, ISBN 978-0-12-384885-7, получено 2024-04-13
- ^ ab Seeberger, Peter H.; Werz, Daniel B. (апрель 2007 г.). «Синтез и медицинское применение олигосахаридов». Nature . 446 (7139): 1046–1051. Bibcode :2007Natur.446.1046S. doi :10.1038/nature05819. ISSN 1476-4687. PMID 17460666.
- ^ Boltje, Thomas J.; Buskas, Therese; Boons, Geert-Jan (2009-11-01). «Возможности и проблемы в исследовании синтетических олигосахаридов и гликоконъюгатов». Nature Chemistry . 1 (8): 611–622. Bibcode :2009NatCh...1..611B. doi :10.1038/nchem.399. ISSN 1755-4330. PMC 2794050 . PMID 20161474.
- ^ ab Xu, Han; Shen, Baoxing; Qiao, Meng; Linhardt, Robert J.; Zhang, Xing (2021-04-15). "Последние достижения в области однореакторного синтеза для сборки гликанов, гликоконъюгатов и полисахаридов контролируемого размера". Углеводные полимеры . 258 : 117672. doi : 10.1016/j.carbpol.2021.117672. ISSN 1879-1344. PMID 33593549.
- ^ ab Шиватаре, Сачин С.; Шиватаре, Видья С.; Вонг, Чи-Хьюи (2022-10-26). «Гликоконъюгаты: синтез, функциональные исследования и терапевтические разработки». Chemical Reviews . 122 (20): 15603–15671. doi :10.1021/acs.chemrev.1c01032. ISSN 0009-2665. PMC 9674437 . PMID 36174107.
- ^ Чандел, Навдип С. (январь 2021 г.). «Углеводный метаболизм». Cold Spring Harbor Perspectives in Biology . 13 (1): a040568. doi :10.1101/cshperspect.a040568. ISSN 1943-0264. PMC 7778149. PMID 33397651 .
- ^ Дэниел Э. Леви и Питер Фюгеди.; Органическая химия сахаров ; Тейлор и Фрэнсис: 2006 , стр. 181–197.
- ^ Стефанетти, Джузеппе; Макленнан, Кальман Александр; Миколи, Франческа (29.09.2022). «Влияние и контроль размера сахара в гликоконъюгированных вакцинах». Molecules . 27 (19): 6432. doi : 10.3390/molecules27196432 . ISSN 1420-3049. PMC 9572008 . PMID 36234967.
- ^ Роберт В. Стик.; Углеводы: сладкие молекулы жизни .; Academic Press.; 2001 , стр. 113-177
- ^ Крич, Д.; Дудкин В.Я.Ам. хим. Соц. 2001 , 123 , 6819-6825
- ^ Шарма, Алок; Виджаян, Маманнамана (январь 2011 г.). «Влияние гликозидной связи на природу связывания углеводов в β-призматических I-складчатых лектинах: рентгеновское и молекулярно-динамическое исследование комплексов банановый лектин–углевод». Гликобиология . 21 (1): 23–33. doi :10.1093/glycob/cwq128. PMID 20729346.
- ^ Гарегг, П. Дж. Химические трактаты-Организационная химия , 1992 , 5 , 389

