Химическое гликозилирование
Химическая реакция гликозилирования включает соединение гликозильного донора с гликозильным акцептором , образуя гликозид . [1] [2] [3] Если и донор, и акцептор являются сахарами, то продукт представляет собой олигосахарид . Реакция требует активации подходящим активирующим реагентом. Реакции часто приводят к смеси продуктов из-за создания нового стереогенного центра в аномерном положении гликозильного донора. Образование гликозидной связи позволяет синтезировать сложные полисахариды , которые могут играть важную роль в биологических процессах и патогенезе , и поэтому наличие синтетических аналогов этих молекул позволяет проводить дальнейшие исследования в отношении их биологического значения.
Терминология
Реакция гликозилирования включает соединение гликозильного донора и гликозильного акцептора посредством инициирования с использованием активатора в подходящих условиях реакции.
- Гликозильный донор — это сахар с подходящей уходящей группой в аномерном положении. Эта группа в условиях реакции активируется и через образование оксокарбения удаляется , оставляя электрофильный аномерный углерод.
- Гликозильный акцептор — это сахар с незащищенной нуклеофильной гидроксильной группой , которая может атаковать углерод оксокарбениевого иона, образующегося в ходе реакции, и способствовать образованию гликозидной связи.
Активатором обычно является кислота Льюиса , которая позволяет уйти уходящей группе в аномерном положении, что приводит к образованию иона оксокарбения.
Стереохимия
Образование гликозидной связи приводит к образованию нового стереогенного центра , и поэтому можно ожидать, что в результате получится смесь продуктов. Образованная связь может быть либо аксиальной, либо экваториальной (α или β по отношению к глюкозе). Чтобы лучше понять это, необходимо рассмотреть механизм реакции гликозилирования.

Участие соседней группы
Стереохимический результат реакции гликозилирования в некоторых случаях может зависеть от типа защитной группы, используемой в положении 2 донора гликозила. Участвующая группа, обычно с присутствующей карбоксильной группой, будет преимущественно приводить к образованию β-гликозида. В то время как неучаствующая группа, группа, обычно без карбоксильной группы, часто будет приводить к образованию α-гликозида.
Ниже можно увидеть, что наличие ацетильной защитной группы в положении 2 позволяет образовать промежуточный ион ацетоксония, который блокирует атаку на нижнюю поверхность кольца, тем самым обеспечивая преимущественное образование β-гликозида.
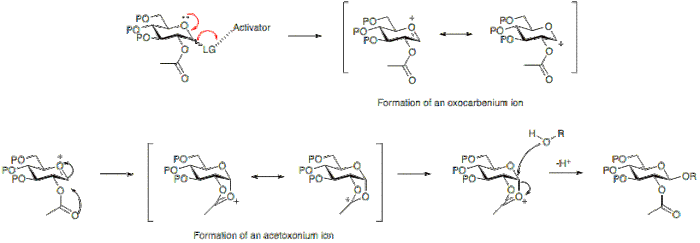
В качестве альтернативы, отсутствие участвующей группы в позиции 2 позволяет проводить атаку снизу или сверху. Поскольку продукт α-гликозида будет благоприятствоваться аномерному эффекту , α-гликозид обычно преобладает.

Защита групп
Различные защитные группы на гликозильном доноре или гликозильном акцепторе [4] [5] могут влиять на реакционную способность и выход реакции гликозилирования. Обычно электроноакцепторные группы , такие как ацетильные или бензоильные группы, как обнаружено, снижают реакционную способность донора/акцептора и поэтому называются «разоруженными» группами. Электронодонорные группы , такие как бензильная группа, как обнаружено, повышают реакционную способность донора/акцептора и поэтому называются «вооружающими» группами.
Современные методы синтеза гликозидов
Гликозилйодиды
Гликозилиодиды были впервые введены для использования в реакциях гликозилирования в 1901 году Кенигсом и Кнорром [6] [7], хотя часто считались слишком реактивными для синтетического использования. Недавно несколько исследовательских групп показали, что эти доноры обладают уникальными реактивными свойствами и могут отличаться от других гликозилхлоридов или бромидов по времени реакции, эффективности и стереохимии . [8] [9] [10] [11] Гликозилиодиды могут быть получены в различных условиях, одним из методов, заслуживающих внимания, является реакция 1- O -ацетилпиранозида с TMSI. [12]

Доноры йодида обычно могут быть активированы в основных условиях для получения β-гликозидов с хорошей селективностью. Использование солей тетраалкиламмония йодида, таких как тетрабутиламмоний йодид (TBAI), позволяет проводить in-situ аномеризацию α-гликозилгалогенида в β-гликозилгалогенид и обеспечивает α-гликозид с хорошей селективностью. [13] [14] [15] [16]

Тиогликозиды
Тиогликозиды были впервые описаны в 1909 году Фишером [17] и с тех пор постоянно изучались, что позволило разработать многочисленные протоколы их получения. Преимущество использования тиогликозидов заключается в их стабильности в широком диапазоне условий реакции, что позволяет производить манипуляции с защитными группами. Кроме того, тиогликозиды действуют как временные защитные группы в аномерном положении, что позволяет тиогликозидам быть полезными как донорами гликозила, так и акцепторами гликозила. [13]
Тиогликозиды обычно получают путем реакции перацетилированных сахаров с BF
3•OEt
2и соответствующий тиол. [18] [19] [20]
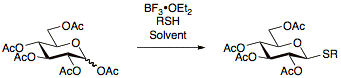
Тиогликозиды, используемые в реакциях гликозилирования в качестве доноров, могут быть активированы в широком диапазоне условий, наиболее заметно с использованием NIS/AgOTf. [21]

Трихлорацетимидаты
Трихлорацетимидаты были впервые введены и исследованы Шмидтом в 1980 году [22] [23] и с тех пор стали очень популярными для синтеза гликозидов. Использование трихлорацетимидатов обеспечивает множество преимуществ, включая простоту образования, реакционную способность и стереохимический результат. [13] O -гликозилтрихлорацетимидаты получают путем добавления трихлорацетонитрила ( Cl
3CCN ) в основных условиях до свободной аномерной гидроксильной группы.

Типичными активирующими группами для реакций гликозилирования с использованием трихлорацетимидатов являются BF
3•OEt
2или TMSOTf . [24]

Колоночная хроматографическая очистка реакционной смеси иногда может быть сложной из-за побочного продукта трихлорацетамида. Однако это можно преодолеть, промыв органический слой 1 М раствором NaOH в делительной воронке перед хроматографией. Было обнаружено, что ацетильные защитные группы стабильны во время этой процедуры. [25]
Известные синтетические продукты
Ниже приведены несколько примеров некоторых примечательных мишеней, полученных с помощью серии реакций гликозилирования.


Смотрите также
Ссылки
- ^ Бунс, Герт-Ян; Карл Дж. Хейл (2000). Органический синтез с углеводами . Блэквелл. ISBN 978-1-85075-913-3.
- ^ Crich, D.; Lim, L. (2004). «Гликозилирование с сульфоксидами и сульфинатами в качестве доноров или промоутеров». Org. React. 64 : 115–251. doi :10.1002/0471264180.or064.02. ISBN 0471264180.
- ^ Буфали, С.; Зеебергер, П. (2006). «Гликозилирование на полимерных носителях». Org. React. 68 : 115–251. doi :10.1002/0471264180.or068.02. ISBN 0471264180.
- ^ Ворм, Стефан ван дер; Хансен, Томас; Хенгст, Джейкоб М.А. ван; С. Оверклефт, Герман; Марель, Гейсберт А. ван дер; К. Коде, Йерун Д. (2019). «Реакционная способность акцептора в реакциях гликозилирования». Обзоры химического общества . 48 (17): 4688–4706. дои : 10.1039/C8CS00369F . hdl : 1887/79489 . ПМИД 31287452.
- ^ Vorm, S. van der; Hansen, T.; S. Overkleeft, H.; Marel, GA van der; C. Codee, JD (2017). «Влияние нуклеофильности акцептора на механизм реакции гликозилирования». Chemical Science . 8 (3): 1867–75. doi :10.1039/C6SC04638J. PMC 5424809 . PMID 28553477.
- ^ Кенигс, Вильгельм; Норр, Эдвард (1901). «Ueber einige Derivate des Traubensuckers und der Galactose (p)». Берихте дер немецкое химическое общество . 34 (1): 957–981. дои : 10.1002/cber.190103401162.
- ^ Фишер, Э. (1893). «Ueber die Glucoside der Alkohole». Бер. Дтч. хим. Гес . 26 (3): 2400–12. дои : 10.1002/cber.18930260327.
- ^ Gervay, J.; Hadd, MJ (1997). «Анионные добавки к гликозилйодидам: высокостереоселективные синтезы β C-, N- и O-гликозидов1». J. Org. Chem . 62 (20): 6961–67. doi :10.1021/jo970922t.
- ^ Hadd, MJ; Gervay, J. (1999). «Гликозилиодиды являются высокоэффективными донорами в нейтральных условиях». Carbohydr. Res . 320 (1–2): 61–69. doi :10.1016/S0008-6215(99)00146-9.
- ^ Микель, Н.; Виньяндо, С.; Руссо, Г.; Лэй, Л. (2004). «Эффективный синтез O-, S-, N- и C-гликозидов 2-амино-2-дезокси-d-глюкопиранозы из гликозилйодидов». Synlett . 2004 (2): 341–3. doi :10.1055/s-2003-44978.
- ^ van Well, RM; Kartha, KPR; Field, RA (2005). «Гликозилирование, стимулируемое йодом, с гликозилйодидами: синтез α-гликозидов». J. Carbohydr. Chem . 24 (4–6): 463–474. doi :10.1081/CAR-200067028. S2CID 86329924.
- ^ Gervay, J.; Nguyen, TN; Hadd, MJ (1997). «Механистические исследования стереоселективного образования гликозилйодидов: первая характеристика β-d-гликозилйодидов». Carbohydr. Res . 300 (2): 119–125. doi :10.1016/S0008-6215(96)00321-7.
- ^ abc Zhu X, Schmidt RR (2009). «Новые принципы образования гликозидных связей». Angew Chem Int Ed Engl . 48 (11): 1900–34. doi :10.1002/anie.200802036. PMID 19173361.
- ^ Lam SN, Gervay-Hague J (октябрь 2003 г.). «Эффективный путь к 2-дезокси бета-O-арил-d-гликозидам через прямое замещение гликозилйодидов». Org Lett . 5 (22): 4219–22. doi :10.1021/ol035705v. PMID 14572289.
- ^ Du W, Gervay-Hague J (май 2005 г.). «Эффективный синтез аналогов альфа-галактозилцерамида с использованием доноров гликозилйодида». Org Lett . 7 (10): 2063–5. doi :10.1021/ol050659f. PMID 15876055.
- ^ Du W, Kulkarni SS, Gervay-Hague J (июнь 2007 г.). «Эффективные однореакторные синтезы биологически активных альфа-связанных гликолипидов». Chem Commun . 23 (23): 2336–8. doi :10.1039/b702551c. PMID 17844738.
- ^ Фишер, Э.; Дельбрюк, К. (1909). «Убер-тиофенол-глюкозид». Бер. Дтч. хим. Гес . 42 (2): 1476–82. дои : 10.1002/cber.19090420210.
- ^ Tai CA, Kulkarni SS, Hung SC (октябрь 2003 г.). «Легкое катализируемое Cu(OTf)2 приготовление пер-O-ацетилированных гексопираноз со стехиометрическим уксусным ангидридом и последовательное однореакторное аномерное замещение на тиогликозиды в условиях отсутствия растворителя». J Org Chem . 68 (22): 8719–22. doi :10.1021/jo030073b. PMID 14575510.
- ^ Agnihotri G, Tiwari P, Misra AK (май 2005 г.). «Однореакторный синтез пер-O-ацетилированных тиогликозидов из незащищенных восстанавливающих сахаров». Carbohydr Res . 340 (7): 1393–6. doi :10.1016/j.carres.2005.02.027. PMID 15854611.
- ^ Хасегава Дж.Ю., Хамада М., Миямото Т., Нишиде К., Кадзимото Т., Уэниши Дж., Узел М. (октябрь 2005 г.). «Применение производных фенилметантиола и бензолтиола в качестве сероорганических реагентов без запаха в синтезе тиосахаров и тиогликозидов». Углеводы Рез . 340 (15): 2360–8. doi :10.1016/j.carres.2005.07.011. ПМИД 16143318.
- ^ Veeneman, GH; van Leeuwen, SH; van Boom, JH (1990). «Ион йодония, стимулирующий реакции в аномерном центре. II. Эффективный тиогликозидный опосредованный подход к образованию 1,2-транс-связанных гликозидов и гликозидных эфиров». Tetrahedron Lett . 31 (9): 1331–4. doi :10.1016/S0040-4039(00)88799-7.
- ^ Шмидт, Р.Р.; Мишель, Дж. (1980). «Einfache Synthese von α-und β-O-Glykosylimidaten; Herstellung von Glykosiden und Disacchariden». Энджью. Хим . 92 (9): 763–4. Бибкод : 1980AngCh..92..763S. дои : 10.1002/ange.19800920933.
- ^ Шмидт, Р. Р.; Мишель, Дж. (1980). «Простой синтез α- и β-O-гликозилимидатов; получение гликозидов и дисахаридов». Angew. Chem. Int. Ed. Engl . 19 (9): 731–2. doi :10.1002/anie.198007311.
- ^ Kale RR, McGannon CM, Fuller-Schaefer C, Hatch DM, Flagler MJ, Gamage SD, Weiss AA, Iyer SS (2008). «Дифференциация структурно гомологичных токсинов Shiga 1 и Shiga 2 с использованием синтетических гликоконъюгатов». Angew Chem Int Ed Engl . 47 (7): 1265–8. doi :10.1002/anie.200703680. PMID 18172842.
- ^ Хейкендорф, Мадс; Йенсен, Хенрик Х. (2017). «Удаление некоторых распространенных побочных продуктов гликозилирования во время обработки реакции». Carbohydrate Research . 439 : 50–56. doi :10.1016/j.carres.2016.12.007. PMID 28107657.
- ^ Джо М., Бай Ю., Накарио Р.К., Лоуари Т.Л. (август 2007 г.). «Синтез докозанасахаридного арабинанского домена микобактериального арабиногалактана и предлагаемого биосинтетического предшественника октадекасахарида». J Am Chem Soc . 129 (32): 9885–901. дои : 10.1021/ja072892+. ПМИД 17655235.
- ^ Wu X, Bundle DR (сентябрь 2005 г.). «Синтез гликоконъюгированных вакцин для Candida albicans с использованием новой линкерной методологии». J Org Chem . 70 (18): 7381–8. doi :10.1021/jo051065t. PMID 16122263.
Книги
- Брито-Ариас, Марко (2022). Синтез и характеристика гликозидов (3-е изд.). Springer. doi :10.1007/978-3-030-97854-9. ISBN 978-3-030-97854-9. S2CID 248302952.