Бисульфит кальция
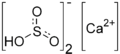 | |
 | |
| Имена | |
|---|---|
| Название ИЮПАК Гидросульфит кальция | |
Другие имена
| |
| Идентификаторы | |
3D модель ( JSmol ) |
|
| ChemSpider | |
| Информационная карта ECHA | 100.034.007 |
| Номер E | E227 (консерванты) |
CID PubChem |
|
| Номер RTECS |
|
| УНИИ | |
Панель инструментов CompTox ( EPA ) |
|
| |
| |
| Характеристики | |
| Ca( HSO3 ) 2 | |
| Молярная масса | 202,22 г/моль |
| Температура плавления | 203 °С |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |
Бисульфит кальция ( бисульфит кальция или гидросульфит кальция ) — неорганическое соединение , представляющее собой соль катиона кальция и аниона бисульфита . Его можно получить путем обработки извести избытком диоксида серы и воды. В качестве пищевой добавки он используется в качестве консерванта под номером E227. Бисульфит кальция — это кислая соль , которая в водном растворе ведет себя как кислота. Он используется в сульфитном процессе производства бумаги из древесной щепы. [1]
Синтез
Бисульфит кальция можно получить путем обработки извести (химическая формула Ca(OH) 2 ) избытком диоксида серы и воды. [2] После синтеза раствора бисульфита кальция он будет иметь зеленовато-желтый непрозрачный вид в виде водного раствора. [3]
Химические реакции
При реакции бисульфита кальция с окружающим воздухом образуется кристаллический осадок, состоящий из дигидрата сульфита кальция . [ необходима ссылка ]
Когда бисульфит кальция переваривается в качестве пищевой добавки, могут возникнуть различные реакции в метаболических путях. Один общий путь приводит к реакции, которая даст 6%-8% диоксида серы . Он может перейти в сульфит при поглощении легкими, а сульфит будет преобразован в сульфат в печени ферментом, называемым сульфитоксидазой . Сульфит может быть вреден для людей, подверженных астме, приводя к приступам астмы. Сульфит также может вызвать крапивницу и ангионевротический отек у в остальном здоровых людей. [3]
Процесс, известный как мокрая очистка известняком, является средством, с помощью которого диоксид серы удаляется из отходов, выделяемых при сжигании ископаемого топлива . Шагом в этом процессе является окисление бисульфита кальция с образованием сульфата. Когда эта реакция происходит в водном растворе, получается гипс . Скорость этой реакции может быть увеличена в присутствии сульфата магния (II) в качестве катализатора. [4]
Другие катализаторы окисления бисульфита кальция включают марганец , железо , кобальт , никель , свинец и цинк . [2]
Приложение
Экономичный
Бисульфит кальция является одним из химикатов, используемых в общей мягкой бисульфитной обработке, предназначенной для повышения эффективности выхода сахара при переработке излишков древесины в биотопливо и реактивное топливо . Использование методики мягкого бисульфита увеличивает выход, а также экономит затраты на доставку древесины на заводы по производству этанола для переработки. [5]
Бисульфит кальция часто используется в качестве пищевого консерванта. Одним из таких случаев является засолка вишни. Однако исследования показывают, что некоторые микроорганизмы могут вызывать гниение вишни, поскольку они вырабатывают фермент полигалактуроназу , который может работать даже в присутствии бисульфита кальция. Три вида грибков, которые особенно способны вызывать гниение засоленной вишни, — это Aspergillus niger , Cytospora leucostoma и Penicillium expansum . [ 6 ]
Лекарственный
Раствор бисульфита кальция используется в процессе преобразования дигидрокверцетина в пульпе древесной коры и последующего преобразования дигидрокверцетина в пригодную для использования форму: кверцетин . Бисульфит кальция не является оптимальным бисульфитным соединением для этой реакции, поскольку ионы кальция могут быть удалены из раствора бисульфита кальция во время реакции, тем самым ингибируя механизм. Однако бисульфиты кальция, как и другие бисульфиты, такие как бисульфит аммония , обладают каталитической способностью в этой реакции, поскольку они не расходуются и могут быть использованы повторно. [7]
Смотрите также
Ссылки
- ^ Патт, Рудольф; Кордсачия, Отар; Зюттингер, Ричард; Отани, Ёсито; Хеш, Йохен Ф.; Эрлер, Питер; Эйхингер, Рудольф; Холик, Герберт; Хамм, Удо; Романн, Майкл Э.; Мумменхофф, Питер; Петерманн, Эрих; Миллер, Ричард Ф.; Франк, Дитер; Вилкен, Ренке; Баумгартен, Генрих Л.; Рентроп, Герт-Хайнц (2000). «Бумага и целлюлоза». Энциклопедия промышленной химии Ульмана . Вайнхайм: Wiley-VCH. дои : 10.1002/14356007.a18_545. ISBN 3527306730.
- ^ ab Karatza, Despina; Prisciandaro, Marina; Lancia, Amedeo; Musmarra, Dino (2010-06-01). «Окисление сульфита, катализируемое ионами кобальта в процессах десульфуризации дымовых газов». Журнал Ассоциации по управлению воздухом и отходами . 60 (6): 675– 680. Bibcode : 2010JAWMA..60..675K. doi : 10.3155/1047-3289.60.6.675. ISSN 1096-2247. PMID 20564992. S2CID 9127556.
- ^ ab EFSA Panel on Food supplements and Nutrient Sources added to Food (ANS) (2016). "Научное мнение о переоценке диоксида серы (E 220), сульфита натрия (E 221), бисульфита натрия (E 222), метабисульфита натрия (E 223), метабисульфита калия (E 224), сульфита кальция (E 226), бисульфита кальция (E 227) и бисульфита калия (E 228) в качестве пищевых добавок". EFSA Journal . 14 (4). doi : 10.2903/j.efsa.2016.4438 .
- ^ Ланча, Амедео; Мусмарра, Дино; Присциандаро, Марина; Таммаро, Марко (1999-07-01). «Каталитическое окисление бисульфита кальция в процессе десульфуризации дымовых газов влажного известняка–гипса». Химическая инженерная наука . 54 (15): 3019– 3026. Bibcode : 1999ChEnS..54.3019L. doi : 10.1016/S0009-2509(98)00483-7. ISSN 0009-2509.
- ^ Дуайт Андерсон и Джонуэй Гао (2015). «Мягкая бисульфитная предварительная обработка лесных отходов» (PDF) .
- ^ Льюис Дж. К., Пирсон К. Ф., Пауэрс М. Дж. (1963). «Грибы, связанные с размягчением вишни, засоленной бисульфитом». Прикладная и экологическая микробиология . 11 (2): 93– 99. doi :10.1128/am.11.2.93-99.1963. PMC 1057949. PMID 16349630. S2CID 9370969 – через журналы ASM.
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Курт, Эрвин (1953). «Кверцетин из пихтовой и сосновой коры». Промышленная и инженерная химия . 45 (9): 2096– 2097. doi :10.1021/ie50525a047 . Получено 29.03.2023 .


