Бисульфат цезия
 | |||
| |||
| Идентификаторы | |||
|---|---|---|---|
| |||
3D модель ( JSmol ) |
| ||
CID PubChem |
| ||
Панель инструментов CompTox ( EPA ) |
| ||
| |||
| |||
| Характеристики | |||
| CsH2O4S | |||
| Молярная масса | 229,97 г·моль −1 | ||
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |||
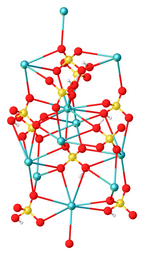
Бисульфат цезия или гидросульфат цезия — неорганическое соединение с формулой CsHSO4 . Цезиевая соль бисульфата , это бесцветное твердое вещество, полученное путем объединения Cs2SO4 и H2SO4 . [ 1 ]
Характеристики
Выше 141 °C CsHSO4 является суперионным проводником . [1] Быстрая ионная проводимость возникает особенно в диапазоне этих температур из-за высокой активности протонов . [2]
На основании результатов рентгеновской кристаллографии структура состоит из тетраэдрических сульфатных центров, которые связывают ионы цезия. Протон связан с кислородом на сульфате. [3]
CsHSO 4 проходит через три кристаллические фазы , которые называются фазами III, II и I. [4] CsHSO 4 изначально существует в фазе III при комнатной температуре 21 °C. Фаза III варьируется от 21 °C до 90 °C с температурой перехода от 90 °C до 100 °C между фазой III и фазой II. Фаза II варьируется от 90 °C до 140 °C. При 140 °C CsHSO 4 претерпевает фазовый сдвиг из фазы II в фазу I. [5]
Фаза III (от 21 °C до 90 °C) и фаза II (от 90 °C до 140 °C) называются моноклинными фазами , в которых CsHSO 4 демонстрирует самую низкую протонную проводимость. По мере повышения температуры кристаллической структуры она будет демонстрировать изменения в объеме элементарной ячейки и расположении ее водородных связей, что изменит способность кристаллической структуры CsHSO 4 допускать смещение протонов.
При 141 °C кристаллическая структура CsHSO 4 претерпевает структурное изменение из моноклинной фазы II в тетрагональную фазу , становясь фазой I. Фаза I имеет более высокую кристаллическую симметрию и расширенные размеры решетки . Фаза I отмечена как суперпротонная фаза (сильнопроводящая фаза), которая вызывает экстремальный рост протонной проводимости на четыре порядка, достигая 10 мСм/см. Это делает проводимость CsHSO 4 в десять раз сильнее, чем проводимость водного раствора хлорида натрия . В суперпротонной фазе движение тетраэдра SO 4 вызывает нарушение сети водородных связей, что ускоряет перенос протонов. [5] Тетрагональные анионы, имеющиеся в структуре, отвечают за расположение водородных связей с движущимися протонами. [6]
Потенциальные приложения
Максимальная проводимость чистого CsHSO 4 составляет 10 мСм/см, что слишком мало для практического применения. В композитах с SiO 2 , TiO 2 и Al 2 O 3 ) протонная проводимость ниже температуры фазового перехода увеличивается на несколько порядков. [7]
В отличие от гидратированных протонных проводников, отсутствие воды в CsHSO 4 обеспечивает термическую и электрохимическую стабильность. Измерения электродвижущей силы (ЭДС) в увлажненной ячейке концентрации кислорода подтвердили высокую ионную природу CsHSO 4 в его суперпротонной фазе. [8] На основе теплового вращения напряжение оставалось неизменным в течение более 85 часов во время измерения, особенно при высокой температуре. [8] Эти результаты демонстрируют термическую независимость от сред влажного типа. Кроме того, кристаллическая структура CsHSO 4 обеспечивает быстрый перенос более мелких заряженных ионов, что приводит к эффективной передаче энергии в электрохимических устройствах.
Ссылки
- ^ ab Haile, Sossina M.; Boysen, Dane A.; Chisholm, Calum RI; Merle, Ryan B. (2001). «Твердые кислоты как электролиты топливных элементов» (PDF) . Nature . 410 (6831): 910– 913. Bibcode : 2001Natur.410..910H. doi : 10.1038/35073536. PMID 11309611. S2CID 4430178.
- ^ Синицын, ВВ (2010). «Влияние давления на фазовые переходы в суперпротонных проводниках MeHAO4 (A = S, Se и Me = NH4, Rb, Cs)». Журнал химии материалов . 20 (30): 6226– 6234. doi :10.1039/c0jm00052c.
- ^ Балагуров, А.М.; Бескровный А.И.; Савенко Б.Н.; Меринов, Б.В.; Длоуга, М.; Вратислав, С.; Жирак (1987). «Структура дейтерированных CsHSO 4 и CsHSeO 4 при комнатной температуре ». Физический статус Солиди А. 100 (1): 3–7 . Бибкод : 1987PSSAR.100....3B. дои : 10.1002/pssa.2211000146.
- ^ Майя Мрочковска-Шершень, Мацей Секерский, Рафал Летмановский, Михал Пищ, Рената Циха-Сзот, Лидия Дудек, Славомир Фалькович, Гражина Жуковска и Магда Дудек. «Спектроскопическая проверка расширенной температурной стабильности суперионной фазы, полученной в процессе механосинтеза для композита CsHSO4/фосфосиликатное стекло». Институт нефти и газа, ул. Любич 25а, 31-503 Краков, Польша/Варшавский технологический университет Факультет химии, Отделение неорганической химии и технологии твердого тела Ul.Noakowskiego 3, 00-640 Варшава, Польша 3AGH – Университет науки и технологий, Факультет топлива и энергетики, Ал. Мицкевича 30, 30-059 Краков, Польша, без веб-сайта.
- ^ ab Отомо, Дзюнъитиро; Шигеока, Хитоси; Нагамото, Хидетоси; Такахаси, Хироши (2005). «Поведение фазового перехода и механизм протонной проводимости в композите гидросульфат цезия/кремнезем». Журнал физики и химии твердого тела . 66 (1): 21– 30. Bibcode : 2005JPCS...66...21O. doi : 10.1016/j.jpcs.2004.07.006.
- ^ Чан, Винг Ки. Структура и динамика водорода в нанокомпозитных твердых кислотах для применения в топливных элементах. TU Delft, Делфтский технический университет, 2011.
- ^ Хироки Мурояма, Тошиаки Мацуи, Рюдзи Кикучи и Коичи Эгучи. «Композитный эффект на структуру и протонную проводимость электролитов CsHSO4 при промежуточных температурах». (nd): n. pag. Department of Energy and Hydrocarbon Chemistry, Graduate School of Engineering, Kyoto University, Nishikyo-ku, Kyoto 615-8510, Japan, 13 апреля 2006 г. Web.
- ^ ab Uda, Tetsuya, Dane A. Boysen и Sossina M. Haile. «Термодинамическая, термомеханическая и электрохимическая оценка CsHSO 4». Solid State Ionics 176.1 (2005): 127-133.

