Нейропилин
| Нейропилин | |||||||||
|---|---|---|---|---|---|---|---|---|---|
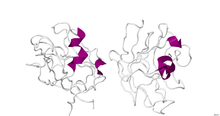 Кристаллографическая структура димерного домена B1 человеческого нейропилина 1. [1] | |||||||||
| Идентификаторы | |||||||||
| Символ | НРП | ||||||||
| Пфам | ПФ11980 | ||||||||
| ИнтерПро | IPR014648 | ||||||||
| Мембранома | 16 | ||||||||
| |||||||||
| нейропилин 1 | |||||||
|---|---|---|---|---|---|---|---|
| Идентификаторы | |||||||
| Символ | НРП1 | ||||||
| ген NCBI | 8829 | ||||||
| HGNC | 8004 | ||||||
| ОМИМ | 602069 | ||||||
| ПДБ | 3I97 | ||||||
| РефСек | NM_001024628 | ||||||
| UniProt | О14786 | ||||||
| Другие данные | |||||||
| Локус | Хр. 10 стр. 12 | ||||||
| |||||||
| нейропилин 2 | |||||||
|---|---|---|---|---|---|---|---|
| Идентификаторы | |||||||
| Символ | НРП2 | ||||||
| ген NCBI | 8828 | ||||||
| HGNC | 8005 | ||||||
| ОМИМ | 602070 | ||||||
| РефСек | NM_201279 | ||||||
| UniProt | О60462 | ||||||
| Другие данные | |||||||
| Локус | Хр. 2 q34 | ||||||
| |||||||
Нейропилин — это белковый рецептор , действующий в нейронах .
Существует две формы нейропилинов, NRP-1 и NRP-2 . Нейропилины — это трансмембранные гликопротеины , впервые описанные как регулирующие нейрогенез и ангиогенез путем комплексообразования с рецепторами плексина /лигандами семафорина класса 3 и рецепторами фактора роста эндотелия сосудов (VEGF)/лигандами VEGF соответственно. [2] [3] Нейропилины в основном действуют как корецепторы, поскольку имеют очень маленький цитоплазматический домен и, таким образом, полагаются на другие рецепторы клеточной поверхности для передачи своих сигналов через клеточную мембрану . [2] [3] Недавние исследования показали, что нейропилины многофункциональны и могут сотрудничать с широким спектром трансмембранных рецепторов. Таким образом, нейропилины связаны с многочисленными сигнальными путями, включая те, которые активируются эпидермальным фактором роста (EGF), фактором роста фибробластов (FGF), фактором роста гепатоцитов (HGF), инсулиноподобным фактором роста (IGF), тромбоцитарным фактором роста (PDGF) и трансформирующим фактором роста бета (TGFβ). [4] [5] Хотя нейропилины обычно обнаруживаются на поверхности клеток, они также были обнаружены в митохондриях и ядре. [6] [7] Оба члена семейства нейропилинов также могут быть обнаружены в растворимых формах, созданных путем альтернативного сплайсинга или путем отщепления эктодомена от поверхности клетки. [8] [9]
Плейотропная природа рецепторов NRP приводит к их участию в клеточных процессах, таких как наведение аксонов и ангиогенез , иммунный ответ и ремиелинизация . [10] Таким образом, нарушение регуляции активности NRP вовлечено во многие патологические состояния, включая многие типы рака и сердечно-сосудистые заболевания . [ 11] [12] [13] [14]
Приложения
Нейропилин-1 является терапевтическим целевым белком при лечении лейкемии и лимфомы , поскольку было показано, что наблюдается повышенная экспрессия нейропилина-1 в клеточных линиях лейкемии и лимфомы. [15] Также было обнаружено , что антагонизм нейропилина-1 подавляет миграцию и адгезию опухолевых клеток . [16]
Структура
Нейропилины содержат следующие четыре домена:
- N-концевой домен CUB (для комплемента C1r/C1s, Uegf, Bmp1)
- Фактор свертывания крови 5/8 типа, С-концевой ( дискоидиновый домен )
- Домен MAM (для меприна, белка A-5 и рецепторного белка-тирозинфосфатазы mu)
- С-концевой нейропилин
Структура домена B1 (тип фактора свертывания крови 5/8) нейропилина-1 была определена с помощью рентгеновской дифракции с разрешением 2,90 Å. Вторичная структура этого домена представляет собой 5% альфа-спирали и 46% бета-слоя . [1]
Ссылки
- ^ ab PDB : 3I97 ; Jarvis A, Allerston CK, Jia H, Herzog B, Garza-Garcia A, Winfield N, et al. (март 2010 г.). "Малые молекулярные ингибиторы взаимодействия нейропилина-1 с фактором роста эндотелия сосудов A (VEGF-A)". Journal of Medicinal Chemistry . 53 (5): 2215– 26. doi :10.1021/jm901755g. PMC 2841442 . PMID 20151671.
- ^ ab Pellet-Many C, Frankel P, Jia H, Zachary I (апрель 2008 г.). «Нейропилины: структура, функция и роль в болезнях». The Biochemical Journal . 411 (2): 211– 26. doi :10.1042/bj20071639. PMID 18363553.
- ^ ab Schwarz Q, Ruhrberg C (январь 2010 г.). «Нейропилин, ты должен мне знать: мне остаться или уйти?». Клеточная адгезия и миграция . 4 (1): 61– 6. doi :10.4161/cam.4.1.10207. PMC 2852559. PMID 20026901 .
- ^ Кофлер Н., Саймонс М. (май 2016 г.). «Расширяющаяся роль нейропилина: регуляция трансформирующего фактора роста-β и сигнализации тромбоцитарного фактора роста в сосудистой системе». Current Opinion in Hematology . 23 (3): 260– 7. doi : 10.1097 /moh.00000000000000233. PMC 4957701. PMID 26849476.
- ^ Рой С., Праманик А., Чакраборти Т., Чакраборти С. (2017). «Многогранная роль матричных металлопротеаз в заболеваниях человека». Протеазы при заболеваниях человека . Springer Singapore. стр. 21– 40. doi :10.1007/978-981-10-3162-5_2. ISBN 978-981-10-3161-8.
- ^ Issitt T, Bosseboeuf E, De Winter N, Dufton N, Gestri G, Senatore V и др. (январь 2019 г.). «Нейропилин-1 контролирует эндотелиальный гомеостаз, регулируя митохондриальную функцию и железозависимый окислительный стресс». iScience . 11 : 205– 223. Bibcode :2019iSci...11..205I. doi :10.1016/j.isci.2018.12.005. PMC 6327076 . PMID 30623799.
- ^ Mehta V, Fields L, Evans IM, Yamaji M, Pellet-Many C, Jones T и др. (август 2018 г.). «VEGF (фактор роста эндотелия сосудов) индуцирует расщепление NRP1 (нейропилина-1) с помощью ADAM (дезинтегрина и металлопротеиназы) 9 и 10 для генерации новых карбоксиконцевых фрагментов NRP1, которые регулируют ангиогенную сигнализацию». Артериосклероз, тромбоз и сосудистая биология . 38 (8): 1845– 1858. doi : 10.1161/ATVBAHA.118.311118. PMC 6092111. PMID 29880492 .
- ^ Rossignol M, Gagnon ML, Klagsbrun M (декабрь 2000 г.). «Геномная организация генов человеческого нейропилина-1 и нейропилина-2: идентификация и распределение вариантов сплайсинга и растворимых изоформ». Genomics . 70 (2): 211– 22. doi :10.1006/geno.2000.6381. PMID 11112349.
- ^ Werneburg S, Buettner FF, Erben L, Mathews M, Neumann H, Mühlenhoff M и др. (август 2016 г.). «Полисиалилирование и вызванное липополисахаридом выпадение лиганда-1 E-селектина и нейропилина-2 микроглией и макрофагами THP-1». Glia . 64 (8): 1314– 30. doi :10.1002/glia.23004. PMID 27159043. S2CID 3713077.
- ^ Mecollari V, Nieuwenhuis B, Verhaagen J (2014). «Взгляд на роль сигнализации семафорина класса III при травме центральной нервной системы». Frontiers in Cellular Neuroscience . 8 : 328. doi : 10.3389/fncel.2014.00328 . PMC 4209881. PMID 25386118 .
- ^ Niland S, Eble JA (февраль 2019 г.). «Нейропилины в контексте сосудистой сети опухолей». International Journal of Molecular Sciences . 20 (3): 639. doi : 10.3390/ijms20030639 . PMC 6387129. PMID 30717262 .
- ^ Кофлер Н., Саймонс М. (май 2016 г.). «Расширяющаяся роль нейропилина: регуляция трансформирующего фактора роста-β и сигнализации тромбоцитарного фактора роста в сосудистой системе». Current Opinion in Hematology . 23 (3): 260– 7. doi :10.1097/MOH.00000000000000233. PMC 4957701. PMID 26849476 .
- ^ Pellet-Many C, Mehta V, Fields L, Mahmoud M, Lowe V, Evans I и др. (ноябрь 2015 г.). «Нейропилины 1 и 2 опосредуют неоинтимальную гиперплазию и реэндотелизацию после повреждения артерий». Cardiovascular Research . 108 (2). Oxford University Press: 288– 98. doi :10.1093/cvr/cvv229. OCLC 927518632. PMC 4614691 . PMID 26410366.
- ^ Harman JL, Sayers J, Chapman C, Pellet-Many C (2020-07-21). «Возникающие роли нейропилина-2 при сердечно-сосудистых заболеваниях». Международный журнал молекулярных наук . 21 (14): 5154. doi : 10.3390/ijms21145154 . PMC 7404143. PMID 32708258 .
- ^ Карьялайнен К., Яалок Д.Э., Буэсо-Рамос CE, Зурита А.Дж., Куниясу А., Экхардт Б.Л. и др. (январь 2011 г.). «Нацеливание на нейропилин-1 при лейкемии и лимфоме человека». Кровь . 117 (3): 920–7 . doi :10.1182/blood-2010-05-282921. ПМЦ 3298438 . ПМИД 21063027.
- ^ Jia H, Cheng L, Tickner M, Bagherzadeh A, Selwood D, Zachary I (февраль 2010 г.). «Антагонизм нейропилина-1 в клетках человеческой карциномы ингибирует миграцию и усиливает химиочувствительность». British Journal of Cancer . 102 (3): 541– 52. doi : 10.1038/sj.bjc.6605539. PMC 2822953. PMID 20087344 .
Внешние ссылки
- Нейропилины в рубриках медицинских предметов Национальной медицинской библиотеки США (MeSH)