Андарин
 | |
| Клинические данные | |
|---|---|
| Другие имена | GTx-007; S-4; Ацетамидоксолутамид; Андроксолутамид; Ацетам-доксолутамид |
| код АТС |
|
| Правовой статус | |
| Правовой статус | |
| Идентификаторы | |
| |
| Номер CAS | |
| CID PubChem |
|
| ИУФАР/БПС |
|
| DrugBank | |
| ChemSpider | |
| УНИИ |
|
| ChEMBL | |
| Панель инструментов CompTox ( EPA ) |
|
| Информационная карта ECHA | 100.230.653 |
| Химические и физические данные | |
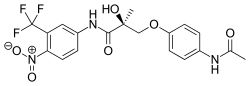
| Формула | С19Н18Ф3Н3О6 |
| Молярная масса | 441,363 г·моль −1 |
| 3D модель ( JSmol ) |
|
| |
 Н Н И (что это?) (проверить) И (что это?) (проверить) | |
Андарин (кодовые названия разработки GTx-007 , S-4 ) — селективный модулятор андрогеновых рецепторов (SARM), разработанный компанией GTX, Inc. для лечения таких состояний, как мышечная атрофия , остеопороз и доброкачественная гиперплазия предстательной железы (ДГПЖ) [1] с использованием нестероидного антиандрогена бикалутамида в качестве ведущего соединения. [2] Разработка андарина для всех показаний была прекращена в пользу структурно родственного и улучшенного соединения энобосарма (остарин; GTx-024; S-22). [3]
Андарин является перорально активным частичным агонистом андрогенового рецептора (AR). У интактных самцов крыс ежедневный прием 0,5 мг андарина снижает вес простаты до 79,4% и незначительно увеличивает вес мышцы levator ani . У кастрированных самцов крыс эта доза восстанавливает только 32,5% веса простаты, но 101% веса мышцы levator ani [4] Это говорит о том, что андарин способен конкурентно блокировать связывание дигидротестостерона с его рецепторными мишенями в предстательной железе, но его частичное агонистическое действие на андрогеновый рецептор предотвращает побочные эффекты, связанные с антиандрогенами, традиционно используемыми для лечения ДГПЖ. [5]
Андарин был впервые описан в литературе в 2002 году. [6] [7] [8] Он завершил первую фазу клинических испытаний при кахексии в 2003 году. [9] [10] Три фазы испытаний (1a, 1b, 1c) были завершены с препаратом, в которых приняли участие 86 здоровых добровольцев мужского и женского пола. [10] Вторая фаза испытаний была запланирована на 2004 год. [10] Однако разработка андарина была прекращена, как сообщается, из-за обнаружения нарушений зрения в клинических исследованиях. [3] [11] Считается, что андарин был первым SARM, который был включен в клинические испытания на людях. [12]
Смотрите также
Ссылки
- ^ Yin D, Gao W, Kearbey JD, Xu H, Chung K, He Y и др. (март 2003 г.). «Фармакодинамика селективных модуляторов андрогеновых рецепторов». Журнал фармакологии и экспериментальной терапии . 304 (3). Американское общество фармакологии и экспериментальной терапии (ASPET): 1334– 1340. doi : 10.1124/jpet.102.040840. PMID 12604714. S2CID 14724811.
- ^ Chen J, Kim J, Dalton JT (июнь 2005 г.). «Открытие и терапевтические перспективы селективных модуляторов андрогеновых рецепторов». Molecular Interventions . 5 (3): 173– 188. doi :10.1124/mi.5.3.7. PMC 2072877 . PMID 15994457.
- ^ ab "Andarine". AdisInsight . Springer Nature Switzerland AG.
- ^ G Gao W, Kearbey JD, Nair VA, Chung K, Parlow AF, Miller DD, Dalton JT (декабрь 2004 г.). «Сравнение фармакологических эффектов нового селективного модулятора андрогеновых рецепторов, ингибитора 5альфа-редуктазы финастерида и антиандрогена гидроксифлутамида у интактных крыс: новый подход к доброкачественной гиперплазии простаты». Эндокринология . 145 (12): 5420– 5428. doi : 10.1210/en.2004-0627. PMC 2098692. PMID 15308613.
- ^ Gao W, Kim J, Dalton JT (август 2006 г.). «Фармакокинетика и фармакодинамика лигандов нестероидных андрогеновых рецепторов». Pharmaceutical Research . 23 (8): 1641– 1658. doi :10.1007/s11095-006-9024-3. PMC 2072875. PMID 16841196 .
- ^ He Y, Yin D, Perera M, Kirkovsky L, Stourman N, Li W и др. (август 2002 г.). «Новые нестероидные лиганды с высокой связывающей способностью и мощной функциональной активностью для рецептора андрогена». European Journal of Medicinal Chemistry . 37 (8): 619– 634. doi :10.1016/s0223-5234(02)01335-1. PMID 12161060.
- ^ Yin D, Gao W, Kearbey JD, Xu H, Chung K, He Y и др. (март 2003 г.). «Фармакодинамика селективных модуляторов андрогеновых рецепторов». Журнал фармакологии и экспериментальной терапии . 304 (3): 1334– 1340. doi :10.1124/jpet.102.040840. PMID 12604714. S2CID 14724811.
- ^ Перера МА (2003). Фармакология, фармакокинетика и метаболизм нового нестероидного селективного модулятора андрогеновых рецепторов (диссертация на соискание степени доктора философии). OCLC 56700020. ProQuest 305301414.[ нужна страница ]
- ^ Mohler ML, Bohl CE, Jones A, Coss CC, Narayanan R, He Y и др. (июнь 2009 г.). «Нестероидные селективные модуляторы андрогеновых рецепторов (SARMs): разъединение анаболической и андрогенной активности андрогеновых рецепторов для терапевтического эффекта». Журнал медицинской химии . 52 (12): 3597– 3617. doi :10.1021/jm900280m. PMID 19432422.
Периферический и селективный анаболический доклинический фармакодинамический профиль 8 казался весьма многообещающим и 3602 Журнал медицинской химии, 2009, т. 52, No. 12 Award Address побудил нас продолжить знаковые клинические испытания SARMs, andarine 8 и Ostarine.75 Хотя исследования фазы I с 8 прошли успешно, без выявленных недостатков (пресс-релиз от 17 марта 2004 г.), Ostarine был выбран для продвинутой клинической разработки на основе корпоративной стратегии. Читатели должны обратить внимание на то, что название Ostarine часто ошибочно связывают с химической структурой 8, который также известен как andarine. Химическая структура Ostarine не была публично раскрыта. Авторы не могут предоставить дополнительную информацию.
- ^ abc "Form S-1: GTx, Inc". Комиссия по ценным бумагам и биржам США. 22 декабря 2003 г.
Клинические испытания. Мы завершили три клинических испытания Andarine I фазы с участием в общей сложности 86 здоровых мужчин и женщин-добровольцев. Мы проверили Andarine на безопасность и переносимость в однократных и многократных дозах. Результаты наших испытаний I фазы подтверждают эффективность перорального приема один раз в день, и никаких серьезных побочных эффектов не наблюдалось ни при одной испытанной однократной или многократных дозах. Мы наблюдали ранние признаки в клиническом испытании I фазы с многократным приемом у мужчин, что Andarine способствовал активности роста, измеряемой по уровням фактора роста в крови, известного как IGF-1, не влияя на сальные железы. Мы считаем, что эти наблюдения подтверждают потенциальную способность Andarine избирательно модулировать рецепторы андрогенов тканеспецифичным образом.
- ^ Starcevic B, Ahrens BD, Butch AW (май 2013 г.). «Обнаружение селективного модулятора андрогеновых рецепторов S-4 (Andarine) в образце допинг-контроля». Drug Testing and Analysis . 5 (5): 377– 379. doi :10.1002/dta.1466. PMID 23427117.
S-4 [Andarine, S3-(4-ацетиламино-фенокси)-2-гидрокси-2-метил-N-(4-нитро-3-трифторметил-фенил)-пропионамид] член класса арилпропионамидов SARMs был оценен в клиническом исследовании фазы I, но исследование пришлось остановить из-за неблагоприятных побочных эффектов, включая нарушения зрения.[3]
- ^ "Форма 8-K". Комиссия по ценным бумагам и биржам США. 3 марта 2004 г. – через Oncternal Therapeutics, Inc.
Мы считаем, что Андарин представляет собой первый SARM, прошедший клинические испытания на людях.