Паравольфрамат аммония
 | |
| Идентификаторы | |
|---|---|
| ChemSpider | |
| Информационная карта ECHA | 100.031.228 |
| Номер ЕС |
|
CID PubChem |
|
| УНИИ | |
Панель инструментов CompTox ( EPA ) |
|
| |
| Характеристики | |
| ( NH4 ) 10 ( H2W12O42 ) · 4H2O | |
| Молярная масса | 3132,2 г/моль |
| Появление | Белое твердое вещество |
| Плотность | 4,60 г/см 3 [1] |
| Точка кипения | Разлагается при 600 °C. |
| Опасности | |
| Маркировка СГС : | |
 | |
| Предупреждение | |
| Н315 , Н319 , Н335 | |
| Р261 , Р264 , Р271 , Р280 , Р302+Р352 , Р304+Р340 , Р305+Р351+Р338 , Р312 , Р321 , Р332+Р313 , Р337+Р313 , Р362 , Р403+Р233 , Р405 , Р501 | |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |
Паравольфрамат аммония (или APT) представляет собой белую кристаллическую соль с химической формулой (NH4 ) 10 ( H2W12O42 ) · 4H2O . Он описывается как « важнейшее сырье для всех других вольфрамовых продуктов». [2]
Производство
Из вольфрамовых руд
Вольфрамовые руды, которые обычно являются оксидами , перевариваются в щелочи, чтобы получить растворы вольфрамата вместе со многими загрязняющими видами. Этот сырой экстракт подкисляется и обрабатывается сульфидом для отделения трисульфида молибдена . При дальнейшем подкислении APT в конечном итоге кристаллизуется. [2]
Лабораторные методы
Если используется прокаленный WO3 , то для ускорения его растворения рекомендуется кипятить раствор аммиака .
Превращение в металлический вольфрам
Нагревание паравольфрамата аммония до температуры его разложения 600 °C приводит к образованию оксида вольфрама (VI) , как описано в этом идеализированном уравнении:
- ( NH4 ) 10 ( H2W12O42 ) · 4H2O → 12WO3 + 10NH3 + 6H2O
Затем триоксид нагревают в атмосфере водорода , получая элементарный вольфрам: [3]
- WO3 + 3H2 → W + 3H2O
Структура
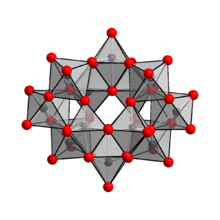
Было показано, что анион в (NH 4 ) 10 (W 12 O 41 ) · 5H 2 O представляет собой [H 2 W 12 O 42 ] 10− , содержащий два атома водорода , удерживая два атома водорода внутри клетки. [1] Поэтому правильное обозначение формулы для паравольфрамат аммония — (NH 4 ) 10 [H 2 W 12 O 42 ] · 4H 2 O. Ион [H 2 W 12 O 42 ] 10− известен как ион паравольфрамат B, в отличие от иона паравольфрамат A, который имеет формулу [W 7 O 24 ] 6− , похожую на ион парамолибдата. Однако существование иона паравольфрамат A не может быть подтверждено с помощью ЯМР-спектроскопии. [4]
Примерно до 1930 года существовали некоторые споры о точном составе соли, и были предложены как (NH 4 ) 10 W 12 O 41 , так и (NH 4 ) 6 W 7 O 24 . О. У. Гиббс заметил по этому поводу:
- «Щелочные вольфраматы многочисленны и необычайно сложны. Соли существенно различных формул настолько близки по процентному составу, что различия лежат очень близко к неизбежным ошибкам анализов. Анализы едва ли достаточно близки, чтобы решить вопрос на чисто аналитических основаниях». [5]
Другие гидраты
При концентрировании аммиачного раствора вольфрамовой кислоты (т.е. водного WO3 ) получается паравольфрамат аммония. Ниже 50 °C образуется гексагидрат , тогда как при температуре раствора выше 50 °C образуется пентагидрат или гептагидрат. Первый кристаллизуется в виде триклинных пластин или призм, тогда как последний — в виде псевдоромбических игл. Тетрагидрат наиболее важен в коммерческом смысле. Также известен:
- декагидрат [6]
- нонагидрат
Ссылки
- ^ Аб д'Амур, Хедвиг; Аллманн, Рудольф (1972). «Кристаллическая структура аммонийпаравольфрамат-тетрагидратов (NH 4 ) 10 [H 2 W 12 O 42 ] · 4H 2 O». Zeitschrift für Kristallographie . 136 ( 1– 2): 23– 47. Бибкод : 1972ZK....136...23D. дои :10.1524/zkri.1972.136.1-2.23.
- ^ аб Ласснер, Эрик; Шуберт, Вольф-Дитер; Людериц, Эберхард; Вольф, Ханс Уве. «Вольфрам, вольфрамовые сплавы и вольфрамовые соединения». Энциклопедия промышленной химии Ульмана . Вайнхайм: Wiley-VCH. дои : 10.1002/14356007.a27_229. ISBN 978-3-527-30673-2.
- ^ DJ Jones, «Практические аспекты спекания вольфрама и молибдена» (согласно ссылке в Comprehensive Inorganic Chemistry , JC Bailar Jr. et al., стр. 744, т. 3, 1-е издание 1973 г.)
- ↑ Гринвуд и Эрншоу, Химия элементов , 2-е изд. 1997, стр. 1012–1014.
- ^ JW Mellor: Неорганическая и теоретическая химия , т. XI, стр. 812–813, Longmans Green & Co. 1931
- ^ Аллманн, Р. (1971). «Die Struktur des Ammoniumparawolframates (NH4) 10 [H 2 W 12 O 42 ]. 10H 2 O». Acta Crystallographica Раздел B. 27 (7): 1393–1404 . doi : 10.1107/S0567740871004047.


