Алифатическое соединение
Эта статья в значительной степени или полностью основана на одном источнике . ( октябрь 2022 г. ) |


В органической химии углеводороды ( соединения , состоящие исключительно из углерода и водорода ) делятся на два класса: ароматические соединения и алифатические соединения ( / ˌ æ l ɪ ˈ f æ t ɪ k / ; G. aleiphar , жир, масло). Алифатические соединения могут быть насыщенными (в которых все связи CC являются одинарными, требующими завершения структуры, или «насыщения», водородом), как гексан , или ненасыщенными, как гексен и гексин . Соединения с открытой цепью , будь то прямые или разветвленные, и которые не содержат колец какого-либо типа, всегда являются алифатическими. Циклические соединения могут быть алифатическими, если они не являются ароматическими . [1]
Структура
Алифатические соединения могут быть насыщенными , соединенными одинарными связями ( алканы ), или ненасыщенными, с двойными связями ( алкены ) или тройными связями ( алкины ). Если другие элементы ( гетероатомы ) связаны с углеродной цепью , наиболее распространенными из которых являются кислород , азот , сера и хлор , это уже не углеводород, и, следовательно, уже не алифатическое соединение. Однако такие соединения все еще могут называться алифатическими, если углеводородная часть молекулы является алифатической, например, алифатические амины , чтобы отличать их от ароматических аминов .
Наименее сложным алифатическим соединением является метан (CH4 ) .
Характеристики
Большинство алифатических соединений являются горючими , что позволяет использовать углеводороды в качестве топлива , например, метан в природном газе для печей или отопления; бутан в горелках и зажигалках ; различные алифатические (а также ароматические) углеводороды в жидком транспортном топливе, таком как бензин , дизельное топливо и реактивное топливо ; и другие виды использования, например, этин (ацетилен) при сварке .
Примеры алифатических соединений
Наиболее важными алифатическими соединениями являются:
- н-, изо- и циклоалканы (насыщенные углеводороды)
- н-, изо- и циклоалкены и -алкины (непредельные углеводороды).
Важные примеры низкомолекулярных алифатических соединений можно найти в списке ниже (отсортированном по числу атомов углерода):
| Формула | Имя | Структурная формула | Химическая классификация |
|---|---|---|---|
| Гл 4 | Метан | 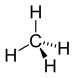 | Алкан |
| С2Н2 | Ацетилен |  | Алкин |
| С2Н4 | этилен | 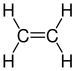 | Алкен |
| С2Н6 | Этан |  | Алкан |
| С3Н4 | Пропин |  | Алкин |
| С3Н6 | Пропен | 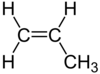 | Алкен |
| С 3 Н 8 | Пропан |  | Алкан |
| С4Н6 | 1,2-бутадиен |  | Диен |
| С4Н6 | 1-Бутин |  | Алкин |
| С4Н8 | 1-Бутен |  | Алкен |
| С4Н10 | Бутан | 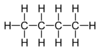 | Алкан |
| С 6 Н 10 | Циклогексен |  | Циклоалкен |
| С 5 Н 12 | н -пентан |  | Алкан |
| С 7 Н 14 | Циклогептан | 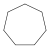 | Циклоалкан |
| С 7 Н 14 | Метилциклогексан | 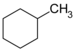 | Циклогексан |
| С 8 Н 8 | Кубанский |  | Призман , Платоновый углеводород |
| С 9 Н 20 | Нонан | 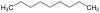 | Алкан |
| С 10 Н 12 | Дициклопентадиен |  | Диен, циклоалкен |
| С 10 Н 16 | Фелландрен |   | Терпен , диен, циклоалкен |
| С 10 Н 16 | α-Терпинен |  | Терпен, диен, циклоалкен |
| С 10 Н 16 | Лимонен |  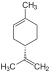 | Терпен, диен, циклоалкен |
| С 11 Н 24 | Ундекан |  | Алкан |
| С 30 Н 50 | Сквален |  | Терпен, полиен |
| С2н Н4н | Полиэтилен |  | Алкан |
Ссылки
- ^ IUPAC , Compendium of Chemical Terminology , 2nd ed. («Золотая книга») (1997). Онлайн-исправленная версия: (1995) «алифатические соединения». doi :10.1351/goldbook.A00217

