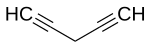
1,4-Пентадиин
 | |
 | |
| Имена | |
|---|---|
| Название ИЮПАК Пента-1,4-диин | |
| Идентификаторы | |
3D модель ( JSmol ) |
|
| ChemSpider |
|
CID PubChem |
|
Панель инструментов CompTox ( EPA ) |
|
| |
| |
| Характеристики | |
| С 5 Н 4 | |
| Молярная масса | 64,087 г·моль −1 |
| Появление | бесцветная жидкость [1] |
| Температура плавления | −21 – −19 °C (−6 – −2 °F; 252–254 K) [1] |
| Точка кипения | 61–64 °C (142–147 °F; 334–337 K) [2] |
Показатель преломления ( nD ) | 1,4283 (23 °С) [2] |
| Структура [3] | |
| 0,516 Д | |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |
1,4-Пентадиин ( пента-1,4-диин ) — химическое соединение, относящееся к алкинам . Соединение является структурным изомером 1,3-пентадиина.
Подготовка
До конца 1960-х годов не было описано ни одного успешного синтеза этой, казалось бы, просто приготовляемой молекулы. Хотя длинноцепочечные и более сложные 1,4-диины были успешно синтезированы ранее, [4] подходы к синтезу, начинающиеся с ацетилида натрия или ацетиленового реактива Гриньяра и пропаргилбромида или метиленхлорида, не увенчались успехом, даже с включением хлорида меди(I) . [5] [1] В основном 1,3-пентадиин был получен как продукт перегруппировки. [1]
Первая успешная изоляция реагировала пропаргилбромидом и этинилмагнийбромидом с катализатором хлоридом меди(I) в ТГФ . Это дало 70% выход в растворе, но продукт было трудно отделить от растворителя. По сравнению с предыдущими попытками, успешный подход включал дополнительный раунд флэш-дистилляции и газожидкостной хроматографии дистиллята. [1] [2]
Улучшенный метод синтеза был опубликован Веркруйссе и Хасселаром в 1979 году. Хлорид меди был заменен бромидом меди(I), а пропаргилбромид — пропаргилтозилатом. При более низких температурах реакции и меньшем количестве побочных продуктов алкин был получен после многоступенчатой экстракции . По мнению авторов публикации, это позволило обойти проблему, заключающуюся в том, что растворитель ТГФ и основное соединение имеют схожие температуры кипения. [2]

Более того, мгновенный вакуумный пиролиз, начинающийся с 3-этинилциклопроп-1-ена при 550 °C, дает соединение и пента-1,2-диен-4-ин в качестве побочного продукта. [6]

Альтернативно возможно фотолитическое разложение циклопентадиенилидена посредством УФ-излучения . [7]
Соединения образуются также в ходе экзотермической реакции аллена и этинильного радикала. Эта реакция представляет интерес в основном для астрохимии . [8] [9] [10]
Характеристики
При комнатной температуре вещество меняет цвет с бесцветной на желтоватую жидкость, однако хранение в разбавленных растворах при 0 °C возможно в течение нескольких недель. [1]
В то время как для 1,4-пентадиена sp 2 - гибридизация приводит к углу связи 120° между одинарной и двойной связью, в 1,4-пентадиине это угол 180° из-за sp-гибридной орбитали. Обе тройные связи в 1,4-положении дестабилизируют друг друга согласно другому исследованию на 3,9 ккал · моль −1 , постулируется отталкивание между p-орбитальными лепестками вблизи sp 3 -гибридизованного углерода. [11] Согласно расчету QCSID(T) , алкин дестабилизирован относительно 1,3-пентадиина на 25 ккал · моль −1 . [12]
Хотя микроволновая спектроскопия не выявила никаких существенных искажений по сравнению с идеальным тетраэдром, кроме дипольного момента 0,516 D , для π-системы сообщалось о трех различных энергиях ионизации. [3]
Использование
1,4-пентадиин является распространенным исходным материалом для синтеза гетеробензолов, таких как стиба- , арса- и фосфабензол , а также их замещенных производных. [13] [14]

Ссылки
- ^ abcdef DA Ben-Efraim; F. Sondheimer (1969). «Синтез и некоторые реакции ряда «пропущенных» полиацетиленов, содержащих концевые ацетиленовые группы». Tetrahedron . 25 (14): 2823– 2835. doi :10.1016/0040-4020(69)80026-8.
- ^ abcd HD Verkruijsse; M. Hasselaar (1974). "Улучшенный синтез 1,4-диинов". Синтез . 4 (4): 292– 293. doi :10.1055/s-1979-28653. S2CID 95166709.
- ^ ab Robert L. Kuczkowski; Frank J. Lovas; RD Suenram (1981). "Микроволновый спектр, структура и дипольный момент 1,4-пентадиина". J. Mol. Struct. 72 : 143– 152. Bibcode :1981JMoSt..72..143K. doi :10.1016/0022-2860(81)85014-4. hdl : 2027.42/24440 .
- ^ H. Taniguchi; IM Mathai; SI Miller (1966). «Синтез и спектральные свойства 1,4- и 1,3-пентадиинов». Tetrahedron . 22 (3): 867– 878. doi :10.1016/0040-4020(66)80058-3.
- ^ JM Todd (1961). Попытка приготовления 1,4-пентадиина (МА). Бостонский университет. hdl :2144/18627.
- ^ ab Майкл М. Хейли; Блюграсс Биггс; Уилл А. Луни; Роберт Д. Гилбертсон (1995). «Синтез алкенил- и алкинилциклопропенов». Tetrahedron Lett. 36 (20): 3457– 3460. doi :10.1016/0040-4039(95)00634-O.
- ^ G. Maier; J. Endres (2000). «Фотохимия матрично-изолированного циклопентадиенилидена снова». J. Mol. Struct. 556 ( 1– 3): 179– 187. Bibcode :2000JMoSt.556..179M. doi :10.1016/S0022-2860(00)00631-1.
- ^ Фантун Чжан; Соль Ким; Ральф И. Кайзер (2009). «Исследование реакции этинильного радикала (C 2 H(X 2 Σ + )) с алленом (H 2 CCCH 2 (X 1 A 1 )) с помощью скрещенных молекулярных пучков». Phys. Chem. Chem. Phys. 11 (23): 4707– 4714. Bibcode :2009PCCP...11.4707Z. doi :10.1039/B822366A. PMID 19492123.
- ^ F. Stahl; P. v. R. Schleyer; HF Schaefer III; RI Kaiser (2002). «Реакции этинильных радикалов как источника углеводородов C 4 и C 5 в атмосфере Титана». Planet. Space Sci. 50 ( 7– 8): 685– 692. Bibcode :2002P&SS...50..685S. doi :10.1016/S0032-0633(02)00014-4.
- ^ Fabien Goulay; Satchin Soorkia; Giovanni Meloni; David L. Osborn; Craig A. Taatjes; Stephen R. Leone (2011). «Обнаружение пентатетраена реакцией этинильного радикала (C 2 H) с алленом (CH 2 =C=CH 2 ) при комнатной температуре». Phys. Chem. Chem. Phys . 13 (46): 20820– 20827. doi :10.1039/C1CP22609F. PMID 22002654.
- ^ Дональд В. Роджерс; Никита Мацунага; Фрэнк Дж. Маклафферти; Андреас А. Завитсас; Джоэл Ф. Либман (2004). «Об отсутствии стабилизации сопряжения в полиинах (полиацетиленах)». J. Org. Chem. 69 (21): 7143– 7147. doi :10.1021/jo049390o. PMID 15471463.
- ^ Нильс Хансен; Стивен Дж. Клиппенштейн; Джеймс А. Миллер; Хуан Ванг; Террилл А. Кул; Мэтью Э. Лоу; Филипп Р. Уэстморленд; Тина Каспер; Катарина Кохсе-Хёингхаус (2006). «Идентификация изомеров C 5 H x в богатых топливом пламенах с помощью фотоионизационной масс-спектрометрии и расчетов электронной структуры». J. Phys. Chem. A . 110 (13): 4276– 4388. Bibcode :2006JPCA..110.4376H. doi :10.1021/jp0569685. PMID 16571041.
- ^ Артур Дж. Эш III (1978). «Гетеробензолы группы 5». Acc. Chem. Res. 11 (4): 153– 157. doi :10.1021/ar50124a005.
- ^ Артур Дж. Эш III; Вун-Тунг Чан (1979). «Подготовка 2-замещенных арсабензов». J. Org. Chem. 44 (9): 1409– 1413. doi :10.1021/jo01323a010.
