ЙО-ЙО-1
 | |
| Имена | |
|---|---|
| Предпочтительное название ИЮПАК [1 2 (2) Z ,16(17 2 ) Z ]-1 3 ,7,7,11,11,17 3 -Гексаметил-1 3 H ,17 3 H -7,11-диаза-3 1 λ 5 ,15 1 λ 5 -3(4,1),15(1,4)-дихинолин-1,17(2)-бис([1,3]бензоксазола)гептадекафан-1 2 (2),16(17 2 )-диен-7,11-диий-3 1,15 1 -бис (илий) тетраиодид | |
| Другие имена ЙО-ЙО, ЙО-ЙО-1, ЙО-ЙО-1 | |
| Идентификаторы | |
3D модель ( JSmol ) |
|
| ЧЭБИ |
|
| ChemSpider |
|
CID PubChem |
|
| УНИИ | |
Панель инструментов CompTox ( EPA ) |
|
| |
| |
| Характеристики | |
| С49Н58Я4Н6О2 | |
| Молярная масса | 1270,642 г/моль |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |
YOYO-1 — это зеленый флуоресцентный краситель , используемый при окрашивании ДНК . [1] Он принадлежит к семейству монометиновых цианиновых красителей и представляет собой тетракатионный гомодимер оксазолового желтого (сокращенно YO, отсюда и название YOYO), обычно доступный в виде тетрайодидной соли. В водном буфере свободный краситель YOYO-1 (поглощение: λ max 458 нм, испускание: λ max 564 нм) имеет очень низкий квантовый выход флуоресценции . Однако интенсивность флуоресценции увеличивается в 3200 раз при связывании посредством бис-интеркаляции с двухцепочечной ДНК (поглощение: λ max 489 нм, испускание: λ max 509 нм). [2]
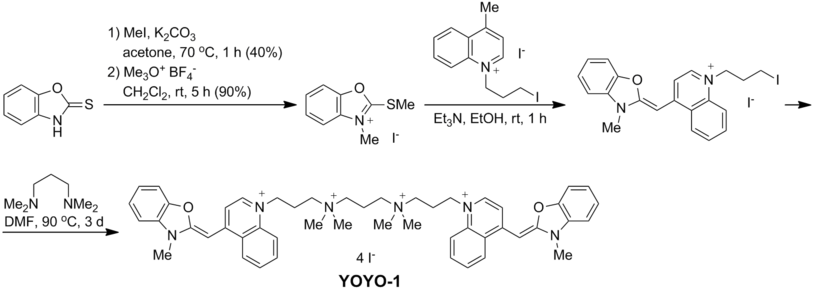
Синтез
YOYO-1 получают путем алкилирования N , N , N ′, N′ -тетраметил-1,3-пропандиамина с 2 эквивалентами N- (3-йодопропил) аналога оксазолового желтого, [2] , который можно получить в три этапа из 2-меркаптобензоксазола: [3]
Фотофизика
Молярный коэффициент затухания на пике поглощения YOYO-1 составляет около 10 5 см −1 М −1 , что является одним из высоких значений типичных органических красителей. Квантовый выход флуоресценции YOYO-1 в воде очень мал (<0,1%) и, таким образом, нефлуоресцентен. При связывании с ДНК его квантовый выход увеличивается >1000 раз и достигает 50% среди самых ярких флуоресцентных органических красителей.
При световом возбуждении наблюдается фотомерцание и фотообесцвечивание YOYO-1 в ДНК. Последнее также считается причиной фоторасщепления молекул ДНК хозяина путем генерации реактивных свободных радикалов.
В литературе были предложены два основных механизма, объясняющих, почему YOYO-1 не флуоресцирует в полярных растворителях, но флуоресцирует при интеркалировании в пары оснований ДНК. Первый — внутримолекулярный перенос заряда, а второй — межмолекулярный перенос заряда. Оба механизма все еще активно изучаются, какой из них доминирует.
Механизм внутримолекулярного переноса заряда был установлен около 1980-х годов. При освещении светом в воде возбужденный электрон в молекуле смещает свою вероятность через метиновую группу, что позволяет молекуле вращаться вместе с метиновой группой, реакция фотоизомеризации . Это вращение релаксирует энергию безызлучательно, поэтому молекула не флуоресцентна. Однако, когда YOYO-1 интеркалируется в пары оснований ДНК, он застревает и не может вращаться. Таким образом, молекула остается флуоресцентной. Основным доказательством является то, что при увеличении вязкости раствора путем охлаждения и увеличения содержания глюкозы в смешанном растворе квантовый выход YOYO-1 увеличивается.
Механизм межмолекулярного переноса заряда был предложен в 2018 году. [4] YOYO-1 слабо связан с молекулами полярного растворителя. Когда он возбуждается светом, в молекуле создается пара электрон-дырка. Дырка способна получить дополнительный электрон из растворителя, который создал отрицательно заряженный радикал YOYO-1 и положительно заряженный радикал в растворе. В большинстве случаев радикалы нейтрализуют друг друга очень быстро и безызлучательно. Это процесс переноса электронов Декстера , который гасит флуоресценцию и создает вращение молекулы YOYO-1. Таким образом, вращение является продуктом гашения, а не причиной гашения, предложенного в механизме внутримолекулярного переноса заряда. Существует небольшая вероятность того, что радикалы разделятся и диффундируют, что затем делает молекулу YOYO-1 восприимчивой к фотообесцвечиванию. Когда молекулы YOYO-1 интеркалируются в молекулу ДНК, гидрофобные пары оснований значительно уменьшают образование радикалов, поскольку ДНК является плохим проводником электричества. Таким образом, флуоресцентное тушение растворителем значительно уменьшается. Небольшое количество протекающих зарядов создает долгоживущие радикалы и разрезает остовы ДНК, что приводит к фоторасщеплению ДНК. Этот механизм был поддержан данными фемтосекундной сверхбыстрой транзиентной абсорбционной спектроскопии.
Если внутримолекулярный механизм переноса заряда доминирует над флуоресцентным тушением YOYO-1 в воде, то можно добавить объемный лиганд, чтобы остановить или замедлить вращение, чтобы увеличить его квантовый выход в воде. Однако, если доминирует межмолекулярный перенос заряда, можно модифицировать молекулу, чтобы остановить перенос заряда между YOYO-1 и водой, либо путем пассивации заряда, либо путем модификации лиганда, чтобы сместить его окислительно-восстановительные потенциалы.
Приложения
Основные применения YOYO-1 — окрашивание ДНК. При нормальных условиях и уровне pH четыре положительных заряда каждой молекулы YOYO-1 позволяют очень легко связываться с молекулами ДНК, имеющими отрицательно заряженные остовы. Затем краситель легко интеркалирует в ДНК либо с одного конца, либо с двух концов в зависимости от температуры отжига и доступного пространства. Затем ДНК загорается под флуоресцентным микроскопом с очень небольшим фоном от несвязанного YOYO-1. Измерение может проводиться на уровне ансамбля в целом или на уровне отдельных молекул. Последнее позволило достичь сверхвысокого разрешения с использованием микроскопии сверхвысокого разрешения . [5] Известно, что при высокой мощности освещения краситель генерирует свободные радикалы, которые затем фоторасщепляют цепи ДНК.
Ссылки
- ^ Беннинк, ML; Шерер, OD; Канаар, R; Саката-Согава, K; и др. (июнь 1999 г.). «Манипуляция одиночными молекулами двухцепочечной ДНК с использованием оптического пинцета: исследования взаимодействия ДНК с RecA и YOYO-1». Цитометрия Часть A. 36 ( 3): 200–208 . doi : 10.1002/(SICI)1097-0320(19990701)36:3<200::AID-CYTO9>3.0.CO;2-T . PMID 10404969.
- ^ ab Rye, HS; Yue, S; Wemmer, DE; Quesada, MA; et al. (1992). "Стабильные флуоресцентные комплексы двухцепочечной ДНК с бис-интеркалирующими асимметричными цианиновыми красителями: свойства и применение". Nucleic Acids Research . 20 (11): 2803– 2812. doi :10.1093/nar/20.11.2803. PMC 336925. PMID 1614866 .
- ^ WO 2010141833, Ли Джозефсон; Элизабет Гаранжер и Скотт Хильдербранд и др., «Жизненно важные конъюгаты флуорохрома и методы их использования», опубликовано 2010-12-09, передано The General Hospital Corp.
- ^ Wang, L; Pyle, JR; Cimatu, KA; Chen, J (1 декабря 2018 г.). «Спектры сверхбыстрого кратковременного поглощения фотовозбужденных молекул YOYO-1 требуют дополнительных исследований механизма тушения их флуоресценции». Журнал фотохимии и фотобиологии A: Химия . 367 : 411– 419. doi : 10.1016/j.jphotochem.2018.09.012. PMC 6217845. PMID 30410276 .
- ^ Пайл, Джозеф Р.; Чен, Цзисинь (2 ноября 2017 г.). «Фотообесцвечивание YOYO-1 в сверхвысоком разрешении флуоресцентной визуализации одиночной ДНК». Журнал нанотехнологий Beilstein . 8 : 2296–2306 . doi :10.3762/bjnano.8.229. PMC 5687005. PMID 29181286 .
