Ванкозамин
 Циклогексан и стул, изображающие ванкозамин (вверху) и эпиванкозамин (внизу). Обратите внимание на разный стереоцентр у углерода 4. | |
| Имена | |
|---|---|
| Название ИЮПАК (3 S ,4 S ,5 S )-3-амино-4,5-дигидрокси-3-метилгексаналь | |
| Другие имена 3-Амино-2,3,6-тридезокси-3-метил- L - ликсо -гексопираноза | |
| Идентификаторы | |
| |
3D модель ( JSmol ) |
|
| ChemSpider |
|
CID PubChem |
|
Панель инструментов CompTox ( EPA ) |
|
| |
| |
| Характеристики | |
| С7Н15Н3 | |
| Молярная масса | 161,201 г·моль −1 |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |
Ванкозамины — это аминосахара , которые являются частью ванкомицина и других молекул в семействе антибиотиков ванкомицина. Синтез ванкозамина кодируется биосинтетическим кластером ванкомицина ( vps ). Эпиванкозамин, близкородственный аминосахар, кодируется биосинтетическим кластером хлорэремомицина ( cep ). [1]
История
Ванкозамин был впервые выделен Ломакиной и др. в 1968 году. [2] В 1972 году Джонсон и др. были первыми, кто идентифицировал и полностью охарактеризовал ванкозамин. [3] Эпиванкозамин был впоследствии выделен в 1988 году Хантом и др. в Eli Lilly [4]
Биосинтез
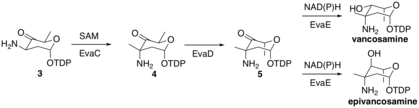
Биосинтез ванкозамина и эпиванкозамина идентичен, за исключением последнего шага. [5] Ферменты, катализирующие реакции, были обозначены как EvaA-E. Молекула TDP-D-глюкозы попадает в путь через преобразование в молекулу 1 ферментом оксидоредуктазой, а затем ферментом дегидратазой. На следующем этапе EvaA дегидратирует молекулу 1 путем депротонирования при 3-C с образованием енолята, который затем устраняет 2-OH с образованием молекулы 2. Молекула 2 трансформируется в молекулу 3 путем таутомеризации в ее кето-форму, а затем трансаминируется EvaB с использованием L-Glu в качестве источника аммиака и PLP в качестве кофактора.
Затем EvaC метилирует молекулу 3 в положении 3-C, образуя молекулу 4 путем депротонирования с образованием енолятного промежуточного соединения, которое затем атакует метильную группу SAM в активном центре EvaC. Затем EvaD эпимеризует молекулу 4 в положении 5-C, образуя молекулу 5. Наконец, EvaE может образовывать либо эпи/ванкозамин путем восстановления с использованием либо NADH , либо NADPH для восстановления карбонила в положении 4-C. Стереохимический результат зависит от EvaE, который закодирован в биосинтетическом кластере. Vancomycin vps EvaE приводит к образованию ванкозамина, тогда как chloroeremomycin cep EvaE приводит к образованию эпиванкозамина.
Ванкозамины затем используются клеткой для синтеза ванкомицина и родственных молекул. Гликозилтрансфераза присоединяет аминосахар через α-1 эфирные связи.
Возможны дополнительные модификации в аминогруппе 3-C для создания N -алкильных или N -ацильных производных этого сахара.
Всего синтезов
Было опубликовано несколько синтезов ванкозамина. [6] [7] [8]
Смотрите также
Ссылки
- ^ Йим, Г., Такер, М. Н., Котева, К., Райт, Г. «Биосинтез гликопептидных антибиотиков». Журнал антибиотиков , 2017 , 67 , 31-41.
- ^ Ломакина Н.Н., Спиридонова И.А., Богнар Р., Пуксас М., Штарицкая Ф. Антибиотики . 1968, 13 , 975.
- ^ Джонсон, AW, Смит, RM, Гатри, RD «Ванкозамин: структура и конфигурация нового аминосахара из ванкомицина». JCS Perkin I , 1972, 2153-2159.
- ^ Хант, AH, Моллой, RM, Дебоно, M., Окколовиц, JL «Выделение и характеристика 4-эпи-ванкозамина». Tetrahedron Lett , 1988, 29 , 1223-1226.
- ^ Чен, Х., Томас, МГ, Хаббард, БК, Лоузи, ХК, Уолш, КТ, Беркарт, МД «Дезоксисахара в гликопептидных антибиотиках: ферментативный синтез TDP-L-эпиванкозамина в биосинтезе хлорэремомицина». PNAS , 2000 , 97 (22), 11942-11947
- ^ Хаузер, Ф. М., Элленбергер, С. Р., Глускер, Дж. П., Смарт, Ф. Дж., Каррелл, Х. Л. «Стереоселективные синтезы +/- даунозамина, +/- ванкозамина и +/- ристозамина из ациклических предшественников». J. Org. Chem. 1986 , 51 , 50-57.
- ^ Николау, К. К., Митчелл, Х. Дж., ван Делфт, Ф. Л., Рубсам, Ф., Родригрус, Р. М. «Быстрые пути получения производных эвернитрозы и ванкозамина и синтеза или модельного арилгликозида ванкомицина». Angew. Chem. Int. Ed. 1998 , 37 , № 13/14, 1871-1874.
- ^ Паркер, КА, Чанг, В. «Синтез производных L-ванкозамина из неуглеводных предшественников с помощью короткой последовательности, основанной на реакциях Маршалла, Макдональда и Дюбуа». Org. Lett. 2003 , 5 (21), 3891-3893.