Реакция Типсона-Коэна
Реакция Типсона-Коэна — это реакция, впервые открытая Стюартом Типсоном и Алексом Коэном в Национальном бюро стандартов в Вашингтоне, округ Колумбия [1]. Реакция Типсона-Коэна происходит, когда две соседние вторичные сульфонилоксигруппы в молекуле сахара обрабатываются цинковой пылью (Zn) и иодидом натрия (NaI) в кипящем растворителе, таком как N , N -диметилформамид (ДМФА), с получением ненасыщенного углевода. [2]
Фон
Ненасыщенные углеводы востребованы, поскольку они являются универсальными строительными блоками, которые можно использовать в различных реакциях. [2] Например, их можно использовать в качестве промежуточных продуктов в синтезе природных продуктов, или в качестве диенофилов в реакции Дильса-Альдера, или в качестве предшественников в синтезе олигосахаридов. [3] Реакция Типсона-Коэна проходит через механизм син- или антиэлиминирования , чтобы получить алкен с высокими или умеренными выходами. [4] Реакция зависит от соседних заместителей. Механизм для глюкопиранозидов и манноиранозидов показан ниже. [4]
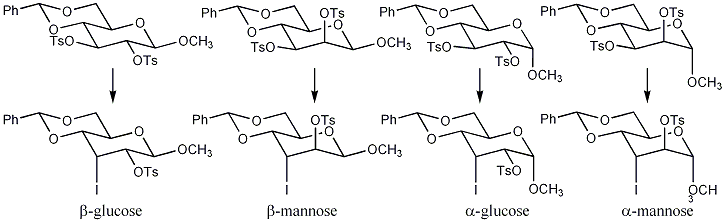
Схема 1: Син- элиминирование происходит с глюкопиранозидами. Галактопиранозиды следуют аналогичному син-механизму. [3] В то время как анти -элиминирование происходит с маннопиранозидами. [4] Обратите внимание, что R может быть метансульфонилом CH 2 O 2 S (Ms) или толуолсульфонилом CH 3 C 6 H 4 O 2 S (Ts).
Механизм реакции
Схема 3: Схема иллюстрирует первое замещение, этап, определяющий скорость, и самый медленный этап, где исходный материал преобразуется в йод-промежуточный продукт. [4] Промежуточный продукт не обнаруживается, поскольку он быстро преобразуется в ненасыщенный сахар. Эксперименты с азидом вместо йодида подтвердили, что атака происходит в положении C-3, поскольку были выделены азот-промежуточные продукты. Порядок реакционной способности от наиболее реакционноспособных к наименее реакционноспособным следующий: β-глюкопиранозиды > β-маннопиранозиды > α-глюкопиранозиды > α-маннопиранозиды.
Реакция β-маннопиранозидов дает низкие выходы и требует более длительного времени реакции, чем с β-глюкопиранозидами из-за наличия соседнего аксиального заместителя (сульфонилокси) относительно C-3 сульфонилокси группы в исходном материале. [4] Аксиальный заместитель увеличивает стерические взаимодействия в переходном состоянии, вызывая неблагоприятное затмение двух сульфонилокси групп. α-Глюкопиранозиды обладают β- транс -аксиальным заместителем относительно C-3 сульфонилокси (аномерная группа OCH 3 ) в исходном материале. β -транс -аксиальный заместитель влияет на переходное состояние, также вызывая неблагоприятное стерическое взаимодействие между двумя группами. В случае α-маннопиранозидов присутствуют как соседний аксиальный заместитель (2-сульфонилоксигруппа), так и β- транс -аксиальный заместитель (аномерная группа OCH 3 ), что значительно увеличивает время реакции и снижает выход. [3]
Условия реакции
Таблица 1: Время реакции и выход зависят от субстрата. Было обнаружено, что β-глюкопиранозид является лучшим субстратом для реакции Типсона-Коэна, поскольку время реакции и выход намного превосходят любой другой субстрат, предложенный в исследовании. [3]
| Субстрат а | Время (часы) | Урожай (%) |
|---|---|---|
| β-глюкопиранозид | 0,5 | 85 |
| β-маннопиранозид | 2.5 | 66 |
| α-глюкопиранозид | 12 | 55 |
| α-маннопиранозид | 15 | 10 |
a Субстраты имеют бензилиденовые защитные группы в положениях C-4 и C-6, группы OMe в аномерном положении и группы OTs в положениях C-2 и C-3. Температура реакции 95–100 ˚C
Область реакции
- Реакцию пытались провести в микроволновой печи, что позволило повысить выход α-глюкопиранозида до 88% и значительно сократить время реакции до 14 минут. [5]
- В оригинальной статье Типсона и Коэна также использовались ациклические сахара для иллюстрации полезности реакции. Таким образом, реакция не ограничивается циклическими производными углеводов. [1]
- Использовались обе сульфоноксигруппы, такие как метансульфонил и толуолсульфонил , однако было обнаружено, что субстраты с толуолсульфонильными группами давали более высокие выходы и более короткое время реакции. [1] [2] [3]
Ссылки
- ^ abc RS Tipson & A. Cohen (1965). «Действие цинковой пыли и иодида натрия в N,N-диметилформамиде на смежные вторичные сульфонилоксигруппы: простой метод введения неконцевой ненасыщенности». Carbohydrate Research . 1 (4): 338–340. doi :10.1016/S0008-6215(00)81770-X.
- ^ abc E.Albano, D. Horton & T. Tsuchiya (1966). «Синтез и реакции ненасыщенных сахаров». Carbohydrate Research . 2 (5): 349–362. doi :10.1016/S0008-6215(00)80329-8.
- ^ abcde T. Yamazaki & K. Matsuda (1976). "Синтез метил 4,6-O-бензилиден-2,3-дидезокси-β-D-эритро-гекс-2-енопиранозида реакцией Типсона-Коэна". Carbohydrate Research . 50 (2): 279–281. doi :10.1016/S0008-6215(00)83860-4.
- ^ abcde T. Yamazaki & K. Matsuda (1977). "Стерические и электростатические эффекты при удалении 2- и 3-сульфонилоксигрупп из метил 4,6-O–бензилиденгексопиранозидов". Журнал химического общества, Perkin Transactions 1. 1 ( 18): 1981–1984. doi :10.1039/p19770001981.
- ^ Л. Баптистелла; А. Нето; и др. (1993). «Улучшенный синтез 2,3- и 3,4-ненасыщенных пиранозидов: использование микроволновой энергии». Tetrahedron Letters . 34 (52): 8407–8410. doi :10.1016/S0040-4039(00)61345-X.