Терапевтическая генная модуляция
Терапевтическая генная модуляция относится к практике изменения экспрессии гена на одной из различных стадий с целью облегчения какой-либо формы заболевания. Она отличается от генной терапии тем, что генная модуляция стремится изменить экспрессию эндогенного гена (возможно, посредством введения гена, кодирующего новый модуляторный белок), тогда как генная терапия касается введения гена, продукт которого помогает реципиенту напрямую.
Модуляция экспрессии генов может быть опосредована на уровне транскрипции ДНК-связывающими агентами (которые могут быть искусственными факторами транскрипции ), малыми молекулами или синтетическими олигонуклеотидами . Она также может быть опосредована посттранскрипционно через РНК-интерференцию .
Транскрипционная модуляция генов
Подход к терапевтической модуляции использует агенты, которые модулируют эндогенную транскрипцию, целенаправленно воздействуя на эти гены на уровне геномной ДНК . Преимущество этого подхода перед модуляцией на уровне мРНК или белка заключается в том, что каждая клетка содержит только одну копию геномной ДНК. Таким образом, число целевых копий значительно ниже, что позволяет теоретически вводить препараты в гораздо меньших дозах. [ необходима цитата ]
Этот подход также предлагает несколько преимуществ по сравнению с традиционной генной терапией . Прямое нацеливание на эндогенную транскрипцию должно давать правильную относительную экспрессию вариантов сплайсинга . Напротив, традиционная генная терапия обычно вводит ген, который может экспрессировать только один транскрипт, а не набор стехиометрически экспрессируемых вариантов сплайсинга. Кроме того, вирусно-введенные гены могут быть нацелены на подавление генов путем метилирования, что может противодействовать эффекту традиционной генной терапии. [1] Это не должно стать проблемой для транскрипционной модуляции, поскольку она действует на эндогенную ДНК.
Существует три основные категории агентов, которые действуют как модуляторы транскрипционных генов: триплекс-образующие олигонуклеотиды (TFO), синтетические полиамиды (SPA) и ДНК-связывающие белки . [2]
Триплекс-образующие олигонуклеотиды
Кто они такие
Триплекс-образующие олигонуклеотиды (TFO) являются одним из потенциальных методов достижения терапевтической генной модуляции. TFO имеют длину приблизительно 10-40 пар оснований и могут связываться в большой бороздке в дуплексной ДНК, что создает третью цепь или тройную спираль. [2] [3] Связывание происходит в полипуриновых или полипиримидиновых областях через водородные связи Хугстина с пуриновыми (A / G) основаниями на двухцепочечной ДНК, которая уже находится в форме спирали Уотсона-Крика . [4]
Как они работают
TFO могут быть молекулами полипурина или полипиримидина и связываться с одной из двух цепей в двойной спирали в параллельной или антипараллельной ориентации для целевых полипуриновых или полипиримидиновых областей. Поскольку коды распознавания ДНК различны для параллельного и антипараллельного способа связывания TFO, TFO, состоящие из пиримидинов (C / T), связываются с богатой пуринами цепью целевой двойной спирали через водородные связи Хугстина параллельным образом. [3] TFO, состоящие из пуринов (A / G) или смешанных пуринов и пиримидинов, связываются с той же богатой пуринами цепью через обратные связи Хугстина антипараллельным образом. TFO могут распознавать богатые пуринами целевые цепи для дуплексной ДНК. [2]

Осложнения и ограничения
Для того чтобы мотивы TFO связывались параллельно и создавали водородные связи , атом азота в положении 3 остатка цитозина должен быть протонирован , но при физиологических уровнях pH это не так, что может помешать параллельному связыванию. [2]
Другим ограничением является то, что TFO могут связываться только с богатыми пурином целевыми цепями, и это ограничит выбор целевых участков эндогенных генов полипурин-полипиримидиновыми участками в дуплексной ДНК. Если бы был создан метод, позволяющий TFO связываться с пиримидиновыми основаниями, это позволило бы TFO нацеливаться на любую часть генома . Кроме того, человеческий геном богат полипуриновыми и полипиримидиновыми последовательностями, которые могут влиять на специфичность TFO для связывания с целевой областью ДНК. Подход к преодолению этого ограничения заключается в разработке TFO с модифицированными нуклеотидами, которые действуют как заблокированные нуклеиновые кислоты для увеличения сродства TFO к определенным целевым последовательностям. [5]
Другие ограничения включают опасения относительно связывающей аффинности и специфичности, стабильности in vivo и поглощения клетками. Исследователи пытаются преодолеть эти ограничения, улучшая характеристики TFO посредством химических модификаций , таких как модификация остова TFO для уменьшения электростатического отталкивания между TFO и дуплексом ДНК. Также из-за их высокой молекулярной массы поглощение клетками ограничено, и некоторые стратегии преодоления этого включают конденсирующие агенты ДНК , связывание TFO с гидрофобными остатками, такими как холестерин , или агенты проницаемости клеток. [2]
Что они могут сделать?
Ученые все еще совершенствуют технологию превращения TFO в терапевтический продукт , и многое из этого вращается вокруг их потенциального применения в антигенной терапии. В частности, они использовались в качестве индукторов сайт-специфических мутаций , реагентов, которые селективно и специфично расщепляют целевую ДНК, и в качестве модуляторов экспрессии генов . [6] Один из таких методов модификации последовательности гена заключается в том, чтобы нацеливать ДНК с TFO для активации целевого гена . Если целевая последовательность расположена между двумя неактивными копиями гена, лиганды ДНК, такие как TFO, могут связываться с целевым сайтом и будут распознаваться как повреждения ДНК. Чтобы исправить эти повреждения, комплексы репарации ДНК собираются на целевой последовательности, ДНК восстанавливается. Повреждение субстрата внутримолекулярной рекомбинации затем может быть восстановлено и обнаружено, если резекция зайдет достаточно далеко, чтобы произвести совместимые концы по обе стороны от сайта расщепления, а затем 3'-выступы лигируются, что приводит к образованию одной активной копии гена и потере всех последовательностей между двумя копиями гена. [4]
В модельных системах TFO могут ингибировать экспрессию генов на уровне ДНК, а также вызывать направленный мутагенез в модели. [6] Ингибирование удлинения транскрипции на эндогенных мишенях, вызванное TFO, было успешно протестировано на клеточных культурах. [7] Однако, несмотря на значительный успех in vitro , в клеточных приложениях были достигнуты ограниченные результаты, возможно, из-за доступности мишеней.
TFOs обладают потенциалом для подавления гена путем воздействия на инициацию или удлинение транскрипции, остановки на участках связывания триплекса или внесения постоянных изменений в целевую последовательность посредством стимуляции присущих клетке путей восстановления. Эти приложения могут быть актуальны при создании методов лечения рака , которые подавляют экспрессию генов на уровне ДНК. Поскольку аберрантная экспрессия генов является отличительной чертой рака, модуляция уровней экспрессии этих эндогенных генов может потенциально действовать как терапия для нескольких типов рака .
Синтетические полиамиды
Синтетические полиамиды представляют собой набор небольших молекул, которые образуют специфические водородные связи с малой бороздкой ДНК. Они могут оказывать эффект либо напрямую, связывая регуляторную область или транскрибированную область гена для изменения транскрипции, либо косвенно, путем направленного сопряжения с другим агентом, который вносит изменения вокруг целевого участка ДНК.
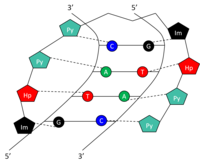
Структура
Определенные основания в малой бороздке ДНК могут быть распознаны и связаны небольшими синтетическими полиамидами (SPA). ДНК-связывающие SPA были разработаны так, чтобы содержать три компонента полиамидных аминокислот: гидроксипиррол (Hp), имидазол (Im) и пиррол (Py). [10] Цепи этих аминокислот замыкаются сами на себя в шпильковой структуре. Аминокислоты по обе стороны шпильки образуют пару, которая может специфически распознавать обе стороны пары оснований Уотсона-Крика . Это происходит посредством водородных связей в малой бороздке ДНК. Амидные пары Py/Im, Py/Hp, Hp/Py и Im/Py распознают пары оснований Уотсона-Крика CG, AT, TA и GC соответственно (таблица 1). Графическое представление распознавания 5'-GTAC-3' SPA см. на рисунке. SPA обладают низкой токсичностью, но пока не использовались в модуляции генов человека.
| Амидная пара | Пара нуклеотидов |
|---|---|
| Пы/Им | CG |
| Мощность/л.с. | В |
| л.с./пи | ТА |
| Им/Пи | ГК |
Ограничения и обходные пути
Основным структурным недостатком немодифицированных SPA как модуляторов генов является то, что их последовательность распознавания не может быть расширена за пределы 5 пар оснований Уотсона-Крика. Естественная кривизна малой бороздки ДНК слишком крутая для соответствия шпилечной структуре. Существует несколько групп, предложивших обходные пути для этой проблемы. [8] [11] [12] [13] [14] SPA можно заставить лучше следовать кривизне малой бороздки, вставив бета-аланин , который расслабляет структуру. [10] Другой подход к увеличению длины распознавания заключается в использовании нескольких коротких шпилек подряд. [15] [16] Этот подход увеличил длину распознавания до одиннадцати пар оснований Уотсона-Крика.


Прямая модуляция
SPA могут ингибировать транскрипцию посредством связывания в транскрибируемой области целевого гена. Это ингибирование происходит посредством блокирования удлинения РНК-полимеразой.
SPA также могут модулировать транскрипцию, нацеливаясь на сайт связывания регулятора транскрипции. Если регулятор является активатором транскрипции, это приведет к снижению уровней транскрипции. Например, было показано, что нацеливание SPA на сайт связывания для активирующего фактора транскрипции TFIIIA ингибирует транскрипцию нисходящей 5S РНК. [17] Напротив, если регулятор является репрессором, это приведет к повышению уровней транскрипции. Например, нацеливание SPA на фактор хозяина LSF, который подавляет экспрессию длинного концевого повтора (LTR) вируса иммунодефицита человека (ВИЧ) типа 1, блокирует связывание LSF и, следовательно, де-репрессирует экспрессию LTR [18] .

Сопряженная модуляция
Не было показано, что SPA напрямую модифицируют ДНК или обладают активностью, отличной от прямого блокирования других факторов или процессов. Однако модифицирующие агенты могут быть связаны с концами шпильковой структуры. Специфическое связывание SPA с ДНК позволяет осуществлять сайт-специфическое нацеливание конъюгированного модифицирующего агента.
SPA были объединены с ДНК-алкилирующими фрагментами циклопропилпирролоиндолом [19] и хлорамбуцилом [20] , которые были способны повреждать и сшивать ДНК SV40. Этот эффект подавлял клеточный цикл и рост. Хлорамбуцил, химиотерапевтический агент, был более эффективен при конъюгации со SPA, чем без него.
В 2012 году SPA были конъюгированы с SAHA, мощным ингибитором гистондеацетилазы (HDAC). [21] SPA с конъюгированным SAHA были нацелены на Oct-3/4 и Nanog, что вызвало эпигенетическое ремоделирование и, следовательно, увеличило экспрессию множественных генов, связанных с плюрипотентностью, в эмбриональных фибробластах мышей.
Дизайнерские белки с цинковыми пальцами
Что они собой представляют/структура
Дизайнерские белки цинковых пальцев — это сконструированные белки, используемые для нацеливания на определенные области ДНК . Эти белки используют способность связывания ДНК природных доменов цинковых пальцев для модуляции определенных целевых областей генома . [ 22] Как в дизайнерских, так и в природных мотивах цинковых пальцев белок состоит из двух β-слоев и одной α-спирали . Два остатка гистидина на α-спирали и два остатка цистеина на β-слоях связаны с атомом цинка , который служит для стабилизации домена белка в целом. Эта стабилизация особенно полезна для α-спирали в ее функции как домена распознавания и связывания ДНК. Фактор транскрипции TFIIIA является примером природного белка с мотивами цинковых пальцев. [23]

Как они работают
Мотивы цинковых пальцев связываются с большой бороздкой спиральной ДНК, [23] где последовательность аминокислотных остатков на α-спирали придает мотиву его специфичность целевой последовательности. Домен связывается с семинуклеотидной последовательностью ДНК (позиции с 1 по 6 на первичной цепи ДНК, плюс позиции 0 и 3 на комплементарной цепи ), тем самым гарантируя, что мотив белка является высокоселективным по отношению к своей цели. [22] При разработке дизайнерского белка цинковых пальцев исследователи могут использовать такие методы, как направленный мутагенез с последующими рандомизированными испытаниями на связывающую способность, [22] [24] или in vitro рекомбинацию мотивов с известной целевой специфичностью для получения библиотеки конечных белков, специфичных к последовательности. [25]


Эффекты и воздействия на генную модуляцию
Дизайнерские белки цинкового пальца могут модулировать экспрессию генома несколькими способами. В конечном счете, два фактора в первую очередь отвечают за результат экспрессии: является ли целевая последовательность регуляторной областью или кодирующей областью ДНК, и связаны ли и какие типы эффекторных доменов с доменом цинкового пальца. Если целевая последовательность для сконструированного дизайнерского белка является регуляторным доменом - например, промотором или репрессором репликации - сайт связывания для естественных факторов транскрипции будет скрыт, что приведет к соответствующему уменьшению или увеличению, соответственно, транскрипции для связанного гена . [26] Аналогично, если целевая последовательность является экзоном , дизайнерский цинковый палец скроет последовательность от транскрипционных комплексов РНК-полимеразы , что приведет к усеченному или иным образом нефункциональному продукту гена. [22]
Эффекторные домены, связанные с цинковым пальцем, также могут иметь сопоставимые эффекты. Именно функция этих эффекторных доменов, возможно, является наиболее важной в отношении использования дизайнерских белков цинкового пальца для терапевтической генной модуляции. Если домен метилазы связан с дизайнерским белком цинкового пальца, то когда белок цинкового пальца связывается с целевой последовательностью ДНК, впоследствии произойдет увеличение состояния метилирования ДНК в этой области. Скорости транскрипции генов, затронутых таким образом, будут снижены. [27] Многие эффекторные домены функционируют для модуляции ДНК напрямую - например, посредством метилирования, расщепления [28] или рекомбинации целевой последовательности ДНК [29] - или путем модуляции скорости ее транскрипции - например, ингибируя транскрипцию через репрессорные домены, которые блокируют транскрипционный аппарат, [30] способствуя транскрипции с помощью доменов активации, которые привлекают транскрипционный аппарат к сайту, [31] или гистоновых или других доменов эпигенетической модификации, которые влияют на состояние хроматина и способность транскрипционного аппарата получать доступ к затронутым генам. [32] Эпигенетическая модификация является основной темой в определении различных уровней экспрессии генов, что объясняется идеей о том, что то, насколько плотно скручена цепь ДНК - от гистонов на локальном уровне до хроматина на хромосомном уровне - может влиять на доступность последовательностей ДНК для транскрипционного аппарата, тем самым влияя на скорость, с которой она может транскрибироваться. [23] Если вместо того, чтобы напрямую воздействовать на цепь ДНК, как описано выше, сконструированный белок с цинковыми пальцами вместо этого влияет на состояние эпигенетической модификации для целевого участка ДНК, аналогичным образом может быть достигнута модуляция экспрессии генов.
В первом случае, чтобы успешно продемонстрировать использование разработанных цинковых пальцевых белков для модуляции экспрессии генов in vivo , Choo et al. [26] разработали белок, состоящий из трех доменов цинковых пальцев, которые нацелены на определенную последовательность на онкогене слияния BCR-ABL . Этот специфический онкоген участвует в остром лимфобластном лейкозе . Онкоген, как правило, позволяет лейкозным клеткам размножаться в отсутствие специфических факторов роста, что является отличительным признаком рака . Включая сигнал ядерной локализации с трехдоменным цинковым пальцем-белком для облегчения связывания белка с геномной ДНК в ядре, Choo et al. смогли продемонстрировать, что их сконструированный белок может блокировать транскрипцию онкогена in vivo. Лейкозные клетки стали зависимыми от обычных факторов роста, возвращая клеточный цикл под контроль нормальной регуляции . [26]
Посттранскрипционная генная модуляция
Основной подход к посттранскрипционной модуляции генов осуществляется с помощью РНК-интерференции (РНКi). Основной проблемой использования РНКi в генной модуляции является доставка лекарств к целевым клеткам. [33] [34] Генная модуляция РНКi была успешно применена к мышам для лечения мышиной модели воспалительного заболевания кишечника. [35] В этом лечении использовались липосомальные, нацеленные на бета-7 интегрин, стабилизированные наночастицы, захватывающие короткие интерферирующие РНК (siRNA). Существует несколько других форм доставки РНКi, включая: полиплексную доставку, конъюгаты лиганд-siRNA, голую доставку, доставку неорганических частиц с использованием золотых наночастиц и локальную доставку, специфичную для определенного участка. [36]
Клиническое значение
С другой стороны, дизайнерские белки цинковых пальцев прошли некоторые испытания в клинической практике . Эффективность и безопасность EW-A-401, сконструированного фактора транскрипции цинковых пальцев, как фармакологического средства для лечения хромоты , сердечно-сосудистого заболевания, была исследована в клинических испытаниях. [37] Белок состоит из сконструированной плазмидной ДНК , которая побуждает пациента вырабатывать сконструированный фактор транскрипции, целью которого является ген фактора роста эндотелия сосудов-A (VEGF-A) , который положительно влияет на развитие кровеносных сосудов . Хотя он еще не одобрен Управлением по контролю за продуктами и лекарствами США (FDA), были завершены два клинических исследования фазы I , которые идентифицируют этот белок цинковых пальцев как многообещающий и безопасный потенциальный терапевтический агент для лечения заболеваний периферических артерий у людей. [38]
Смотрите также
Ссылки
- ^ Young WB, Link CJ (2000). «Химерный ретровирусный вспомогательный вирус и последовательность IRES пикорнавируса для устранения метилирования ДНК для улучшения ретровирусных упаковочных клеток». Журнал вирусологии . 74 (11): 5242– 5249. doi :10.1128/JVI.74.11.5242-5249.2000. PMC 110878. PMID 10799600.
- ^ abcde Uil TG, Haisma HJ, Rots MG (2003). «Терапевтическая модуляция эндогенной функции генов агентами с разработанной специфичностью последовательности ДНК». Nucleic Acids Research . 31 (21): 6064– 6078. doi :10.1093/nar/gkg815. PMC 275457. PMID 14576293 .
- ^ ab Sargent, RG.; Kim, S.; Gruenert, DC. (2011). «Модификация генов на основе олиго/полинуклеотидов: стратегии и терапевтический потенциал». Олигонуклеотиды . 21 (2): 55–75 . doi :10.1089/oli.2010.0273. PMC 3078494. PMID 21417933 .
- ^ ab Simon, P.; Cannata, F.; Concordet, JP.; Giovannangeli, C. (август 2008 г.). «Нацеливание ДНК с помощью триплекс-формирующих олигонуклеотидов для изменения последовательности генов». Biochimie . 90 (8): 1109– 16. doi :10.1016/j.biochi.2008.04.004. PMID 18460344.
- ^ Чжоу, Ю.; Киржек, Э.; Лоо, ЗП.; Антонио, М.; Яу, Ю.Х.; Чуа, Ю.В.; Гейфман-Шочат, С.; Киржек Р.; Чен, Г. (июль 2013 г.). «Распознавание дуплексов РНК химически модифицированными триплексообразующими олигонуклеотидами». Нуклеиновые кислоты Рез . 41 (13): 6664–73 . doi :10.1093/nar/gkt352. ПМЦ 3711454 . ПМИД 23658228.
- ^ ab Guntaka, RV.; Varma, BR.; Weber, KT. (январь 2003 г.). «Триплексобразующие олигонуклеотиды как модуляторы экспрессии генов». Int J Biochem Cell Biol . 35 (1): 22– 31. doi :10.1016/s1357-2725(02)00165-6. PMID 12467644.
- ^ Фариа, М.; Вуд, К. Д.; Перруо, Л.; Нельсон, Дж. С.; Винтер, А.; Уайт, М. Р.; Элен, К.; Джованнанджели, К. (апрель 2000 г.). «Целенаправленное ингибирование удлинения транскрипции в клетках, опосредованное триплекс-образующими олигонуклеотидами». Proc Natl Acad Sci USA . 97 (8): 3862– 7. Bibcode :2000PNAS...97.3862F. doi : 10.1073/pnas.97.8.3862 . PMC 18107 . PMID 10760257.
- ^ ab Reddy BS, Sharma SK, Lown JW (2001). "Последние разработки в области селективных последовательности эффекторов малой бороздки ДНК". Curr. Med. Chem . 8 (5): 475– 508. doi :10.2174/0929867003373292. PMID 11281837.
- ^ Dervan PB (2001). «Молекулярное распознавание ДНК малыми молекулами». Bioorg. Med. Chem . 9 (9): 2215– 2235. doi :10.1016/s0968-0896(01)00262-0. PMID 11553460.
- ^ ab White S, Szewcxyk JW, Turner JM, Baird EE, Dervan PB (1998). "Распознавание четырех пар оснований Уотсона-Крика в малой бороздке ДНК синтетическими лигандами" (PDF) . Nature . 391 (6666): 468– 471. Bibcode :1998Natur.391..468W. doi :10.1038/35106. PMID 9461213. S2CID 205023593.
- ^ Dervan PB, Edelson BS (2003). «Распознавание малой бороздки ДНК пирролимидазольными полиамидами». Curr. Opin. Struct. Biol . 13 (3): 284– 299. doi :10.1016/s0959-440x(03)00081-2. PMID 12831879.
- ^ Lown JW (1988). «Лекситропсины: рациональный дизайн агентов считывания последовательности ДНК как новых противораковых агентов и потенциальных клеточных зондов». Anticancer Drug Des . 3 (1): 25–40 . PMID 2838035.
- ^ Trauger JW, Baird EE, Dervan PB (1996). «Распознавание ДНК сконструированными лигандами в субнаномолярных концентрациях». Nature . 382 (6591): 559– 561. Bibcode :1996Natur.382..559T. doi :10.1038/382559a0. PMID 8700233. S2CID 4335955.
- ^ Wemmer DE (2000). «Спроектированные лиганды малой бороздки, специфичные для последовательности». Annu. Rev. Biophys. Biomol. Struct . 29 : 439– 461. doi :10.1146/annurev.biophys.29.1.439. PMID 10940255.
- ^ Керс И, Дерван ПБ (2002). «Поиск оптимального линкера в тандемных шпилечных полиамидах». Bioorg. Med. Chem . 10 (10): 3339– 3349. doi :10.1016/s0968-0896(02)00221-3. PMID 12150881.
- ^ Weyermann P, Dervan PB (2002). «Распознавание десяти пар оснований ДНК шпилечным димером «голова к голове»» (PDF) . J. Am. Chem. Soc . 124 (24): 6872– 6878. doi :10.1021/ja020258k. PMID 12059208.
- ^ Gottesfeld JM, Neely L, Trauger JW, Baird EE, Dervan PB (1997). «Регуляция экспрессии генов малыми молекулами». Nature . 387 (6629): 202– 205. Bibcode :1997Natur.387..202G. doi :10.1038/387202a0. PMID 9144294. S2CID 4358491.
- ^ Coull JJ, He G, Melander C, Rucker VC, Dervan PB, Margolis DM (2002). «Целенаправленная дерепрессия длинного концевого повтора вируса иммунодефицита человека типа 1 с помощью пиррол-имидазольных полиамидов». J. Virol . 76 (23): 12349– 12354. doi :10.1128/jvi.76.23.12349-12354.2002. PMC 136904. PMID 12414976 .
- ^ Wang YD, Dziegielewski J, Wurtz NR, Dziegielewska B, Dervan PB, Beerman TA (2003). «Сшивание ДНК и биологическая активность конъюгата полиамида-хлорамбуцила в виде шпильки». Nucleic Acids Research . 31 (21): 1208– 1215. doi :10.1093/nar/gkg215. PMC 150233. PMID 12582240.
- ^ Wang YD, Dziegielewski J, Chang AY, Dervan PB, Beerman TA (2002). «Внеклеточная и клеточная активность селективного конъюгата полиамида-CBI с шпилькой для ДНК-последовательности». J. Biol. Chem . 277 (45): 42431– 42437. doi : 10.1074/jbc.M207179200 . PMID 12196541.
- ^ Pandian NG, Nakano Y, Sato S, Morinaga H, Bando T, Nagase H, Sugiyama H (2012). "Синтетическая малая молекула для быстрой индукции множественных генов плюрипотентности в эмбриональных фибробластах мыши". Scientific Reports . 2 (544): 544. Bibcode :2012NatSR...2E.544P. doi :10.1038/srep00544. PMC 3408130 . PMID 22848790.
- ^ abcd Papworth, M.; Kolasinska, P.; Minczuk, M. (январь 2006 г.). «Дизайнерские белки с цинковыми пальцами и их применение». Gene . 366 (1): 27– 38. doi :10.1016/j.gene.2005.09.011. PMID 16298089.
- ^ abc Уотсон, Джеймс Д. (2008). Молекулярная биология гена . Сан-Франциско: Pearson/Benjamin Cummings. стр. 595. ISBN 978-0-8053-9592-1.
- ^ Desjarlais, JR.; Berg, JM. (март 1993 г.). «Использование консенсусной последовательности цинкового пальца и правил специфичности для проектирования специфических ДНК-связывающих белков». Proc Natl Acad Sci USA . 90 (6): 2256– 60. Bibcode : 1993PNAS ...90.2256D. doi : 10.1073/pnas.90.6.2256 . PMC 46065. PMID 8460130.
- ^ Исалан, М.; Клуг, А.; Чу, И. (июль 2001 г.). «Быстрый, общеприменимый метод создания цинковых пальцев, проиллюстрированный на примере воздействия на промотор ВИЧ-1». Nat Biotechnol . 19 (7): 656– 60. doi :10.1038/90264. PMC 2677679. PMID 11433278 .
- ^ abc Choo, Y.; Sánchez-García, I.; Klug, A. (декабрь 1994 г.). "In vivo репрессия сайт-специфическим ДНК-связывающим белком, разработанным против онкогенной последовательности" (PDF) . Nature . 372 (6507): 642– 5. Bibcode :1994Natur.372..642C. doi :10.1038/372642a0. hdl : 10261/6295 . PMID 7990954. S2CID 12701336.
- ^ Carvin, CD.; Parr, RD.; Kladde, MP. (Ноябрь 2003 г.). «Сайт-селективное in vivo нацеливание метилирования ДНК цитозина-5 белками с цинковыми пальцами». Nucleic Acids Res . 31 (22): 6493– 501. doi :10.1093/nar/gkg853. PMC 275549. PMID 14602907 .
- ^ Kim, YG.; Cha, J.; Chandrasegaran, S. (февраль 1996 г.). «Гибридные рестрикционные ферменты: слияния цинковых пальцев с доменом расщепления Fok I». Proc Natl Acad Sci USA . 93 (3): 1156– 60. Bibcode : 1996PNAS ...93.1156K. doi : 10.1073/pnas.93.3.1156 . PMC 40048. PMID 8577732.
- ^ Urnov, FD.; Miller, JC.; Lee, YL.; Beausejour, CM.; Rock, JM.; Augustus, S.; Jamieson, AC.; Porteus, MH.; et al. (июнь 2005 г.). «Высокоэффективная эндогенная коррекция генов человека с использованием разработанных нуклеаз с цинковыми пальцами». Nature . 435 (7042): 646– 51. Bibcode :2005Natur.435..646U. doi :10.1038/nature03556. PMID 15806097. S2CID 4390010.
- ^ Beerli, RR.; Dreier, B.; Barbas, CF. (Февраль 2000). «Положительная и отрицательная регуляция эндогенных генов с помощью разработанных факторов транскрипции». Proc Natl Acad Sci USA . 97 (4): 1495– 500. Bibcode : 2000PNAS...97.1495B. doi : 10.1073/pnas.040552697 . PMC 26462. PMID 10660690 .
- ^ Лара, Х.; Ван, И.; Бельтран, АС.; Хуарес-Морено, К.; Юань, Х.; Като, С.; Лейсевиц, А.В.; Куэльо Фредес, М.; и др. (август 2012 г.). «Воздействие на серозный эпителиальный рак яичников с помощью дизайнерских факторов транскрипции цинковых пальцев». J Biol Chem . 287 (35): 29873– 86. doi : 10.1074/jbc.M112.360768 . PMC 3436144. PMID 22782891 .
- ^ Сноуден, AW.; Чжан, Л.; Урнов, Ф.; Дент, К.; Жувено, И.; Чжун, Х.; Ребар, Э.Дж.; Джеймисон, А.С.; и др. (декабрь 2003 г.). «Подавление фактора роста эндотелия сосудов А в клетках глиобластомы с использованием сконструированных факторов транскрипции цинковых пальцев». Cancer Res . 63 (24): 8968–76 . PMID 14695215.
- ^ Behlke, MA. (Апрель 2006). «Прогресс в использовании siRNA in vivo». Mol Ther . 13 (4): 644– 70. doi : 10.1016/j.ymthe.2006.01.001 . PMC 7106286 . PMID 16481219.
- ^ Dykxhoorn, DM.; Lieberman, J. (2006). «Управление интерференцией: перспективы и препятствия к использованию малых интерферирующих РНК в качестве малых молекулярных лекарств». Annu Rev Biomed Eng . 8 : 377– 402. CiteSeerX 10.1.1.418.758 . doi :10.1146/annurev.bioeng.8.061505.095848. PMID 16834561.
- ^ Пир, Д.; Парк, Э.Дж.; Моришита, И.; Карман, К.В.; Шимаока, М. (февраль 2008 г.). «Системная лейкоцитарно-направленная доставка siRNA, раскрывающая циклин D1 как противовоспалительную цель». Science . 319 (5863): 627– 30. doi :10.1126/science.1149859. PMC 2490797 . PMID 18239128.
- ^ Rettig, GR.; Behlke, MA. (март 2012 г.). «Прогресс в использовании siRNA-II in vivo». Mol Ther . 20 (3): 483– 512. doi :10.1038/mt.2011.263. PMC 3293614. PMID 22186795 .
- ^ "Идентификатор NCT00080392. Модуляция фактора роста эндотелия сосудов (VEGF) с использованием сконструированного фактора транскрипции цинк-пальцевого типа для лечения перемежающейся хромоты нижних конечностей". ClinicalTrials.gov . Национальные институты здравоохранения США. 30 декабря 2011 г. Получено 25 июля 2013 г.
- ^ Giacca, M.; Zacchigna, S. (июнь 2012 г.). «Генная терапия VEGF: терапевтический ангиогенез в клинике и за ее пределами». Gene Ther . 19 (6): 622– 9. doi : 10.1038/gt.2012.17 . PMID 22378343.