Тимидилатсинтаза
| ТЫМС | |||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Идентификаторы | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Псевдонимы | TYMS , HST422, TMS, TS, тимидилатсинтетаза | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Внешние идентификаторы | ОМИМ : 188350; МГИ : 98878; гомологен : 834; Генные карты : TYMS; ОМА :ТИМС - ортологи | ||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Викиданные | |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| тимидилатсинтаза | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 Гомодимер тимидилатсинтазы, Человек | |||||||||
| Идентификаторы | |||||||||
| Номер ЕС | 2.1.1.45 | ||||||||
| Номер CAS | 9031-61-2 | ||||||||
| Базы данных | |||||||||
| ИнтЭнз | IntEnz вид | ||||||||
| БРЕНДА | запись BRENDA | ||||||||
| ExPASy | NiceZyme вид | ||||||||
| КЕГГ | запись KEGG | ||||||||
| МетаЦик | метаболический путь | ||||||||
| ПРИАМ | профиль | ||||||||
| Структуры PDB | RCSB PDB PDBe PDBsum | ||||||||
| Генная онтология | AmiGO / QuickGO | ||||||||
| |||||||||
| Тимидилатсинтаза | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Идентификаторы | |||||||||
| Символ | Тимидилат_синтез | ||||||||
| Пфам | ПФ00303 | ||||||||
| ИнтерПро | IPR000398 | ||||||||
| ПРОСИТ | PDOC00086 | ||||||||
| СКОП2 | 1тыс / SCOPe / SUPFAM | ||||||||
| |||||||||
Тимидилатсинтаза (ТС) ( EC 2.1.1.45) [5] — фермент , катализирующий превращение дезоксиуридинмонофосфата (dUMP) в дезокситимидинмонофосфат (dTMP). Тимидин — один из нуклеотидов ДНК. При ингибировании ТС возникает дисбаланс дезоксинуклеотидов и повышенный уровень dUMP . Оба эти фактора вызывают повреждение ДНК. [6] [7]
Функция
Следующая реакция катализируется тимидилатсинтазой:
- 5,10-метилентетрагидрофолат + dUMP дигидрофолат + dTMP
Посредством восстановительного метилирования дезоксиуридинмонофосфат ( dUMP) и N5,N10-метилентетрагидрофолат совместно используются для образования dTMP, давая дигидрофолат в качестве вторичного продукта.
Это обеспечивает единственный de novo путь для производства dTMP и является единственным ферментом в метаболизме фолата, в котором 5,10-метилентетрагидрофолат окисляется во время одноуглеродного переноса. [8] Фермент необходим для регулирования сбалансированного снабжения 4 предшественников ДНК при нормальной репликации ДНК: дефекты в активности фермента, влияющие на процесс регуляции, вызывают различные биологические и генетические аномалии, такие как смерть без тимина. [9] Фермент является важной мишенью для некоторых химиотерапевтических препаратов. Тимидилатсинтаза является ферментом с молекулярной массой около 30–35 кДа у большинства видов, за исключением простейших и растений, где она существует как бифункциональный фермент, включающий домен дигидрофолатредуктазы. [8] Остаток цистеина участвует в каталитическом механизме (он ковалентно связывает промежуточное соединение 5,6-дигидро-dUMP). Последовательность вокруг активного центра этого фермента сохраняется от фагов до позвоночных.
Тимидилатсинтаза индуцируется фактором транскрипции LSF/ TFCP2 , а LSF является онкогеном в гепатоцеллюлярной карциноме . LSF и тимидилатсинтаза играют важную роль в пролиферации и прогрессировании рака печени, а также в устойчивости к лекарственным препаратам. [10]
Клиническое значение
Тимидилатсинтаза (ТС) играет решающую роль на ранних стадиях биосинтеза ДНК . [11] Повреждение или удаление ДНК происходит ежедневно в результате как эндогенных, так и экологических факторов. Такие экологические факторы включают ультрафиолетовое повреждение и сигаретный дым, которые содержат различные канцерогены. [12] Поэтому синтез и вставка здоровой ДНК жизненно важны для нормальных функций организма и предотвращения раковой активности. Кроме того, важно ингибирование синтеза важных нуклеотидов, необходимых для роста клеток. По этой причине ТС стала важной мишенью для лечения рака с помощью химиотерапии . Чувствительность ТС к поддаче ингибиторов ТС является ключевой частью его успеха в лечении колоректального, поджелудочной железы, яичников, желудка и молочной железы. [11]
Использование ТС в качестве мишени для наркотиков
Использование ингибиторов TS стало основным направлением использования TS в качестве лекарственной мишени. Наиболее широко используемый ингибитор — 5-фторурацил (5-FU) и его метаболизированная форма 5-фтордезоксиуридинмонофосфат (5-FdUMP), который действует как антиметаболит , необратимо ингибирующий TS путем конкурентного связывания. [13] Однако из-за низкого уровня 5-FU, обнаруженного у многих пациентов, было обнаружено, что в сочетании с лейковорином (LV) 5-FU имеет больший успех в подавлении механизмов прогрессирования опухоли и повышении активности иммунной системы. [14]
Экспериментально было показано, что низкие уровни экспрессии TS приводят к лучшему ответу на 5-FU и более высоким показателям успешности и выживаемости пациентов с раком толстой кишки и печени. [11] Однако дополнительные эксперименты просто заявили, что уровни TS могут быть связаны со стадией заболевания, пролиферацией клеток и дифференциацией опухоли у пациентов с аденокарциномой легких, но низкие уровни не обязательно являются показателями высокого успеха. Уровни экспрессии мРНК TS могут быть полезны для прогнозирования злокачественного потенциала определенных раковых клеток, тем самым улучшая цели лечения рака и обеспечивая более высокие показатели выживаемости среди пациентов с раком [Хашимото].
Связь TS с клеточным циклом также способствует его использованию в лечении рака. Несколько зависимых от клеточного цикла киназ и факторов транскрипции влияют на уровни TS в клеточном цикле, которые увеличивают его активность во время фазы S , но уменьшают его активность, когда клетки больше не пролиферируют. [11] В ауторегуляторном режиме TS контролирует не только свою собственную трансляцию, но и трансляцию других белков, таких как p53, который через мутацию является корнем роста многих опухолей. Благодаря своей трансляции TS имеет различную экспрессию в раковых клетках и опухолях, что приводит к ранней гибели клеток. [13]
Интерактивная карта маршрутов
Нажмите на гены, белки и метаболиты ниже, чтобы перейти к соответствующим статьям. [§ 1]
- ^ Интерактивную карту путей можно редактировать на WikiPathways: «FluoropyrimidineActivity_WP1601».
Описание механизма

В предлагаемом механизме TS образует ковалентную связь с субстратом dUMP через 1,4-присоединение с участием нуклеофила цистеина. Субстрат тетрагидрофолат отдает метильную группу альфа-углероду, одновременно восстанавливая новый метил на dUMP, образуя dTMP. [15]

Было доказано, что имин, образованный в результате реакции с ТГФ и dUMP, является промежуточным продуктом в реакции с dUMP через мутации в структуре TS, которые ингибируют завершение механизма. V316Am TS, мутант с делецией C-концевых валинов из обеих субъединиц, позволяет катализировать дегалогенирование BrdUMP, предшествующее механизму, описанному выше, и ковалентную связь с ТГФ и dUMP. Мутант TS не способен выполнить C-концевое конформационное изменение, необходимое для разрыва ковалентных связей с образованием dTMP, тем самым показывая, что предложенный механизм верен. Структура была выведена с помощью рентгеновской кристаллографии V316Am TS, чтобы проиллюстрировать полную гомодимерную структуру TS (рисунок 1). Кроме того, она показала возможные взаимодействия 175Arg и 174Arg между димерами. Предполагается, что эти аргинины стабилизируют структуры UMP в активных центрах, создавая водородные связи с фосфатной группой (рисунок 2). [Страуд и Файнер-Мур] [ требуется цитата ] 5-FU является ингибитором TS. При попадании в клетку 5-фторурацил (5-FU) преобразуется во множество активных метаболитов внутриклеточно. Одним из таких метаболитов является FdUMP, который отличается от dUMP фтором вместо водорода на альфа-углероде. FdUMP способен ингибировать TS, связываясь с нуклеотид-связывающим сайтом dUMP. Это конкурентное связывание ингибирует нормальную функцию синтеза dTMP из dUMP [Лонгли]. [ требуется цитата ] Таким образом, dUMP не может иметь реакцию элиминации и завершить метилдонорство от THF.

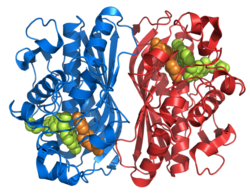
Рисунок 1. На этом рисунке изображен гомодимер, который является TS. Как вы можете видеть, оранжевые и бирюзовые остовы никогда не соединяются и не переплетаются, но между димерами есть взаимодействия боковых цепей. На оранжевом белке вы можете визуально обнаружить две длинные боковые цепи, которые входят в бирюзовый белок (он расположен внутри желтого круга). Другие бежевые части — это боковые цепи, которые взаимодействуют внутри активного центра. Чуть ниже желтого круга вы можете увидеть тот же рисунок боковых цепей и конфигурацию.

Рисунок 2. На этом рисунке показаны возможные взаимодействия водородных связей между аргининами и UMP в активном центре тимидилатсинтазы. Это можно увидеть по слабым линиям между синими и красными кончиками. Эти аргинины используются для удержания положения молекулы UMP, чтобы взаимодействие могло происходить правильно. Два аргинина в правом верхнем углу, которые расположены рядом друг с другом на скелете, на самом деле из другого белка этого димерного фермента. Это взаимодействие является одной из многих межмолекулярных сил, которые удерживают эти две третичные структуры вместе. Желтая стойка в верхней средней области показывает серную связь, которая образуется между боковой цепью цистеина и UMP. Это ковалентно удерживает UMP в активном центре, пока он не прореагирует с образованием TMP.
Смотрите также
- Пиримидиновые аналоги
- Ингибитор тимидилатсинтазы
- Тимидинкиназа
- Тимидинкиназа в клинической химии
- Тимидилаткиназа
Ссылки
- ^ abc GRCh38: Ensembl выпуск 89: ENSG00000176890 – Ensembl , май 2017 г.
- ^ abc GRCm38: Ensembl выпуск 89: ENSMUSG00000025747 – Ensembl , май 2017 г.
- ^ "Human PubMed Reference:". Национальный центр биотехнологической информации, Национальная медицинская библиотека США .
- ^ "Mouse PubMed Reference:". Национальный центр биотехнологической информации, Национальная медицинская библиотека США .
- ^ «Ген Энтрез: тимидилатсинтетаза TYMS» .
- ^ "ДНК: Форма и Функция" (PDF) . Архивировано из оригинала (PDF) 2013-05-25 . Получено 2014-05-02 .
- ^ «Синтез ДНК».
- ^ ab Stroud RM, Santi DV, Hardy LW, Montfort WR, Jones MO, Finer-Moore JS (1987). «Атомная структура тимидилатсинтазы: цель для рационального дизайна лекарств». Science . 235 (4787): 448– 455. Bibcode :1987Sci...235..448H. doi :10.1126/science.3099389. PMID 3099389.
- ^ Gotoh O, Shimizu K, Kaneda S, Nalbantoglu J, Takeishi K, Seno T, Ayusawa D (1990). «Структурный и функциональный анализ гена тимидилатсинтазы человека». J. Biol. Chem . 265 (33): 20277– 20284. doi : 10.1016/S0021-9258(17)30501-X . PMID 2243092.
- ^ Сантекадур П.К., Раджасекаран Д., Сиддик А., Гредлер Р., Чен Д., Шаус С.Е., Хансен Ю., Фишер П.Б., Саркар Д. (2012). «Фактор транскрипции LSF: новый онкоген гепатоцеллюлярной карциномы» (PDF) . Am J Cancer Res . 2 (3): 269–85 . ПМЦ 3365805 . ПМИД 22679558.
- ^ abcd Петерс Г.Дж., Бэкус Х.Х., Фримантл С., ван Трист Б., Кодаччи-Писанелли Г., ван дер Вилт КЛ, Смид К., Лунек Дж., Калверт А.Х., Марш С., МакЛеод Х.Л., Блумена Е., Мейер С., Янсен Г., ван Гроенинген С.Дж., Пинедо Х.М. (2002). «Индукция тимидилатсинтазы как механизм устойчивости к 5-фторурацилу». Биохим. Биофиз. Акта . 1587 ( 2–3 ): 194–205 . doi :10.1016/S0925-4439(02)00082-0. ПМИД 12084461.
- ^ "Лейковорин". Информация о лекарствах MedlinePlus . Национальная медицинская библиотека США.
- ^ ab Papamichael D. (1999). «Использование ингибиторов тимидилатсинтазы при лечении запущенного колоректального рака: текущее состояние». The Oncologist . 4 (6): 478– 487. doi : 10.1634/theoncologist.4-6-478 . PMID 10631692.
- ^ Nicolini A, Conte M, Rossi G, Ferrari P, Duffy M, Barak V, Carpi A, Miccoli P (2011). «Дополнительный 5-FU-LV значительно увеличивает выживаемость при желудочно-кишечном раке». Front Biosci . 3 (4): 1475– 82. doi :10.2741/348. PMID 21622151.
- ^ Carreras CW, Santi DV (1995). «Каталитический механизм и структура тимидилатсинтазы». Annu. Rev. Biochem . 64 : 721– 62. doi : 10.1146/annurev.bi.64.070195.003445. PMID 7574499.
Дальнейшее чтение
- Каррерас CW, Санти DV (1995). «Каталитический механизм и структура тимидилатсинтазы». Annual Review of Biochemistry . 64 (1): 721– 762. doi :10.1146/annurev.bi.64.070195.003445. PMID 7574499.
- Банерджи Д., Майер-Кукук П., Капио Г. и др. (2002). «Новые аспекты устойчивости к препаратам, нацеленным на дигидрофолатредуктазу и тимидилатсинтазу». Biochim. Biophys. Acta . 1587 ( 2–3 ): 164–73 . doi :10.1016/S0925-4439(02)00079-0. PMID 12084458.
- Liu J, Schmitz JC, Lin X и др. (2002). «Тимидилатсинтаза как трансляционный регулятор экспрессии клеточных генов». Biochim. Biophys. Acta . 1587 ( 2–3 ): 174–82 . doi :10.1016/s0925-4439(02)00080-7. PMID 12084459.
- Chu J, Dolnick BJ (2002). «Естественная антисмысловая (rTSalpha) РНК индуцирует сайт-специфическое расщепление мРНК тимидилатсинтазы». Biochim. Biophys. Acta . 1587 ( 2–3 ): 183–93 . doi :10.1016/s0925-4439(02)00081-9. PMID 12084460.
- Peters GJ, Backus HH, Freemantle S и др. (2002). «Индукция тимидилатсинтазы как механизм устойчивости к 5-фторурацилу». Biochim. Biophys. Acta . 1587 ( 2–3 ): 194–205 . doi :10.1016/S0925-4439(02)00082-0. PMID 12084461.
- Costi MP, Tondi D, Rinaldi M и др. (2002). «Исследования структуры по видоспецифическому ингибированию тимидилатсинтазы». Biochim. Biophys. Acta . 1587 ( 2–3 ): 206–14 . doi :10.1016/s0925-4439(02)00083-2. PMID 12084462. S2CID 19676651.
- Lin D, Li H, Tan W и др. (2007). Генетические полиморфизмы ферментов метаболизма фолата и риск рака желудка и пищевода: потенциальное взаимодействие генов и питательных веществ в развитии рака . Forum of Nutrition. Vol. 60. pp. 140–5 . doi :10.1159/000107090. ISBN 978-3-8055-8216-2. PMID 17684410.
Внешние ссылки
- Тимидилат+синтетаза в рубриках медицинских предметов Национальной медицинской библиотеки США (MeSH)
- PDBe-KB предоставляет обзор всей структурной информации, доступной в PDB для человеческой тимидилатсинтазы.








