Сукцинил кофермент А синтетаза
| Сукцинат—КоА-лигаза (GDP-образующая) | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 Свинья ГТФ-специфическая сукцинил-КоА-синтетаза с ГТФ. PDB 2fp4 [1] | |||||||||
| Идентификаторы | |||||||||
| Номер ЕС | 6.2.1.4 | ||||||||
| Номер CAS | 9014-36-2 | ||||||||
| Базы данных | |||||||||
| ИнтЭнз | IntEnz вид | ||||||||
| БРЕНДА | запись BRENDA | ||||||||
| ExPASy | NiceZyme вид | ||||||||
| КЕГГ | запись KEGG | ||||||||
| МетаЦик | метаболический путь | ||||||||
| ПРИАМ | профиль | ||||||||
| Структуры PDB | RCSB PDB PDBe PDBsum | ||||||||
| Генная онтология | AmiGO / QuickGO | ||||||||
| |||||||||
| Сукцинат—КоА-лигаза (АДФ-образующая) | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 Сукцинил-КоА-синтетаза из Escherichia coli . PDB 2scu [2] | |||||||||
| Идентификаторы | |||||||||
| Номер ЕС | 6.2.1.5 | ||||||||
| Номер CAS | 9080-33-5 | ||||||||
| Базы данных | |||||||||
| ИнтЭнз | IntEnz вид | ||||||||
| БРЕНДА | запись BRENDA | ||||||||
| ExPASy | NiceZyme вид | ||||||||
| КЕГГ | запись KEGG | ||||||||
| МетаЦик | метаболический путь | ||||||||
| ПРИАМ | профиль | ||||||||
| Структуры PDB | RCSB PDB PDBe PDBsum | ||||||||
| Генная онтология | AmiGO / QuickGO | ||||||||
| |||||||||
Сукцинилкоэнзим А-синтетаза ( SCS , также известная как сукцинил-КоА-синтетаза или сукцинаттиокиназа или сукцинат-КоА-лигаза ) — это фермент, катализирующий обратимую реакцию сукцинил-КоА в сукцинат . [3] Фермент облегчает сопряжение этой реакции с образованием молекулы нуклеозидтрифосфата ( ГТФ или АТФ ) из молекулы неорганического фосфата и молекулы нуклеозиддифосфата (ГДФ или АДФ ) . Он играет ключевую роль в качестве одного из катализаторов, участвующих в цикле лимонной кислоты , центральном пути клеточного метаболизма , и он расположен в митохондриальном матриксе клетки. [4]
Химическая реакция и механизм фермента
Сукцинил-КоА-синтетаза катализирует следующую обратимую реакцию :
- Сукцинил-КоА + Pi + NDP ↔ Сукцинат + КоА + NTP
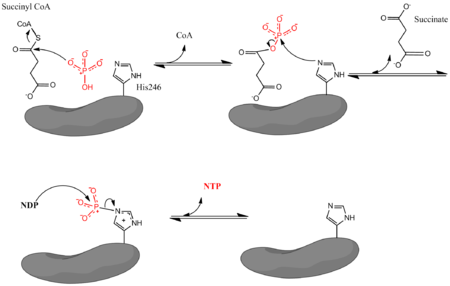
где Pi обозначает неорганический фосфат, NDP обозначает нуклеотиддифосфат (GDP или ADP), а NTP обозначает нуклеотидтрифосфат (GTP или ATP). Как уже упоминалось, фермент облегчает сопряжение превращения сукцинил-КоА в сукцинат с образованием NTP из NDP и Pi. Реакция имеет биохимическое стандартное состояние изменения свободной энергии -3,4 кДж/моль. [4] Реакция происходит по трехстадийному механизму [3], который изображен на изображении ниже. Первый шаг включает вытеснение CoA из сукцинил-КоА нуклеофильной молекулой неорганического фосфата с образованием сукцинилфосфата. Затем фермент использует остаток гистидина для удаления фосфатной группы из сукцинилфосфата и получения сукцината. Наконец, фосфорилированный гистидин переносит фосфатную группу в нуклеозиддифосфат, который генерирует высокоэнергетический несущий нуклеозидтрифосфат.
Структура
Субъединицы
Бактериальные и млекопитающие SCS состоят из α и β субъединиц . [5] В E. coli два αβ гетеродимера соединяются вместе, образуя гетеротетрамерную структуру α 2 β 2. Однако митохондриальные SCS млекопитающих активны как αβ димеры и не образуют гетеротетрамер. [6] Гетеротетрамер SCS E. coli был кристаллизован и охарактеризован очень подробно. [6] [7] Как видно на изображении 2, две α субъединицы (розовая и зеленая) находятся на противоположных сторонах структуры, а две β субъединицы (желтая и синяя) взаимодействуют в средней области белка. Две субъединицы α взаимодействуют только с одной субъединицей β, тогда как субъединицы β взаимодействуют с одной субъединицей α (образуя димер αβ) и субъединицей β другого димера αβ. [6] Короткая аминокислотная цепочка связывает две субъединицы β, что приводит к образованию тетрамерной структуры.

Кристаллическая структура альфа-субъединицы сукцинил-КоА-синтетазы (изоформа связывания сукцинил-КоА) была определена Джойсом и др. с разрешением 2,10 А, код PDB 1CQJ. [1]. [8]
Каталитические остатки
Кристаллические структуры для E. coli SCS свидетельствуют о том, что кофермент А связывается внутри каждой α-субъединицы (внутри складки Россмана ) в непосредственной близости от остатка гистидина (His246α). [7] Этот остаток гистидина фосфорилируется во время этапа образования сукцината в механизме реакции. Точное место связывания сукцината не определено. [9] Образование нуклеотидтрифосфата происходит в домене захвата АТФ , который расположен вблизи N-конца каждой β-субъединицы. Однако этот домен захвата расположен примерно в 35 Å от фосфорилированного остатка гистидина. [8] Это заставляет исследователей полагать, что фермент должен претерпеть существенное изменение конформации , чтобы перенести гистидин в домен захвата и облегчить образование нуклеозидтрифосфата. Эксперименты по мутагенезу показали, что два остатка глутамата (один около каталитического гистидина, Glu208α, и один около домена захвата АТФ, Glu197β) играют роль в фосфорилировании и дефосфорилировании гистидина, но точный механизм, посредством которого фермент изменяет конформацию, до конца не изучен. [9]
Изоформы
Джонсон и др. описывают две изоформы сукцинил-КоА-синтетазы у амниот : одна из них отвечает за синтез АТФ, а другая — за синтез ГТФ. [10]
У амниот фермент представляет собой гетеродимер α- и β-субъединицы. Специфичность для аденозин- или гуанозинфосфата определяется β-субъединицей, [10] которая кодируется 2 генами. SUCLG2 является ГТФ-специфическим, а SUCLA2 — АТФ-специфическим, в то время как SUCLG1 кодирует общую α-субъединицу. Варианты β вырабатываются в разных количествах в разных тканях, [10] вызывая потребность в субстрате ГТФ или АТФ .
В основном потребляющие ткани, такие как сердце и мозг, имеют более АТФ-специфическую сукцинил-КоА-синтетазу (ATPSCS), в то время как синтетические ткани, такие как почки и печень, имеют более ГТФ-специфическую форму (GTPSCS). [11] Кинетический анализ ATPSCS из грудной мышцы голубей и GTPSCS из печени голубей показал, что их кажущиеся константы Михаэлиса были схожи для CoA, но различались для нуклеотидов, фосфата и сукцината. Наибольшее различие было для сукцината: K m app для ATPSCS = 5 мМ по сравнению с GTPSCS = 0,5 мМ. [10]
Функция
Образование нуклеотидтрифосфатов
SCS — единственный фермент в цикле лимонной кислоты, который катализирует реакцию, в которой нуклеотидтрифосфат (ГТФ или АТФ) образуется путем фосфорилирования на уровне субстрата . [4] Исследования показали, что SCS E. coli могут катализировать образование как ГТФ, так и АТФ. [7] Однако млекопитающие обладают различными типами SCS, которые специфичны либо для ГТФ (G-SCS), либо для АТФ (A-SCS) и являются родными для различных типов тканей в организме. Интересное исследование с использованием клеток голубей показало, что ГТФ-специфичные SCS были расположены в клетках печени голубей, а АТФ-специфичные SCS были расположены в клетках грудных мышц голубей. [12] Дальнейшие исследования выявили схожий феномен ГТФ и АТФ-специфичных SCS в тканях крысы, мыши и человека. Похоже, что ткани, обычно участвующие в анаболическом метаболизме (например, печень и почки), экспрессируют G-SCS, тогда как ткани, участвующие в катаболическом метаболизме (например, мозг, сердце и мышечная ткань), экспрессируют A-SCS. [11]
Образование промежуточных продуктов метаболизма
SCS облегчает поток молекул в другие метаболические пути , контролируя взаимопревращение между сукцинил-КоА и сукцинатом. [13] Это важно, поскольку сукцинил-КоА является промежуточным соединением, необходимым для биосинтеза порфирина , гема , [14] и кетоновых тел . [15]
Регуляция и торможение
У некоторых бактерий фермент регулируется на уровне транскрипции. [16] Было показано, что ген SCS (sucCD) транскрибируется вместе с геном α-кетоглутаратдегидрогеназы (sucAB) под контролем промотора, называемого sdhC, который является частью оперона сукцинатдегидрогеназы . Этот оперон активируется присутствием кислорода и реагирует на различные источники углерода. Антибактериальные препараты , которые предотвращают фосфорилирование гистидина, такие как молекула LY26650, являются мощными ингибиторами бактериальных SCS. [17]
Оптимальная активность
Измерения (проведенные с использованием соевого SCS) указывают на оптимальную температуру 37 °C и оптимальный pH 7,0-8,0. [18]
Роль в заболевании
Фатальный младенческий лактоацидоз: дефектный SCS был вовлечен в качестве причины фатального младенческого лактоацидоза , заболевания у младенцев, которое характеризуется накоплением токсичных уровней молочной кислоты. Состояние (когда оно наиболее тяжелое) приводит к смерти, как правило, в течение 2–4 дней после рождения. [19] Было установлено, что у пациентов с этим состоянием наблюдается делеция двух пар оснований в гене, известном как SUCLG1, который кодирует α-субъединицу SCS. [19] В результате функциональный SCS отсутствует в метаболизме, вызывая значительный дисбаланс в потоке между гликолизом и циклом лимонной кислоты. Поскольку клетки не имеют функционального цикла лимонной кислоты, ацидоз возникает, потому что клетки вынуждены выбирать производство молочной кислоты в качестве основного средства производства АТФ.
Смотрите также
- Цикл лимонной кислоты
- Сукцинатдегидрогеназа
- Сукцинат—КоА-лигаза (АДФ-образующая)
- Сукцинат—КоА-лигаза (GDP-образующая)
Ссылки
- ^ Fraser ME, Hayakawa K, Hume MS, Ryan DG, Brownie ER (апрель 2006 г.). «Взаимодействие GTP с доменом захвата АТФ GTP-специфической сукцинил-КоА-синтетазы». Журнал биологической химии . 281 (16): 11058–65. doi : 10.1074/jbc.M511785200 . PMID 16481318.
- ^ Fraser ME, James MN, Bridger WA, Wolodko WT (январь 1999). «Подробное структурное описание сукцинил-КоА-синтетазы Escherichia coli». Журнал молекулярной биологии . 285 (4): 1633–53. doi :10.1006/jmbi.1998.2324. PMID 9917402.
- ^ ab Voet, Дональд Дж. (2011). Биохимия / Дональд Дж. Воэт; Джудит Г. Воэт . Нью-Йорк, штат Нью-Йорк: Wiley, J. ISBN 978-0-470-57095-1.
- ^ abc Берг, Джереми М. (Jeremy M.); Тимочко, Джон Л.; Страйер, Любер.; Страйер, Любер. Биохимия. (2002). Biochemistr . Нью-Йорк: WH Freeman. С. 475–477. ISBN 0-7167-3051-0.
- ^ Nishimura JS (1986). "Succinyl-CoA synthetase structure-function relationships and other considerations". Advances in Enzymology and Related Areas of Molecular Biology . Advances in Enzymology and Related Areas of Molecular Biology. Vol. 58. pp. 141–72. doi :10.1002/9780470123041.ch4. ISBN 9780470123041. PMID 3521216.
- ^ abc Wolodko WT, Kay CM, Bridger WA (сентябрь 1986 г.). «Активное осаждение ферментов, скорость осаждения и исследования равновесия осаждения сукцинил-КоА-синтетаз свиного сердца и Escherichia coli». Биохимия . 25 (19): 5420–5. doi :10.1021/bi00367a012. PMID 3535876.
- ^ abc Fraser ME, James MN, Bridger WA, Wolodko J (май 1999). "Подробное структурное описание синтетазы escherichia coli succinly-CoA". Журнал молекулярной биологии . 288 (3): 501. doi : 10.1006/jmbi.1999.2773 . PMID 10329157.
- ^ ab Joyce MA, Fraser ME, James MN, Bridger WA, Wolodko WT (январь 2000 г.). "Сайт связывания АДФ сукцинил-КоА-синтетазы Escherichia coli, выявленный с помощью рентгеновской кристаллографии". Биохимия . 39 (1): 17–25. doi :10.1021/bi991696f. PMID 10625475.
- ^ ab Fraser ME, Joyce MA, Ryan DG, Wolodko WT (январь 2002 г.). «Два остатка глутамата, Glu 208 альфа и Glu 197 бета, имеют решающее значение для фосфорилирования и дефосфорилирования остатка гистидина активного центра в сукцинил-КоА-синтетазе». Биохимия . 41 (2): 537–46. doi :10.1021/bi011518y. PMID 11781092.
- ^ abcd Johnson JD, Mehus JG, Tews K, Milavetz BI, Lambeth DO (октябрь 1998 г.). «Генетические доказательства экспрессии АТФ- и ГТФ-специфических сукцинил-КоА-синтетаз у многоклеточных эукариот». Журнал биологической химии . 273 (42): 27580–6. doi : 10.1074/jbc.273.42.27580 . PMID 9765291.
- ^ ab Lambeth DO, Tews KN, Adkins S, Frohlich D, Milavetz BI (август 2004 г.). «Экспрессия двух сукцинил-КоА-синтетаз с различной нуклеотидной специфичностью в тканях млекопитающих». Журнал биологической химии . 279 (35): 36621–4. doi : 10.1074/jbc.M406884200 . PMID 15234968.
- ^ Джонсон Дж. Д., Мухонен WW, Ламбет ДО (октябрь 1998 г.). «Характеристика АТФ- и ГТФ-специфических сукцинил-КоА-синтетаз у голубей. Ферменты включают одну и ту же альфа-субъединицу». Журнал биологической химии . 273 (42): 27573–9. doi : 10.1074/jbc.273.42.27573 . PMID 9765290.
- ^ Лаббе РФ, Курумада Т, Онисава Дж (декабрь 1965 г.). «Роль сукцинил-КоА-синтетазы в контроле биосинтеза гема». Biochimica et Biophysical Acta (BBA) – Общие предметы . 111 (2): 403–15. дои : 10.1016/0304-4165(65)90050-4. ПМИД 5879477.
- ^ Ottaway JH, McClellan JA, Saunderson CL (1981). «Янтарная тиокиназа и метаболический контроль». Международный журнал биохимии . 13 (4): 401–10. doi :10.1016/0020-711x(81)90111-7. PMID 6263728.
- ^ Jenkins TM, Weitzman PD (сентябрь 1986 г.). «Отдельные физиологические роли животных сукцинаттиокиназ. Связь гуаниннуклеотидсвязанной сукцинаттиокиназы с утилизацией кетоновых тел». FEBS Letters . 205 (2): 215–8. doi : 10.1016/0014-5793(86)80900-0 . PMID 2943604. S2CID 23667115.
- ^ Круспль В., Штрайтманн Б. (февраль 1975 г.). «[Узловатый ретикулез с келоидными образованиями]». Zeitschrift für Hautkrankheiten . 50 (3): 117–25. ПМИД 179232.
- ^ Hunger-Glaser I, Brun R, Linder M, Seebeck T (май 1999). «Ингибирование фосфорилирования гистидина сукцинил-КоА-синтетазы у Trypanosoma brucei ингибитором бактериальных двухкомпонентных систем». Молекулярная и биохимическая паразитология . 100 (1): 53–9. doi :10.1016/s0166-6851(99)00032-8. PMID 10376993.
- ^ Wider de Xifra E, del C Batlle AM (март 1978 г.). «Биосинтез порфиринов: иммобилизованные ферменты и лиганды. VI. Исследования сукцинил-КоА-синтетазы из культивируемых клеток сои». Биохимика и биофизика Acta . 523 (1): 245–9. дои : 10.1016/0005-2744(78)90027-x. ПМИД 564714.
- ^ ab Ostergaard E, Christensen E, Kristensen E, Mogensen B, Duno M, Shoubridge EA, Wibrand F (август 2007 г.). «Дефицит альфа-субъединицы сукцинат-коэнзима А-лигазы вызывает фатальный младенческий лактатацидоз с истощением митохондриальной ДНК». American Journal of Human Genetics . 81 (2): 383–7. doi :10.1086/519222. PMC 1950792 . PMID 17668387.
Внешние ссылки
- Сукцинил+Коэнзим+А+Синтетазы в рубриках медицинских предметов Национальной медицинской библиотеки США (MeSH)