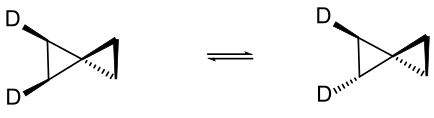Спиропентан
 | |
 | |
| Имена | |
|---|---|
| Предпочтительное название ИЮПАК Спиро[2.2]пентан | |
| Идентификаторы | |
3D модель ( JSmol ) |
|
| ChemSpider |
|
CID PubChem |
|
Панель инструментов CompTox ( EPA ) |
|
| |
| |
| Характеристики | |
| С 5 Н 8 | |
| Молярная масса | 68,119 г·моль −1 |
| Температура плавления | −134,6 °C (−210,3 °F; 138,6 К) |
| Точка кипения | 39,0 °C (102,2 °F; 312,1 К) |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |
Спиропентан — углеводород с формулой C 5 H 8 . Это простейший спиросвязанный циклоалкан , триангулан . [1] [2] [3] [ 4] Прошло несколько лет после открытия в 1887 году, прежде чем была определена структура молекулы. [5] [6] [7] Согласно правилам номенклатуры для спиросоединений, систематическое название — спиро[2.2]пентан. Однако конститутивных изомерных спиропентанов быть не может , поэтому название уникально без скобок и цифр.
Синтез
После того, как Густавсон получил циклопропан путем реакции 1,3-дибромпропана с измельченным металлическим цинком, он попробовал провести ту же реакцию с 2,2-бис(бромметил)-1,3-дибромпропаном (см. схему формулы). Исходный материал легко получить путем реакции пентаэритрита с бромистоводородной кислотой . Была получена молекула с формулой C5H8 . В первоначальной публикации она была названа винилтриметиленом. [8] В 1907 году Фехт высказал предположение, что это должен быть спиропентан, конституционный изомер винилциклопропана. [9] Дальнейшие доказательства структуры углеводорода исходят из того факта, что его также можно получить из 1,1-бис(бромметил)-циклопропана (см. схему формулы). [10]
Спиропентан трудно отделить от других продуктов реакции, и ранние процедуры приводили к нечистым смесям. Спустя десятилетия метод производства был усовершенствован. Спироуглеводород можно отделить от побочных продуктов (2-метил-1-бутен, 1,1-диметилциклопропан, метиленциклобутан) путем перегонки . [11]
Характеристики
Физические свойства
Структурное определение методом электронной дифракции показало две различные длины CC; связи с четвертичным («спиро») атомом углерода короче (146,9 пм), чем связи между метиленовыми группами (CH 2 –CH 2 , 151,9 пм). Углы C–C–C на спироатоме C составляют 62,2°, больше, чем в циклопропане . [12]
Химические свойства
При нагревании молекул спиропентана, меченных атомами дейтерия, наблюдается реакция топомеризации или «стереомутации», аналогичная реакции циклопропана: цис -1,2-дидейтериоспиропентан уравновешивается транс -1,2-дидейтериоспиропентаном. [13]
Густавсон (1896) сообщил, что нагревание спиропентана до 200 °C привело к его превращению в другие углеводороды. Термолиз в газовой фазе от 360 до 410 °C привел к расширению кольца до конституционного изомера метиленциклобутана, вместе с продуктами фрагментации этена и пропадиена . [14] Предположительно, более длинная и слабая связь разрывается первой, образуя бирадикальное промежуточное соединение. [13]
Родственные соединения
Ссылки
- ^ Донохью, Джерри; Хамфри, Джордж Л.; Шомакер, Вернер (1945). «Структура спиропентана». Журнал Американского химического общества . 67 (2): 332– 335. doi :10.1021/ja01218a056. ISSN 0002-7863.
- ^ Мюррей, М. Дж.; Стивенсон, Юджин Х. (1944). «СПИРОПЕНТАН». Журнал Американского химического общества . 66 (2): 314. doi :10.1021/ja01230a515. ISSN 0002-7863.
- ^ Мюррей, М. Дж.; Стивенсон, Юджин Х. (1944). «Дебромирование пентаэритритилбромида цинком. Выделение спиропентана1». Журнал Американского химического общества . 66 (5): 812– 816. doi :10.1021/ja01233a047. ISSN 0002-7863.
- ^ Price, JE; Coulterpark, KA; Masiello, T.; Nibler, JW; Weber, A.; Maki, A.; Blake, TA (2011). "Высокоразрешающие инфракрасные спектры спиропентана, C5H8". Журнал молекулярной спектроскопии . 269 (1): 129– 136. Bibcode : 2011JMoSp.269..129P. doi : 10.1016/j.jms.2011.05.011. ISSN 0022-2852.
- ^ Филипов, О. (1916). «Die Konstitution der Kohlenwassersstoffe Gustavsons: Винилтриметилен и Этилидентриметилен». Журнал практической химии . 93 (1): 162–182 . doi :10.1002/prac.19160930112. ISSN 0021-8383.
- ^ Фаворски, Ал.; Баталин, В. (1914). «Über das Vinyltrimethylen und Äthyliden-trimethylen von Gustavson». Berichte der Deutschen Chemischen Gesellschaft . 47 (2): 1648–1651 . doi :10.1002/cber.19140470250. ISSN 0365-9496.
- ^ Бернс, GR; МакГэвин, DG (1972). "Инфракрасные и рамановские спектры спиропентана-H8". Прикладная спектроскопия . 26 (5): 540– 542. Bibcode : 1972ApSpe..26..540B. doi : 10.1366/000370272774351778. S2CID 95384874.
- ^ Густавсон, Г. (1896). «Уэбер Этилидентриметилен». Журнал практической химии . 54 (1): 104–107 . doi :10.1002/prac.18960540106. ISSN 0021-8383.
- ^ Фехт, Х. (1907). «Убер спироциклан». Berichte der Deutschen Chemischen Gesellschaft . 40 (3): 3883–3891 . doi :10.1002/cber.190704003194. ISSN 0365-9496.
- ^ Зелинский, Н. (1913). «Über das Spirocyclan, seine Synthese und sein Verhalten bei der Reduktionskatalyse». Berichte der Deutschen Chemischen Gesellschaft . 46 (1): 160–172 . doi :10.1002/cber.19130460128. ISSN 0365-9496.
- ^ Applequist, Douglas E.; Fanta, George F.; Henrikson, Bertel W. (1958). «Химия спиропентана. I. Улучшенный синтез спиропентана». Журнал органической химии . 23 (11): 1715– 1716. doi :10.1021/jo01105a037. ISSN 0022-3263.
- ^ Г. Даллинга, Р.К. ван дер Драай, Л.Х. Тонеман, Recueil des Travaux Chimiques des Pays-Bas 87, 897 (1968).
- ^ ab JJ Gajewski, LT Burka, Журнал Американского химического общества 94, Nr. 25, 8857 (1972).
- ^ М. К. Флауэрс, Х. М. Фрей, Журнал химического общества , 1961, 5550.