Сомитогенез
| Сомитогенез | |
|---|---|
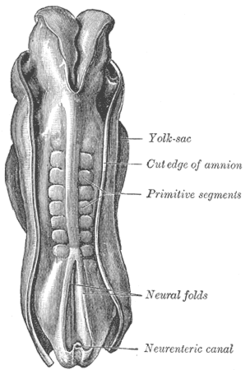 Дорсум человеческого эмбриона, длина 2,11 мм. (Старый термин «примитивные сегменты» используется для обозначения сомитов, образующихся в процессе сомитогенеза) | |
| Подробности | |
| Предшественник | параксиальная мезодерма |
| Дает начало | дерматом , миотом , синдетом, склеротом |
| Анатомическая терминология [править на Wikidata] | |
Сомитогенез — это процесс формирования сомитов . Сомиты — это билатерально парные блоки параксиальной мезодермы , которые формируются вдоль передне-задней оси развивающегося эмбриона у сегментированных животных . У позвоночных сомиты дают начало скелетным мышцам, хрящам , сухожилиям , эндотелию и дерме .
Обзор
В сомитогенезе сомиты формируются из параксиальной мезодермы , особой области мезодермы в нейрулирующем эмбрионе. Эта ткань подвергается конвергентному расширению по мере регресса первичной полоски или гаструляции эмбриона . Хорда простирается от основания головы до хвоста; вместе с ней простираются толстые полосы параксиальной мезодермы. [1]
По мере того, как примитивная полоска продолжает регрессировать, сомиты формируются из параксиальной мезодермы путем "отпочкования" рострально, когда сомитомеры , или завитки клеток параксиальной мезодермы, уплотняются и разделяются на отдельные тельца. Периодическая природа этих событий расщепления заставила многих утверждать, что сомитогенез происходит посредством модели часового волнового фронта, в которой волны сигналов развития вызывают периодическое образование новых сомитов.
Эти незрелые сомиты затем уплотняются во внешний слой (эпителий) и внутреннюю массу ( мезенхиму ).
Сами сомиты классифицируются в соответствии с их местоположением, так как сегментарная параксиальная мезодерма, из которой они образуются, сама определяется положением вдоль передне-задней оси до сомитогенеза.
Клетки внутри каждого сомита определяются на основе их расположения внутри сомита. Кроме того, они сохраняют способность становиться любой структурой, производной от сомита, до относительно позднего этапа процесса сомитогенеза. [2]
Сигнализация
Периодичность
Как только клетки пресомитной мезодермы оказываются на месте после миграции клеток во время гаструляции, в этих клетках начинается колебательная экспрессия многих генов, как будто регулируемая «часами» развития. Как упоминалось ранее, это привело многих к выводу, что сомитогенез координируется механизмом «часов и волн» .
С технической точки зрения это означает, что сомитогенез происходит из-за в значительной степени клеточно-автономных колебаний сети генов и генных продуктов, что заставляет клетки колебаться между пермиссивным и непермиссивным состоянием в последовательно синхронизированной манере, как часы. Эти гены включают членов семейства FGF , пути Wnt и Notch , а также мишени этих путей. Волновой фронт медленно продвигается в направлении сзади вперед. Когда волновой фронт сигнала вступает в контакт с клетками в пермиссивном состоянии, они подвергаются эпителиально-мезенхимальному переходу и отщепляются от более задней пресомитной мезодермы, образуя границу сомита и переустанавливая процесс для следующего сомита. [3]
В частности, циклическая активация пути Notch, по-видимому, имеет большое значение в модели волнового фронта-часов. Было высказано предположение, что активация Notch циклически активирует каскад генов, необходимых для отделения сомитов от основного параксиального тела. Это контролируется разными способами у разных видов, например, через простую отрицательную обратную связь у данио-рерио или в сложном процессе, в котором часы FGF и Wnt влияют на часы Notch, как у цыплят и мышей. [4] [5] Однако модель сегментационных часов в высокой степени эволюционно консервативна. [6]
Внутренняя экспрессия «часового гена» должна колебаться с периодичностью, равной времени, необходимому для формирования одного сомита, например, 30 минут у данио-рерио, 90 минут у цыплят и 100 минут у змей. [7]
Генные колебания в пресомитных клетках в значительной степени, но не полностью, являются клеточно-автономными. Когда сигнализация Notch нарушается у данио-рерио, соседние клетки больше не колеблются синхронно, что указывает на то, что сигнализация Notch важна для поддержания синхронности соседних популяций клеток. [8] Кроме того, некоторая клеточная взаимозависимость была продемонстрирована в исследованиях, касающихся белка Sonic hedgehog (Shh) в сомитогенезе. Хотя не сообщалось о том, что экспрессия белков пути Shh колеблется в пресомитной мезодерме, они экспрессируются в пресомитной мезодерме во время сомитогенеза. Когда хорда удаляется во время сомитогенеза у куриного эмбриона, формируется надлежащее количество сомитов, но сегментационные часы задерживаются для задних двух третей сомитов. Передние сомиты не затрагиваются. В одном исследовании этот фенотип был имитирован ингибиторами Shh, а своевременное формирование сомита было восстановлено экзогенным белком Shh, что показало, что отсутствующий сигнал, производимый хордой, опосредован Shh. [9]
Сигнализация при разделении и эпителизации сомитов
Физическое разделение сомитов зависит от оттягивания клеток друг от друга и образования границ и новых спаек между различными клетками. Исследования указывают на важность путей, включающих рецептор Eph и семейство белков Ephrin , которые координируют формирование границ, в этом процессе. Кроме того, фибронектины и кадгерины помогают соответствующим клеткам локализоваться друг с другом. [10] [11]
Спецификация и дифференциация
Что касается параксиальной мезодермы, из которой формируются сомиты, эксперименты по картированию судьбы на стадии бластулы показывают наличие пресомитных мезодермальных предшественников в месте гаструляции, называемом у некоторых организмов первичной полоской, в областях, фланкирующих организатора. Эксперименты по трансплантации показывают, что только на поздней стадии гаструлы эти клетки привержены параксиальной судьбе, что означает, что определение судьбы строго контролируется локальными сигналами и не предопределено. Например, воздействие на пресомитную мезодерму костных морфогенетических белков (BMP) вентрализует ткань, однако in vivo антагонисты BMP, секретируемые организатором (такие как Noggin и chordin), предотвращают это и, таким образом, способствуют формированию дорсальных структур. [12]
Прекращение сомитогенеза
В настоящее время неизвестно, каким именно механизмом завершается сомитогенез. Одним из предлагаемых механизмов является массовая гибель клеток в самых задних клетках параксиальной мезодермы, в результате чего эта область не может формировать сомиты. [13] [14] Другие предполагают, что ингибирование сигнализации BMP с помощью Noggin , целевого гена Wnt, подавляет эпителиально-мезенхимальный переход, необходимый для отделения сомитов от полос пресомитной мезодермы, и таким образом завершает сомитогенез. [15] Хотя эндогенная ретиноевая кислота требуется у высших позвоночных для ограничения каудального домена Fgf8, необходимого для сомитогенеза в туловище (но не в хвосте), некоторые исследования также указывают на возможную роль ретиноевой кислоты в завершении сомитогенеза у позвоночных, у которых отсутствует хвост (человек) или есть короткий хвост (цыпленок). [16] Другие исследования предполагают, что прекращение может быть вызвано дисбалансом между скоростью формирования сомита и ростом пресомитной мезодермы, простирающейся в эту область хвоста. [17]
Сомитогенез у разных видов
У разных видов разное количество сомитов. Например, у лягушек их около 10, у людей — 37, у цыплят — 50, у мышей — 65, а у змей — более 300, вплоть до 500.
Число сомитов не зависит от изменений размера эмбриона в ходе экспериментальной процедуры. Поскольку все развивающиеся эмбрионы определенного вида образуют одинаковое число сомитов, число присутствующих сомитов обычно используется в качестве ориентира для возраста развивающихся позвоночных. [18] [19]
Ссылки
- ^ Гилберт, СФ (2010). Биология развития (9-е изд.). Sinauer Associates, Inc. стр. 413–415 . ISBN 978-0-87893-384-6.
- ^ Гилберт, СФ (2010). Биология развития (9-е изд.). Sinauer Associates, Inc. стр. 413–415 . ISBN 978-0-87893-384-6.
- ^ Бейкер, RE ; Шнелл, S.; Майни, PK (2006). «Часовой и волновой механизм формирования сомита». Developmental Biology . 293 (1): 116–126 . doi : 10.1016/j.ydbio.2006.01.018 . PMID 16546158.
- ^ Goldbeter, A.; Pourquié, O. (2008). «Моделирование сегментационных часов как сети связанных колебаний в сигнальных путях Notch, Wnt и FGF». Журнал теоретической биологии . 252 (3): 574–585 . Bibcode : 2008JThBi.252..574G. doi : 10.1016/j.jtbi.2008.01.006. PMID 18308339.
- ^ Гилберт, СФ (2010). Биология развития (9-е изд.). Sinauer Associates, Inc. стр. 413–415 . ISBN 978-0-87893-384-6.
- ^ Крол, AJ; Руллиг, Д.; Декеант, М.-Л.; Тасси, О.; Глинн, Э.; Хаттем, Г.; Мушегян А.; Оутс, AC; Пурке, О. (2011). «Эволюционная пластичность сетей часов сегментации». Разработка . 138 (13): 2783–2792 . doi :10.1242/dev.063834. ПМК 3109603 . ПМИД 21652651.
- ^ Гомес, К. и др. (2008). «Контроль числа сегментов у эмбрионов позвоночных». Nature . 454 (7202): 335– 339. Bibcode :2008Natur.454..335G. doi :10.1038/nature07020. PMID 18563087. S2CID 4373389.
- ^ Jiang, Y et al. 2000 (2000). «Notch signaling and the synchronize of the somite segmentation clock». Nature . 408 (6811): 475– 479. Bibcode :2000Natur.408..475J. doi :10.1038/35044091. PMID 11100729. S2CID 1182831.
{{cite journal}}: CS1 maint: числовые имена: список авторов ( ссылка ) - ^ Resende, TP; et al. (2010). «Sonic hedgehog in temporal control of somite formation» (Звуковой еж во временном контроле формирования сомитов). Proc Natl Acad Sci USA . 107 (29): 12907– 12912. Bibcode : 2010PNAS..10712907R. doi : 10.1073/pnas.1000979107 . PMC 2919945. PMID 20615943 .
- ^ Pourquié, O. (2001). «Vertebratesomitogenesis». Annual Review of Cell and Developmental Biology . 17 : 311– 350. doi :10.1146/annurev.cellbio.17.1.311. PMID 11687492.
- ^ Гилберт, СФ (2010). Биология развития (9-е изд.). Sinauer Associates, Inc. стр. 413–415 . ISBN 978-0-87893-384-6.
- ^ Пуркье, О. (2001). «Сомитогенез позвоночных». Анну. Преподобный Cell Dev. Биол . 17 : 311–50 . doi : 10.1146/annurev.cellbio.17.1.311. ПМИД 11687492.
- ^ Сандерс, Э.Дж.; Кхаре, МК; Оои, ВК; Беллэрс, Р. (1986). «Экспериментальный и морфологический анализ мезенхимы хвостовой почки куриного эмбриона». Анатомия и эмбриология . 174 (2): 179– 185. doi :10.1007/bf00824333. PMID 3740453. S2CID 26289320.
- ^ Миллс, CL; Беллэрс, Р. (1989). «Митоз и гибель клеток в хвосте куриного эмбриона». Анатомия и эмбриология . 180 (3): 301–308 . doi :10.1007/bf00315888. PMID 2596707. S2CID 1318372.
- ^ Охта, С.; Сузуки, К.; Тачибана, К.; Танака, Х.; Ямада, Г. (2007). «Прекращение гаструляции опосредовано подавлением эпителиально-мезенхимального перехода на вентральном эктодермальном гребне». Развитие . 134 (24): 4315– 4324. doi : 10.1242/dev.008151 . hdl : 2298/10388 . PMID 18003744.
- ^ Каннингем, Т.Дж.; Дьюстер, Г. (2015). «Механизмы сигнализации ретиноевой кислоты и ее роль в развитии органов и конечностей». Nat. Rev. Mol. Cell Biol . 16 (2): 110– 123. doi :10.1038/nrm3932. PMC 4636111. PMID 25560970 .
- ^ Тенин, Г.; Райт, Д.; Ферженцик, З.; Боун, Р.; МакГрю, М.Дж.; Марото, М. (2010). «Осциллятор сомитогенеза цыпленка останавливается до того, как вся параксиальная мезодерма сегментируется на сомиты». BMC Developmental Biology . 10 : 24. doi : 10.1186/1471-213X-10-24 . PMC 2836991 . PMID 20184730.
- ^ Гомес, К. и др. (2008). «Контроль числа сегментов у эмбрионов позвоночных». Nature . 454 (7202): 335– 339. Bibcode :2008Natur.454..335G. doi :10.1038/nature07020. PMID 18563087. S2CID 4373389.
- ^ Гилберт, СФ (2010). Биология развития (9-е изд.). Sinauer Associates, Inc. стр. 413–415 . ISBN 978-0-87893-384-6.